Auf der Suche nach der besten Behandlung
Bericht:
Dr. Lydia Unger-Hunt
Das diesjährige Treffen der European Society for Blood and Marrow Transplantation (EBMT) bot einen breiten Überblick über pathophysiologische Prozesse sowie aktuelle und zukünftige Therapieoptionen, unter anderem für die Behandlung des multiplen Myeloms, des B-Zell-Lymphoms und der Graft-versus-Host-Reaktion. Auch den psychologischen Komponenten in der Betreuung von Patienten und deren Angehörigen wurde verhältnismäßig viel Platz eingeräumt.
Ein Update zur Pathophysiologie der chronischen Graft-versus-Host-Disease (cGVHD) gibt Univ.-Prof. Dr. Ernst Holler von der Universität Regensburg. So ist mittlerweile klar, dass Patienten nach Transplantation peripherer Blutzellen (PBCT) eine höhere GVHD-Inzidenz haben als Patienten nach Knochenmarkstransplantation („bone marrow transplantation“, BMT).1 T-Zellen sind hier entscheidend: Bei Stammmzellen des Peripher-Bluts (PBSC) liegt eine höhere T-Zell-Zahl vor, und bei früher In-vivo-Intervention durch „anti-Thymozyten-Globulin“(ATG)-Serotherapie ist die Anzahl der T-Zellen depletiert. Somit wird die Inzidenz sowohl der akuten als auch der chronischen GVHD vermindert.2 Zu den weiteren wichtigen klinischen Risikofaktoren zählt das Alter: Patienten über 20 Jahre haben bereits ein doppelt so hohes Risiko für GVHD wie Jüngere mit besserer thymischer Funktion.3 Zudem scheint die Schädigung des Thymus die Erholung naiver regulatorischer T-Zellen zu verhindern, die wiederum bei der Prävention von GVHD wirksam sein können.4
B-Zellen beziehungsweise deren Dysfunktion sind ein weiterer wichtiger Faktor bei cGVHD. Ereignisse, die zu B-Zell-Dysfunktion führen, treten bereits früh nach der Transplantation auf: In den ersten zwei bis drei Monaten ist eine hohe Ratio von B-Zell-aktivierendem Faktor (BAFF) zu B-Zellen zu beobachten. „Dies fördert die Entwicklung aberranter B-Zellen und auch der T-follikulären Helferzellen (TFH), die die B-Zell-Antwort und damit die (Auto)-Antikörperproduktion regulieren“, erklärt Prof. Holler.5 Diese Entwicklung scheint auf eine Zerstörung der B-Zellen-Nische im Knochenmark durch eine akute GVHD zurückzuführen zu sein. Eine Blockade aller B-Zellen sei allerdings nicht die Antwort: „Wir haben mehr und mehr Daten, dass regulatorische B-Zellen eine wichtige Rolle in der Downregulierung von Immunreaktionen spielen. Subpopulationen von Il-10+ B-Zellen beispielsweise sind im Nabelschnurblut angereichert und könnten nach entsprechender Nabelschnurbluttransplantation einen Schutz vor cGVHD bieten.“6
Neue therapeutische Zielstrukturen beim multiplen Myelom
40% der Patienten mit multiplem Myelom (MM) brauchen mehr als zwei Therapielinien, gleichzeitig zeigt Real-World-Evidenz einen Anstieg von Behandlungsresistenzen sowie zunehmend schlechte Überlebensraten mit der Anzahl der eingesetzten Therapien, berichtet Ass. Prof. Dr. Dr. Elena Zamagni von der Universität Bologna. Real-World-progressionsfreies-Überleben (PFS) und Gesamtüberleben (OS) sinken zwischen der Erst- bis Viertlinientherapie um jeweils 75,8 beziehungsweise 83,8%.7 Für bessere Outcomes und einen wirklichen klinischen Benefit seien daher „neue Strategien mit unterschiedlichen Zielstrukturen und/oder Wirkmechanismen“ erforderlich, so die italienische Onkologin.
Einige der mittlerweile bekannten Resistenzmechanismen wie etwa Überexpression von Genen und Mutationen, die zu Apoptoseresistenz führen, abnormer Wirkstofftransport oder verlängertes Überleben der Krebsstammzellen könnten gleichzeitig auch potenzielle therapeutische Zielstrukturen darstellen.
Selinexor ist ein First-in-Class-selektiver Inhibitor des nukleären Exports (SINE), der spezifisch Exportin 1 (XPO1) blockiert, welches wiederum Tumorsuppressorgene inaktiviert. Die XPO1-Hemmung durch Selinexor führt zur Reaktivierung multipler Tumorsuppressor-Proteine und blockiert die Onkoprotein-Translation sowie die Reparatur von DNA-Schäden.8
Venetoclax ist ein selektiver Inhibitor des antiapoptotischen B-Zell-Lymphom(BCL)-2-Proteins, dessen Überexpression das Überleben von MM-Zellen fördern kann.9 Die erhöhte Expression von BCL-2 spielt eine wichtige Rolle in der MM-Tumorgenese und im Ansprechen auf die Behandlung.10 Prof. Zamagni: „MM-Zellen mit einer (11;14)-Translokation sind für das Überleben sogar primär von BCL-2 abhängig, diese Patienten könnten daher besser auf diesen Therapiemechanismus reagieren.“11
Zudem berichtet Prof. Zamagni über neue immunmodulatorische Strategien. Derzeit sind „immunomodulatory imide drugs“ (IMiDs) verfügbar, die ihre Anti-MM-Aktivität über Cereblon (CRBN) vermitteln, ein Komponent des E3-Ligase-Komplexes. Der CRBN-E3-Ligasemodulator (CELMoD) CC-220 (ein Prüfpräparat) wiederum kooptiert CRBN, um eine verstärkte Degradierung von Zielproteinen wie den beiden Transkriptionsfaktoren Ikaros und Aiolos zu erlauben.12,13 Die möglichen Vorteile: CC-220 sowie ein weiterer CELMoD, CC92480, binden CRBN mit einer höheren Affinität als IMiDs; sie zeigten eine höhere Potenz in der Substratdegradierung; sie könnten über die CRBN-Downregulierung Resistenzen auf IMiDs überwinden; und CC-220 könnte mit einer geringeren Rate an Zytopenien assoziiert sein.14
Eine weitere vielversprechende Zielstruktur ist BCMA: Das „B-Zell-Maturations-Antigen“ wird hochselektiv auf malignen Plasmazellen von MM-Patienten exprimiert, eine Überexpression von BCMA in Myelomzellen verstärkt das Tumorwachstum und -überleben.15,16 BCMA wird derzeit über drei Strategien angegriffen: Anti-Drug-Konjugate, CAR(„chimeric antigen receptor“)-T-Zellen und bispezifische Antikörper, die alle drei „spezifische Vorteile und Herausforderungen“ mit sich bringen, so Prof. Zamagni.
CAR-T-Zellen vs. autologe Transplantation bei B-Zell-Lymphom
Für das chemosensitive relapsierend/rezidivierende diffuse großzellige B-Zell-Lymphom (r/r DLBCL) besteht der Standard of Care (SOC) in der Salvage-Therapie, gefolgt von der autologen hämatopoetischen Zelltransplantation (auto-HCT). „Für die Subgruppe der Patienten mit primär refraktärem DLBCL, die auf die Salvage-Therapie ansprechen, bietet die autoHCT eine anhaltende Krankheitskontrolle: Nach vier Jahren lag das ereignisfreie Überleben bei 40%, das OS bei 50%“, berichtet Dr. Rémy Duléry von der Sorbonne- Universität in Paris.17
Jedoch beträgt die therapiebedingte Mortalität („non-relapse mortality“, NRM) bei r/r Patienten fünf bis acht Prozent, und „nur wenige Patienten sind chemosensitiv gegenüber der Salvage-Therapie und gleichzeitig für eine Transplantation geeignet“, gibt der Experte zu bedenken.18 Insgesamt muss das langfristige Überleben nach auto-HCT bei primär refraktärem DLBCL oder bei DLBCL mit frühem Rezidiv daher als sehr schlecht bezeichnet werden.
CAR-T-Zellen haben die Behandlung revolutioniert und stellen mittlerweile den SOC für die Drittlinientherapie von r/r DLBCL dar. In der JULIET-Studie an 115 Patienten lag die komplette Ansprechrate (CR) unter Tisagenlecleucel bei 40%, das 3-Jahres-PFS bei 31%; in der ZUMA-1-Studie bei jeweils 58 beziehungsweise 44%.19,20 Real-World-Daten haben diese Ergebnisse klinischer Studien mittlerweile bestätigt.21 Eingeschränkt werden die Einsatzmöglichkeiten der CAR-T-Zell-Therapie durch die potenziell schweren Nebenwirkungen wie Zytokin-Freisetzungssyndrom und Neurotoxizität, jedoch sind diese Toxizitäten „laut Real-World-Daten bei fast allen Patienten reversibel“, kommentiert Dr. Duléry.
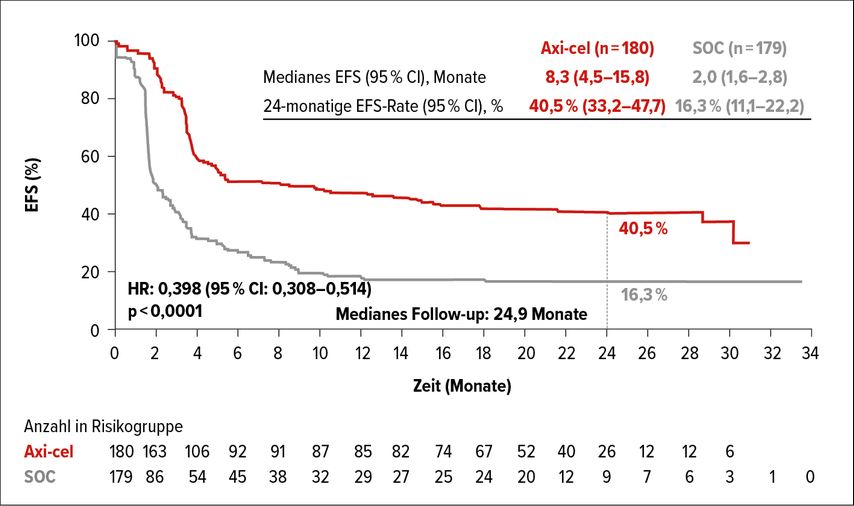
In der Zweitlinientherapie wurde kürzlich eine internationale Phase-III-Studie (ZUMA-7) zum Vergleich von CAR-T-Zell-Therapie (Axicabtagen-Ciloleucel, axi-cel) vs. SOC an rund 360 Patienten mit r/r DLBCL veröffentlicht (SOC = Chemoimmunotherapie, gefolgt von hochdosierter Chemotherapie mit autoSCT bei Patienten mit Ansprechen auf die Chemoimmunotherapie).22 Die CAR-T-Zell-Therapie war nach einem medianen Follow-up von knapp 25 Monaten mit signifikant überlegenen Ergebnissen assoziiert hinsichtlich Gesamtansprechen (83 vs. 50%, Odds Ratio [OR]: 5,31), während das ereignisfreie Überleben (EFS) median bei 8,3 vs. 2,0 Monate lag. Das 2-Jahres-Überleben lag bei jeweils 40,5 vs. 16,3% (Abb. 1). Signifikante Verlängerungen wurden auch beim OS beobachtet. Ähnliche Ergebnisse zeigten sich auch in einer Studie zu Lisocabtagen Maraleucel (liso-cel) vs. SOC in der Zweitlinientherapie von r/r DLBCL-Patienten.23 „Interessant ist, dass hier für Patienten unter liso-celauch in verschiedenen Bereichen der Lebensqualität ein günstiger Effekt vs. SOC nachgewiesen wurde“, so Dr. Duléry.24
Die Kunst der guten Kommunikation in der pädiatrischen Onkologie
„Der Wert guter Kommunikation steht außer Frage: Sie erhöht das Vertrauen in den behandelnden Arzt und verbessert zudem die Vorbereitung betroffener Familien für das Selbstmanagement der Betreuung zu Hause“, erinnert Ass. Prof. Dr. Bryan Sisk von der Washington University School of Medicine in St. Louis, Missouri.
Bei der Kommunikation schlechter Nachrichten an junge Patienten und deren Familien empfiehlt der Experte, keinen strikten Vorgaben zu folgen, sondern sich auf den Patienten und seine Situation einzustellen. „Das kann in manchen Fällen vielleicht sogar heißen, das Gespräch abzubrechen und das Zimmer zu verlassen – wie mir ein jugendlicher Patient mitteilte, war das die ‚beste Entscheidung‘, die zu diesem Zeitpunkt getroffen werden konnte. Ein ‚Wie fühlst du dich?‘ wäre das Gegenteil dessen gewesen, was er sich gewünscht hätte.“ Einem „Skript zu folgen“ hieße außerdem, Authentizität zu verlieren, und „Familien wissen ganz genau, wann wir aufrichtig sind und wann nicht“.
Trotz des hohen Stellenwerts einer authentischen, situationsangepassten Kommunikation gibt es grundlegende Punkte, die für den Großteil der Patienten bedeutsam sind:
-
Speziell bei pädiatrischen Patienten und deren Familien ist das Unterstützen der Hoffnung, wo möglich, sehr wichtig.25 Cave: Manche AYA(„adolescents and young adults“)-Patienten schicken ihre Eltern als ihre „Sprecher“ vor, um Fragen zu stellen. Prof. Sisk: „Das heißt aber nicht, dass AYA nicht zuhören, im Gegenteil.“
-
Die überwiegende Mehrheit von Eltern und AYA will alle Details wissen, einschließlich der Spätfolgen. „Wer Patienten prognostische Infos anbietet, bevor sie diese selbst erfragen müssen, wird als Arzt mit höherer Sensibilität gegenüber den Bedürfnissen des Patienten eingestuft.“26 Das bedeutet aber auch: Eine Minderheit von rund 13% möchte eben nicht alle Details wissen. Das zu erfragen, ist sehr wichtig.
-
In einer schwedischen Untersuchung gaben 87% der Eltern an, nicht ausreichend darüber informiert worden zu sein, wie sich die Krankheit auf die psychische Gesundheit ihres Kindes auswirken kann, und dass sie sich häufig nicht trauten, dieses Thema von sich aus anzusprechen.27 „Das sind Themen, die ein Onkologe nicht übernehmen kann, daher ist die Arbeit im Team so wichtig“, erklärt Prof. Sisk.
-
Grundlegende Eigenschaften einer guten Kommunikation sind: verständlich, sensibel, ehrlich, in einer angemessenen Geschwindigkeit sowie situationsangepasst; möglichst schriftliche Informationen zum Mitgeben bereithalten. Keine Annahmen, kein „Ich gehe davon aus, dass …“.
-
Am besten viel fragen: „Möchten Sie Zahlen, Daten, Fakten oder die Information eher vage, etwa ‚Diese Krebsform ist allgemein recht gut zu behandeln‘? Möchten Sie alle Infos jetzt auf einmal, oder lieber nach und nach? Wieviel möchte/soll das Kind wissen?“ Cave: Antworten auf diese Fragen können sich im Laufe der Zeit ändern.
-
Der Beginn des Gesprächs sollte sich immer auf die kurzfristige Information fokussieren: „Was machen wir jetzt?“28
Quelle:
48. Jahrestagung der European Society for Blood and Marrow Transplantation, 19.–23. März 2022, virtuell
Literatur:
1 Schmitz N et al.: Haematologica 2005; 90: 643-8 2 Finke J et al.: Lancet Oncol 2009; 10: 855-64 3 Atkinson K et al: Blood 1990; 75: 2459-64 4 Alho A et al.: Blood 2015; 127: 646-57 5 McManigle W et al.: Hum Immunol 2019; 80: 393-9 6 Sarvaria A et al.: Blood 2016; 128: 1346-61 7 Bruno AS et al.: Exp Rev Hematol 2020; 13: 1017-25 8 Sun Q et al.: Signal Transduct Target Ther 2016; 1: 16010 9 Punnoose E et al.: Mol Cancer Ther 2016; 15: 1132-44 10 Trudel S et al.: Clin Cancer Res 2007; 13: 621-9 11 Touzeau C et al.: Leukemia 2018; 32: 1899-907 12 Matyskiela M et al.: J Med Chem 2018; 61: 535-2 13 Bjorklund C et al.: Leukemia 2020; 34: 1197-1 14 Thakurta A et al.: Oncotarget 2021; 12: 1555-63 15 Caraccio C et al.: Front Immunol 2020; 11: 501 16 Cho S et al.: Front Immunol 2018; 9: 1821 17 Bal S et al.: Transplant Cell Ther 2021; 27: 55.e1-55.e7 18 Costa LJ et al.: Am J Hematol 2017; 92: 161-70 19 Schuster S et al.: NEJM 2019; 380: 45-56 20 Locke F et al.: Lancet Oncol 2019; 20: 31-42 21 Bachy E et al.: Abstract 92, ASH 2021 22 Locke F et al.: NEJM 2022; 386: 640-54 23 Kamdar M et al.: Abstract 91, ASH 2021 24 Abramson J et al.: Abstract 3845, ASH 2021 25 Sisk B et al.: Pediatrics 2020; Supp Care Cancer 2021 26 Sisk B et al.: JPall Med 2020; 23(3): 310-1 27 Lövgren M et al.: Pediatr Blood Cancer 2020; 67: e28735 28 Srinivas S et al.: Manuscript in Progress
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...