ASCO-Update 2021 zum metastasierten Kolorektalkarzinom
Autor:
Priv.-Doz. Ltd. OA Dr. Lukas Weiss, PhD
Universitätsklinik für Innere Medizin III
Paracelsus Medizinische Universität
Salzburg Cancer Research Institute (SCRI)
Cancer Cluster Salzburg
E-Mail: lu.weiss@salk.at
Der Fortschritt geht weiter – neben der Bestätigung von neuen Therapien in seltenen Subgruppen eröffnet vor allem die ctDNA-Analyse neue Möglichkeiten in der Therapie des metastasierten Kolorektalkarzinoms (mCRC).
Keypoints
-
Pembrolizumab wurde als Standard in der Erstlinientherapie des MSI-H- bzw. dMMR-mCRC bestätigt.
-
FU/LV und Panitumumab sind eine mögliche Erhaltungstherapie bei RAS/BRAF-Wildtyp-mCRC nach Erstlinien-Induktionstherapie mit FOLFOX und Panitumumab.
-
Die Anti-EGFR-Rechallenge kann nach entsprechender Präselektion ein hohes Ansprechen generieren.
-
Die ctDNA-Analyse hält auch beim mCRC Einzug.
-
Es gibt frühe Daten zu hoher klinischer Wirksamkeit von Trastuzumab Deruxtecan auch beim HER2+ mCRC.
Pembrolizumab als Erstlinienstandard bei MSI-high mCRC
Eine Mikrosatelliten-Instabilität (MSI-H) oder Mismatch-Reparatur-Defizienz (dMMR) kann bei etwa 5–10% aller mCRC-Patienten nachgewiesen werden und ist mit einer deutlich erhöhten Sensitivität gegenüber Immuntherapie vergesellschaftet. Nach der letztjährigen Präsentation der Daten zum progressionsfreien Überleben (PFS) in der KEYNOTE-177-Studie wurden nun die mit Spannung erwarteten Daten zum Gesamtüberleben (OS) berichtet.1 In dieser randomisierten Phase-III-Studie wurde bei insgesamt 307 Patienten eine Immuntherapie mit Pembrolizumab mit einer Doublet-Chemotherapie mit Biological (mFOLFOX6 oder FOLFIRI in Kombination mit Bevacizumab oder Cetuximab) in der Erstlinientherapie von MSI-H- oder dMMR-mCRC verglichen.
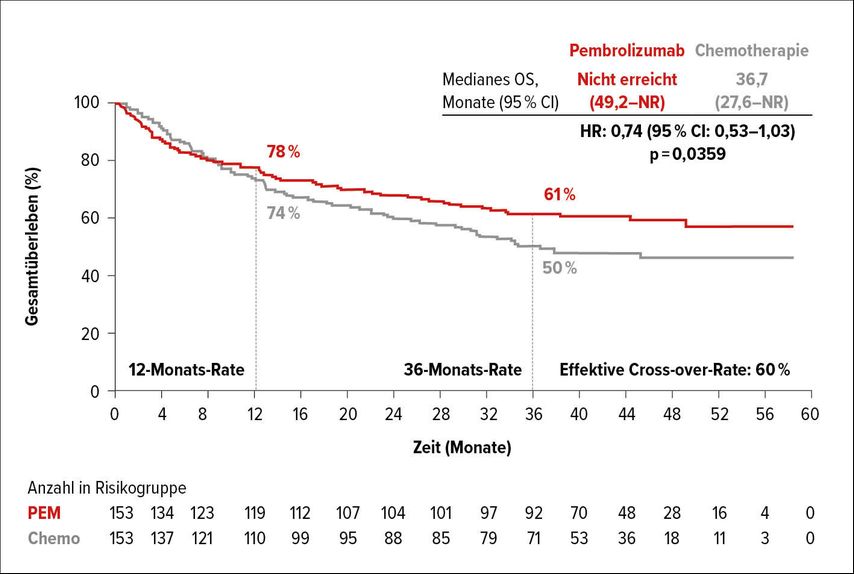
Im Update der PFS-Daten bestätigte sich die Überlegenheit von Pembrolizumab mit im Median 16,5 Monaten gegenüber 8,2 Monaten im Standardarm (HR: 0,59; 95% CI: 0,45–0,79). Auch die Gesamtansprechrate (ORR: 45,1% vs. 33,1%) und die kompletten Remissionen (CR: 13,1% vs. 3,9%) sprechen klar für Pembrolizumab, bei bekannt guter Verträglichkeit (Toxizitäten Grad 3/4: 21,6% vs. 66,4%).
In der nun präsentierten OS-Analyse konnte zwar der statistisch prädefinierte Endpunkt nicht erreicht werden, die Ergebnisse zeigen jedoch einen klinisch hochrelevanten Vorteil für die Immuntherapie: Während im Pembrolizumab-Arm das mediane OS noch nicht erreicht wurde, beträgt dieses im Chemotherapie-Arm 36,7 Monate (HR: 0,74; 95% CI: 0,53–1,03) und nach 3 Jahren sind noch 61% im Pembrolizumab-Arm gegenüber 50% im Chemotherapie-Arm am Leben (Abb. 1). Besonders wichtig für die Interpretation der Daten ist die Tatsache, dass insgesamt 60% der Patienten im Chemotherapie-Arm im Weiteren eine Immuntherapie erhalten haben. Angesichts dieser PFS- und OS-Daten wird Pembrolizumab klar als neuer Erstlinienstandard in dieser Indikation bestätigt und wurde bereits seitens der EMA zugelassen.
Offene Fragen betreffen die höhere primäre Progression unter Pembrolizumab gegenüber der Chemotherapie mit 29,4% vs. 12,3% und das anfängliche Kreuzen der PFS-Kurven: Hier werden verschiedene Erklärungen diskutiert, von der fehlenden zentralen Bestimmung des MSI-H/dMMR-Status bis hin zum Phänomen der sogenannten Pseudoprogression. Zudem scheint sich die Überlegenheit von Pembrolizumab bei KRAS/NRAS-mutiertem mCRC nicht ganz so klar abzuzeichnen wie in anderen Subgruppen – jedoch auch keine Unterlegenheit. Weitere Analysen der vorliegenden KEYNOTE-177-Studie, aber auch andere Phase-III-Studien wie mit Nivolumab ± Ipilimumab (NCT04008030) oder Atezolizumab (NCT02997228) sollten hier weitere Klarheit bringen.
Panitumumab-&-FU/LV-Erhaltungstherapie
Die deutsche PANAMA-Studie untersuchte eine Erhaltungstherapie mit 5-Fluorouracil/Leucovorin (FU/LV) und Panitumumab gegenüber einer alleinigen FU/LV-Therapie bei insgesamt 148 Patienten mit RAS-Wildtyp-mCRC.2 Die Randomisierung in dieser Phase-III-Studie erfolgte nach einer Erstlinien-Induktionstherapie mit FOLFOX und Panitumumab bei zumindest stabiler Erkrankung. In Bezug auf den primären Endpunkt PFS konnte ein Vorteil für die Kombinations-Erhaltungstherapie gezeigt werden, mit im Median 8,8 Monaten für FU/LV und Panitumumab gegenüber 5,7 Monaten für FU/LV alleine (HR: 0,72; 80% CI: 0,60–0,85). Im Alltag stellt sich primär die Frage der Verträglichkeit von Panitumumab, da angesichts des Nebenwirkungsprofils sicherlich nur Patienten mit sehr guter Toleranz für eine derartige Erhaltungsstrategie infrage kommen.
Zusätzlich wurden auch Patienten untersucht, welche die laut Studienprotokoll empfohlene Reinduktion mit FOLFOX und Panitumumab bei Progress unter Erhaltungstherapie erhalten haben. Obwohl man in der klinischen Praxis viel eher einen Strategiewechsel auf z.B. FOLFIRI und Bevacizumab vornehmen würde, zeigte diese Analyse sehr klar, dass ein anti-EGFR-freies Intervall für eine anti-EGFR-basierte Wiederbehandlung essenziell zu sein scheint: So wurde nur bei 8,9% der Patienten im FU/LV- und Panitumumab-Arm ein Ansprechen erzielt gegenüber 34,7% im alleinigen FU/LV-Arm. Auch das mediane PFS war signifikant kürzer mit 3,3 Monaten gegenüber 5,8 Monaten.
ctDNA-guided Anti-EGFR-Rechallenge
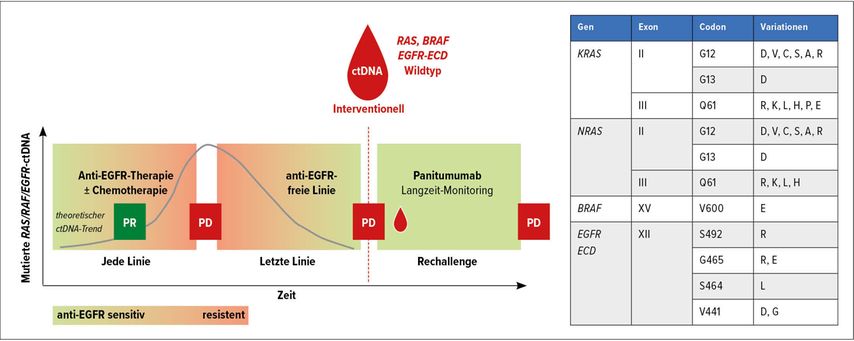
Unter dem Selektionsdruck anti-EGFR-basierter Therapien kann es zur Ausbildung von RAS-mutierten Klonen kommen, welche sekundär zur Resistenz führen. Eine wachsende Zahl an Studien konnte inzwischen demonstrieren, dass ein nachfolgendes anti-EGFR-freies Intervall häufig zu einem Absinken dieser RAS-mutierten Klone führt und dadurch eine RAS-Wildtyp-Situation wiederhergestellt werden kann. Hierauf beruht das Konzept der sogenannten Rechallenge, das heißt die erneute Verwendung einer Therapie, unter der in der Vergangenheit bereits ein Progress verzeichnet wurde. Dies widerspricht im Grunde den geläufigen onkologischen Therapieprinzipien, kann jedoch wie im Falle der Anti-EGFR-Rechallenge zu beeindruckenden klinischen Resultaten führen.
Mit der CHRONOS-Studie wurde eine neue Entwicklungsstufe des Anti-EGFR-Rechallenge-Konzepts präsentiert,3 da hier eine Präselektion von Patienten mit vermeintlich sensitiver Erkrankung anhand des Profils der zirkulierenden Tumor-DNA (ctDNA)vorgenommen wurde. Patienten mit initial RAS/BRAF-Wildtyp-mCRC, in der Vorgeschichte dokumentiertem Ansprechen auf eine Anti-EGFR-Therapie und in der Folge auch dokumentiertem Progress unter Anti-EGFR-Therapie wurden einer ctDNA-Analyse unterzogen (Abb. 2). Der Einschluss in die Studie war jedoch nur möglich, sofern keine Resistenz-vermittelnden Mutationen in der ctDNA festgestellt werden konnten (KRAS, NRAS, BRAF, EGFRECD). Derart wurden 31% der 52 gescreenten Patienten ausgeschlossen und so wurde eine vermutlich wirkungslose Rechallenge-Therapie vermieden. Bei den verbleibenden 27 Patienten konnte mit einer Panitumumab-Monotherapie ein Gesamtansprechen von 30% und bei 63% eine Krankheitskontrolle von zumindest 4 Monaten erreicht werden. Interessanterweise war das Ansprechen unabhängig von der Anzahl der Vortherapien.
So unterstützt nach der CRICKET-Studie (NCT02296203) auch die CHRONOS-Studie klar das Konzept der Anti-EGFR-Rechallenge. Trotz der überzeugenden Ansprechraten fällt die Einordnung in die aktuelle Therapielandschaft angesichts der geringen Fallzahlen im Vergleich zu den großen Studien der zugelassenen Drittlinienoptionen nicht leicht. Die lokale Verfügbarkeit einer ctDNA-Analyse und die jeweilige Situation der Patienten werden vermutlich am ehesten diese individuelle Entscheidung leiten. Weitere Daten sind wünschenswert und auch aus Studien wie der FIRE 4 (NCT02934529) und ggf. auch aus retrospektiven Analysen von „early adopters“ zu erwarten.
Trastuzumab Deruxtecan bei HER2+ mCRC
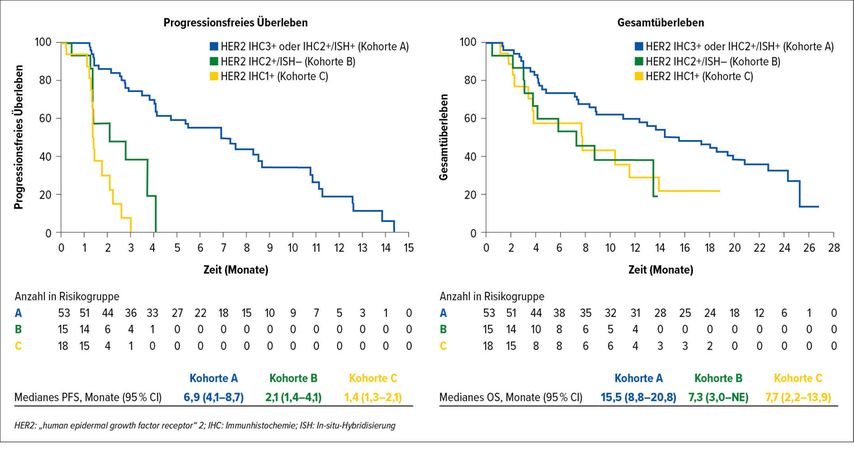
Finale Ergebnisse wurden am diesjährigen ASCO auch für die DESTINY-CRC01-Studie gezeigt:4In dieser einarmigen Phase-II-Studie wurde der Einsatz des Antikörper-Wirkstoff-Konjugats Trastuzumab Deruxtecan bei HER2+ mCRC untersucht: Die bekannt hohe Gesamtansprechrate von 45,3% beschränkt sich auf die klar HER2-positive Erkrankung (HER2 IHC3+ oder IHC2+/ISH+) – trotz im Median 4 Vortherapien und teilweiser anti-HER2-gerichteter Vortherapien. In der Analyse der 53 Patienten dieser HER2+ Kohorte konnten ein medianes PFS von 6,9 Monaten und ein medianes OS von 15,5 Monaten erreicht werden (Abb. 3). Dies scheint im indirekten Vergleich mit zugelassenen Drittlinien-Therapieoptionen – bei aller gebotenen Vorsicht – als sehr vielversprechend. Wie auch aus anderen Studien mit Trastuzumab Deruxtecan bekannt, muss besonderes Augenmerk auf die Lungentoxizität gelegt werden: 3 von 86 Patienten verstarben therapiebedingt an Pneumonitis bzw. interstitieller Lungenerkrankung.
Abb. 3: Progressionsfreies Überleben (PFS) und Gesamtüberleben (OS) in der DESTINY-CRC01-Studie (nach Yoshino T et al.)4
Trotz berichteter nur 2–3%iger HER2-Positivität bei mCRC sollte je nach der Verfügbarkeit von anti-HER2-gerichteten Therapien an eine entsprechende Analyse des Tumorgewebes gedacht werden. Darüber hinaus wird die HER2-Überexpression als wichtiger sekundärer Resistenzmechanismus gegenüber Anti-EGFR-Therapien bei mCRC diskutiert, sodass sich hierdurch die Zahl der infrage kommenden Patienten noch weiter erhöhen könnte. Im Gegensatz zum metastasierten HER2+ Mammakarzinom liegt für den Einsatz von Trastuzumab Deruxtecan beim mCRC seitens der EMA bislang noch keine Zulassung vor.
Literatur:
1 Thierry A et al.: J Clin Oncol 2021;39(Suppl 15): Abstr. #3500 2 Modest DP et al.: J Clin Oncol 2021; 39(Suppl 15): Abstr. #3503 3 Sartore-Bianchi A et al.: J Clin Oncol 2021; 39(Suppl 15): Abstr. #3506 4 Yoshino T et al.: J Clin Oncol 2021; 39(Suppl 15): Abstr. #3505
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...