ASCO-Highlights zum Lungenkarzinom
Autor:
OA Dr. Maximilian J. Hochmair
Leiter der pneumo-onkologischen Ambulanz und Tagesklinik
Abteilung für Innere Medizin und Pneumologie
Karl Landsteiner Institut für Lungenforschung und pneumologische Onkologie
Krankenhaus Nord – Klinik Floridsdorf, Wien
E-Mail: maximilian.hochmair@wienkav.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Jahrestagung der ASCO wurde dieses Jahr aufgrund der aktuellen Situation als virtueller Kongress veranstaltet. Der Qualität und Relevanz der vorgestellten Arbeiten tat dies jedoch keinen Abbruch. Im folgenden Überblick habe ich meine persönlichen Highlights aus dem Bereich Lungenkarzinom zusammengefasst.
Rauchstopp: niemals zu spät
Eine gepoolte Analyse von mehr als 35000 Patienten hat gezeigt, dass es sich im Zusammenhang mit Lungenkrebs immer lohnt, mit dem Rauchen aufzuhören. Im Vergleich zu Rauchern war das Sterberisiko insgesamt bei ehemaligen Rauchern umso stärker reduziert, je länger sie mit dem Rauchen aufgehört hatten: um 12% beim Rauchstopp vor <2 Jahren, um 17% vor 2–5 Jahren und um 20% vor >5 Jahren. Das Lungenkrebs-spezifische Überleben war allerdings nur bei einem Rauchstopp >5 Jahre signifikant besser. Diese Ergebnisse waren über alle Tumorstadien hinweg unabhängig vom Alter und den Pack-Years.1
Covid-19 und Lungenkrebs
Mitte März wurde auf Initiative der Mailänder Pneumo-Onkologin Chiara Garassino ein weltweites Konsortium (TERAVOLT) ins Leben gerufen. Es sammelt Daten von Lungenkrebspatienten, die an Covid-19 erkrankten. Das Ziel war, den Einfluss der Krebstherapie und der Coronavirusinfektion auf das Überleben der Patienten zu untersuchen. Insgesamt wurden bis Anfang Mai die Daten von 400 Patienten ausgewertet. Die meisten befanden sich in einer Tumortherapie. Ein Großteil wies eine oder mehrere Komorbiditäten auf, unter anderem COPD, Diabetes und Bluthochdruck. Die Patienten zeigten typische Covid-19-Symptome wie Fieber, Husten und Atemnot. Zum Daten-Cut-off waren 141 Patienten gestorben, davon 112 an Covid-19, 169 hatten überlebt und 118 befanden sich noch in Behandlung. Das Risiko, an Covid-19 zu sterben, stieg mit höherem Alter (>65 Jahre), Komorbiditäten, schlechtem ECOG-Performance-Status, Antikoagulation, Steroidtherapie und einer Tumortherapie innerhalb der vorhergegangenen drei Monate, vor allem nach Chemotherapie. Strahlentherapie, Immuntherapie oder Tyrosinkinase-Inhibitoren (TKI) allein wirkten sich nicht auf das Covid-19-Sterberisiko aus.2
Nicht kleinzelliges Lungenkarzinom (NSCLC)
Frühe Stadien
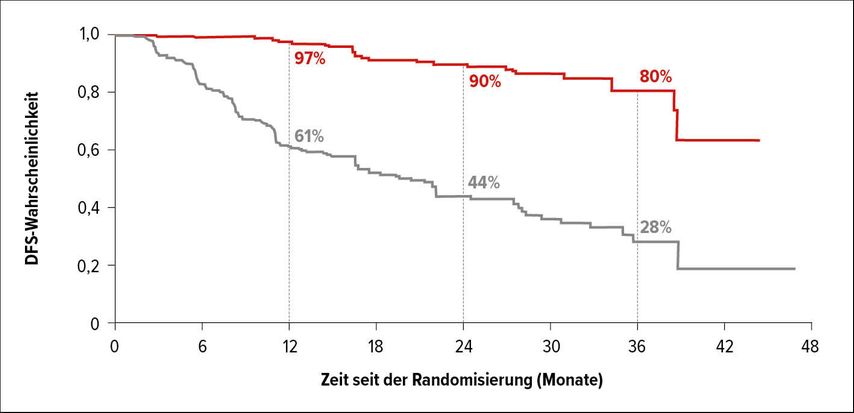
Zwei Studien zur Behandlung früher Stadien des NSCLC sind hervorzuheben: zunächst die ADAURA-Studie, die meiner Meinung nach aktuell eine der wichtigsten Arbeiten ist. Eingeschlossen waren Patienten mit EGFR-mutiertem NSCLC der Stadien IB bis IIIA. Nach der vollständigen Resektion des Tumors mit/ohne adjuvante Chemotherapie wurden sie randomisiert und erhielten entweder Osimertinib oder Placebo. Primärer Endpunkt war das krankheitsfreie Überleben (DFS). Bei Patienten im Stadium II oder IIIA erzielte Osimertinib einen signifikanten Vorteil im DFS (nicht erreicht vs. 20,4 Monate; p<0,0001) (Abb. 1). Auch in der Gesamtpopulation und über alle Subgruppen hinweg war der DFS-Vorteil signifikant. Die Daten zum Gesamtüberleben (OS) waren zum ASCO noch nicht reif. Es zeigte sich lediglich ein Trend zugunsten von Osimertinib. Diese Daten sind jedoch für die Klinik besonders wichtig, um zu wissen, ob bereits in einem frühen Stadium ein TKI gegeben werden sollte. Bestätigt sich der Trend, sollten diese Erkenntnisse unbedingt umgesetzt werden.3
Die zweite erwähnenswerte Studie ist CTONG 1104 mit einer ähnlichen Studienpopulation (EGFR-mutiertes NSCLC Stadium II bis IIIA). Die Patienten wurden adjuvant mit Gefitinib oder Chemotherapie behandelt. Die DFS-Daten wurden bereits bei früheren ASCO-Kongressen präsentiert und waren klar zugunsten von Gefitinb. In diesem Jahr wurden die OS-Daten vorgestellt. Hier ergab sich kein Unterschied zwischen beiden Gruppen. Es ist deshalb besonders interessant, die OS-Daten der ADAURA-Studie abzuwarten.4
Zielgerichtete Therapien
Bei den zielgerichteten Therapien ist die GEOMETRY-Studie zu nennen, an der auch wir mitgearbeitet haben. In diese noch andauernde Studie sind Patienten mit METex14–mutiertem NSCLC eingeschlossen, die mit Capmatinib behandelt werden. Hier wurden schon im vergangenen Jahr beeindruckende PFS-Daten bei vorbehandelten (Kohorte 4) und Therapie-naiven Patienten (Kohorte 5b) gezeigt. In diesem Jahr wurden die Ergebnisse von hoch MET-amplifizierten Patienten vorgestellt, die mit 1–2 Therapielinien vorbehandelt (Kohorte 1a) oder Therapie-naiv (Kohorte 5b) waren. Das Ansprechen war etwas schwächer als bei den MET-mutierten Patienten und betrug in Kohorte 1a 29%, in Kohorte 5b 40%. In beiden Gruppen lag die mediane Ansprechdauer (DOR) bei rund 8 Monaten, das mediane PFS bei 4 Monaten. Capmatinib sehe ich daher als gute Option in der Zweit- oder Drittlinie nach Chemo-Immuntherapie.5
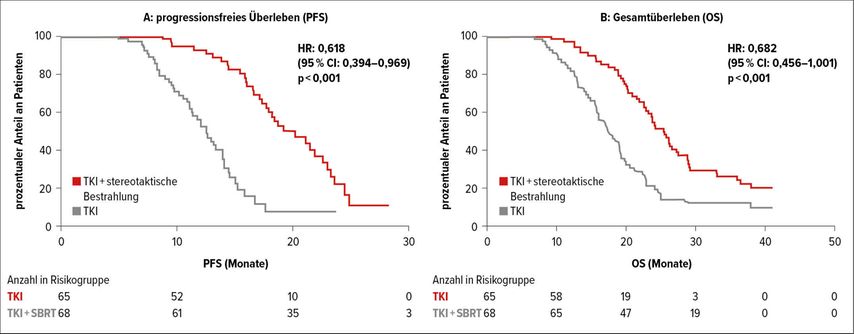
Sehr wichtig beim frühen NSCLC sind auch die Daten der SINDAS-Studie. Diese Studie stellt ein Vorgehen, das bereits praktiziert wird, gut dar. Eingeschlossen waren oligometastasierte Patienten mit EGFR-mutiertem NSCLC im Stadium IV. Die Patienten erhielten randomisiert entweder nur einen TKI oder einen TKI plus stereotaktische Bestrahlung, die schon initial eingeleitet wurde. Es ergab sich ein klarer Vorteil für die Strahlentherapie: Nach einem medianen Follow-up von fast 20 Monaten lag das PFS im TKI-Arm bei 12,5 Monaten, im TKI/Strahlentherapiearm bei 20,2 Monaten (p<0,001). Das OS betrug unter dem TKI 17,4 Monate und 25,5 Monate unter der Kombination TKI/Strahlentherapie (p<0,001) (Abb. 2).6 Aufgrund dieser Ergebnisse sollte bei Patienten mit Oligometastasen immer eine Strahlentherapie erfolgen. Die Frage, die diese Studie nicht beantworten kann, ist, ob der TKI vor der Strahlentherapie als Induktion eingesetzt oder beide gleichzeitig gestartet werden sollen.
Beeindruckende Resultate lieferte auch die Studie DESTINY-Lung01 mit dem gegen HER2 gerichteteten Antikörper-Wirkstoff-Konjugat Trastuzumab-Deruxtecan. Eingeschlossen waren Patienten mit nicht resezierbarem/metastasiertem oder rezidiviertem/refraktärem HER2-positivem NSCLC. Alle wurden mit Trastuzumab-Deruxtecan behandelt. Primärer Endpunkt war die Rate der objektiven Response (ORR), bestehend aus kompletter (CR) oder partieller Remission (PR). Weitere Endpunkte waren: Krankheitskontrollrate (DCR), DOR, PFS, Sicherheit. Bereits 2019 waren die Daten der Patienten mit HER2-überexprimierendem Tumor vorgestellt worden. Dieses Jahr wurden die Daten der Patienten mit HER2-mutiertem Tumor präsentiert. Alle hatten im Durchschnitt bereits zwei Therapielinien erhalten. Es zeigte sich eine beeindruckende ORR von 61,9%, das PFS lag bei median 14 Monaten und das OS war noch nicht erreicht. Insgesamt war die Substanz gut verträglich. Die häufigsten Nebenwirkungen waren Anämie, Neutropenie und gastrointestinale Symptome.7 Trastuzumab-Deruxtecan führt zur stärksten HER2-Blockade im Vergleich zu allen anderen verfügbaren Wirkstoffen. Derzeit ist die Substanz in Österreich noch nicht erhältlich, aber wir erwarten, dass demnächst entsprechende Studien angeboten werden.
Für die ALTA-1L-Studie wurde ein interessantes Update zur Liquid Biopsy gezeigt. In dieser Studie wurde Brigatinib gegen Crizotinib in der Erstlinie getestet. Unter Brigatinib war das PFS signifikant länger als unter Crizotinib (48 vs. 26 Monate, p<0,0001). Nun wurde untersucht, wie EML4-ALK-Fusionsvarianten die Wirksamkeit der beiden Substanzen beeinflussen. Bei 55% der Patienten wurde im Plasma die ALK-Fusion gefunden. Am häufigsten waren die Varianten 1 und 3, wobei Variante 1 mit besserem Ansprechen und längerem PFS einherging. Die TP53-Mutation führte zu einem schlechteren Ansprechen und PFS.8
Zur ALEX-Studie mit Alectinib versus Crizotinib beim ALK-positiven NSCLC wurde ebenfalls ein Update vorgestellt. Bereits zuvor waren die PFS-Daten gezeigt worden, die zugunsten von Alectinib ausgefallen waren (34,8 vs. 10,9 Monate; HR: 0,43). Das Update lieferte die 5-Jahres-OS-Daten, die einen klinisch relevanten Vorteil für Alectinib zeigen (nicht erreicht vs. 57,4 Monate; HR: 0,67).9
Schließlich gab es noch ein weiteres Update zur LIBRETTO-001-Studie mit Selpercatinib (LOXO-292) bei Patienten mit RET-positivem NSCLC. Diese Patienten haben eine etwa 50%ige Lebenszeitprävalenz für Hirnmetastasen. Selpercatinib ist ein ZNS-gängiger hochselektiver RET-Inhibitor. Die aktuellen Daten zeigen eine Ansprechrate von 81,8%.10 Die Substanz ist in Österreich im Rahmen des „Named Patient Use“-Programms verfügbar und wir haben bereits einige Patienten damit behandelt, die sehr gut darauf ansprechen.
NSCLC Stadium IV
Die Studie CheckMate 9LA hat bei nicht vorbehandelten Patienten mit NSCLC im Stadium IV die Doppelimmuntherapie Nivolumab + Ipilimumab in Kombination mit 2 Zyklen Chemotherapie mit 4 Zyklen Chemotherapie verglichen. Primärer Endpunkt war das OS, sekundäre Endpunkte waren unter anderem PFS und ORR. Hinsichtlich des primären Endpunkts war die Chemo-Immuntherapie der alleinigen Chemotherapie signifikant überlegen (15,6 vs. 10,9 Monate; HR: 0,66). Dieser Überlebensvorteil wurde beim squamösen wie auch beim nicht squamösen NSCLC beobachtet und war unabhängig von der PD-L1-Expression. Da in der Kombination nur zwei Chemotherapiezyklen gegeben wurden, war diese insgesamt besser verträglich. Die Nebenwirkungen der Immuntherapie entsprachen den aus anderen Studien bereits bekannten.11 Die Kombination ist in Österreich allerdings derzeit nicht zugelassen.
Die Studie CheckMate 227 Part 1 setzte ebenfalls in der Erstlinie Nivolumab + Ipilimumab bei Stadium-IV-NSCLC-Patienten ein. Für die Randomisierung spielte die PD-L1-Expression eine Rolle. Patienten mit PD-L1 ≥1% wurden randomisiert in Nivolumab + Ipilimumab, Nivolumab-Monotherapie, Chemotherapie. Patienten mit PD-L1 <1% wurden randomisiert in Nivolumab + Ipilimumab, Nivolumab + Chemotherapie, Chemotherapie. Primärer Endpunkt war das OS. Beim diesjährigen ASCO wurden die 3-Jahres-Daten vorgestellt. Bei beiden Patientengruppen erzielte die Kombination dauerhafte OS-Raten von 33 bzw. 34%.12
Die KEYNOTE 189-Studie hat den Goldstandard für die Erstlinientherapie des fortgeschrittenen NSCLC gesetzt, an dem sich alle anderen Substanzen messen lassen müssen. Auch in der finalen Analyse mit einem medianen Follow-up von 31 Monaten zeigte die Kombination Pembrolizumab + Chemotherapie gegenüber der Chemotherapie einen andauernden Überlebensvorteil (22 vs. 10,6 Monate; HR: 0,56) – und dies unabhängig von der PD-L1-Expression. Die 2-Jahres-OS-Raten betrugen für die Chemo-Immuntherapie 45,7%, für die Chemotherapie 27,3%.13
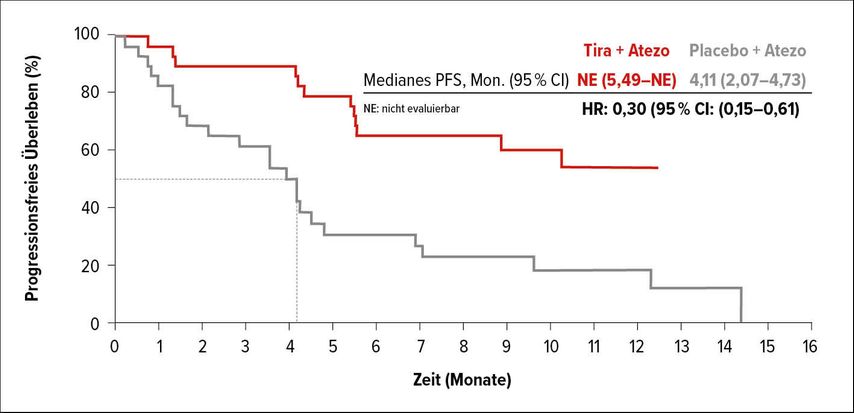
In der CITYSCAPE-Studie wurde erstmals der PD-L1-Inhibitor Atezolizumab mit dem TIGIT-Inhibitor Tiragolumab untersucht. TIGIT (T-Zell-Immunrezeptor mit Ig- und ITIM-Domänen) wurde als neuer Angriffspunkt für Immuncheckpoint-Inhibitoren identifiziert. Die TIGIT-Expression korreliert stark mit der PD-L1-Expression, vor allem bei tumorinfiltrierenden Zellen des Lungenkarzinoms. In die Studie waren PD-L1-positive NSCLC-Patienten eingeschlossen und wurden entweder mit Atezolizumab allein oder in Kombination mit Tiragolumab behandelt. Patienten mit einer hohen PD-L1-Expression ≥50% zeigten unter der Kombinationstherapie eine fast dreifach höhere ORR als unter Atezolizumab allein (66% vs. 24%). Patienten mit <50% PD-L1-Expression profitierten von der Kombination nicht mehr als von Atezolizumab. Das Gleiche gilt für das PFS: Patienten mit hoher PD-L1-Expression erreichten ein verlängertes PFS (Abb. 3), bei Patienten mit niedrigerer PD-L1-Expression konnte kein Unterschied zwischen den Studienarmen beobachtet werden. Hinsichtlich der Nebenwirkungen ist zu sagen, dass etwas mehr immunvermittelte Nebenwirkungen auftraten, die aber offenbar beherrschbar sind.14 Mittlerweile steht diese Kombination in einer Phase-III-Studie auch in Österreich zur Verfügung.
Kleinzelliges Lungenkarzinom (SCLC)
ES-SCLC
In diesem Jahr gab es erfreulich viele Arbeiten beim fortgeschrittenen SCLC („extensive stage“). Beginnen möchte ich mit der CASPIAN-Studie, an der wir ebenfalls mitgewirkt haben. Dabei handelt es sich um eine dreiarmige Studie: Durvalumab + Chemotherapie versus Chemotherapie wurde schon im vergangenen Jahr präsentiert. In diesem Jahr wurde der Vergleich von Durvalumab + Tremelimumab + Chemotherapie mit Chemotherapie gezeigt. Hinsichtlich des OS ergab sich zwar ein Vorteil für die Kombination, der jedoch nicht klinisch relevant ist. Diese Kombination wird sich daher nicht durchsetzen. Dagegen bestätigten sich die guten Resultate der Kombination aus Durvalumab plus Chemotherapie gegenüber Chemotherapie.15 Diese Kombination wird ab September in Österreich zur Verfügung stehen und ist neben Atezolizumab als Goldstandard für diese Indikation zu sehen.
Mit Spannung erwartet wurden die aktuellen Daten von KEYNOTE-604. In dieser Studie wurde Pembrolizumab plus Chemotherapie mit Chemotherapie allein in der Erstlinienbehandlung des fortgeschrittenen SCLC verglichen. Die Zugabe von Pembrolizumab verlängerte zwar das PFS signifikant (4,5 vs. 4,3 Monate; p=0,0023), aber hinsichtlich des OS konnte kein Vorteil gezeigt werden.16 Daher wird auch diese Kombination keine klinische Relevanz bekommen.
Die Studie ECOG-ACRIN EA5161 verglich Nivolumab plus Chemotherapie mit Chemotherapie allein beim fortgeschrittenen SCLC. Die Zugabe von Nivolumab verlängerte sowohl das PFS (5,5 vs. 4,7 Monate; p=0,047) als auch das OS (11,3 vs. 9,3 Monate; p=0,14).17
LS-SCLC
Eine wichtige Studie zur Radiochemotherapie bei frühen SCLC-Stadien („limited disease“) kam aus Norwegen. Verglichen wurde der derzeitige Standard (1x/d 45Gy + Chemotherapie) mit einer höheren Strahlendosis (2x/d 60 Gy + Chemotherapie). Primärer Endpunkt, dereindeutig positiv ausfiel, war das 2-Jahres-Überleben: Im 60-Gy-Arm waren nach zwei Jahren noch 70,2% der Patienten am Leben, im 45-Gy-Arm 46,1% (p=0,002). Das OS im 60-Gy-Arm war fast doppelt so lang wie im 45-Gy-Arm (41,6 Monate vs. 22,9 Monate; p=0,027). Dabei verursachte die höhere Strahlendosis keine höhere Toxizität als die Standarddosis. Diese Studie wird die Behandlung des LD-SCLC verändern.18
Mesotheliom
Hier sind zwei interessante Arbeiten hervorzuheben. Zum einen eine einarmige Phase-II-Studie mit Durvalumab plus Cisplatin/Pemetrexed (PrE0505). 55 Patienten mit nicht resezierbarem Mesotheliom erhielten bis zu 6 Zyklen Durvalumab + Chemotherapie, gefolgt von einer Durvalumab-Erhaltungstherapie von bis zu einem Jahr. Primärer Endpunkt war das OS, sekundäre Endpunkte waren Sicherheit/Verträglichkeit, PFS und ORR. Das mediane OS lag bei 20,4 Monaten (p=0,0014) und nach einem Jahr waren noch 70% der Patienten am Leben. Das PFS erreichte 6,7 Monate bei Responseraten von 56,4% (partielle Remission) und 40% (stabile Krankheit). Eine Korrelation mit PD-L1 oder TMB wurde nicht festgestellt.19
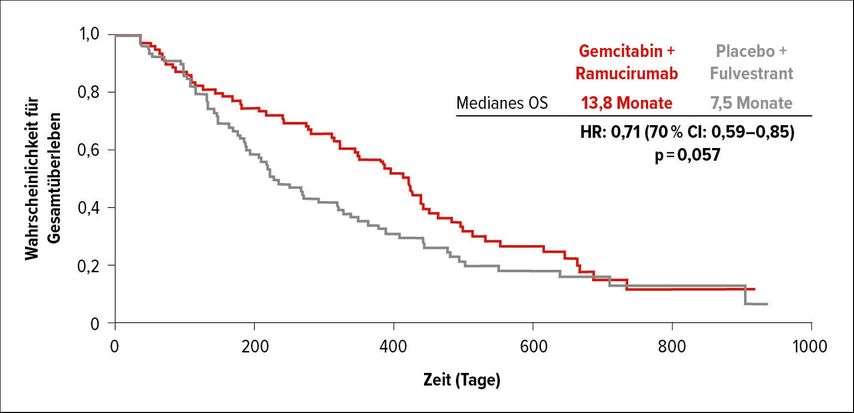
Einen Hoffnungsschimmer brachte die RAMES-Studie. Sie untersuchte, wie sich die Zugabe von Ramucirumab zu Gemcitabin in der zweiten Linie nach Platin/Pemetrexed auf das OS von Mesotheliompatienten auswirkt. Insgesamt wurden 164 Patienten in zwei Gruppen randomisiert und erhielten Gemcitabin plus Ramucirumab oder Placebo. Ramucirumab erzielte nahezu eine Verdoppelung des OS im Vergleich zu Placebo (13,8 vs. 7,5 Monate; p=0,057). Die Dauer des Ansprechens auf die Erstlinienbehandlung und der Histotyp spielten dabei keine Rolle. Selbst bei nicht epitheloiden Tumoren, deren Prognose extrem schlecht ist, betrug das OS median 13 Monate. Das PFS war im Ramucirumab-Arm ebenfalls doppelt so lang wie im Vergleichsarm (6,2 vs. 3,3 Monate; p=0,26).20 Die Therapie ist zwar noch nicht zugelassen, wird aber die Zweitlinienbehandlung des Mesothelioms grundlegend verändern.
Literatur:
1 Fares AF et al.: J Clin Oncol 2020: 38 (suppl; abstr 1512) 2 Horn L et al.: J Clin Oncol 2020: 38 (suppl; abstr LBA111) 3 Herbst RS et al.: J Clin Oncol 2020: 38 (suppl; abstr LBA5) 4 Wu YL et al.: J Clin Oncol 2020: 38 (suppl; abstr 9005) 5 Wolf J et al.: J Clin Oncol 2020: 38 (suppl; abstr 9509) 6 Wang x et al.: J Clin Oncol 2020: 38 (suppl; abstr 9508) 7 Smit EF et al.: J Clin Oncol 2020: 38 (suppl; abstr 9504) 8 Camidge DR et al.: J Clin Oncol 2020: 38 (suppl; abstr 9517) 9 Peters S et al.: J Clin Oncol 2020: 38 (suppl; abstr 9518) 10 Vivek Subbiah et al.: J Clin Oncol 2020: 38 (suppl; abstr 9516) 11 Reck M et al.: J Clin Oncol 2020: 38 (suppl; abstr 9501) 12 Suresh SR et al.: J Clin Oncol 2020: 38 (suppl; abstr 9500) 13 Rodriguez-Abreu D et al.: J Clin Oncol 2020: 38 (suppl; abstr 9582) 14 Rodriguez-Abreu D et al.: J Clin Oncol 2020: 38 (suppl; abstr 9503) 15 Paz-Ares LG et al.: J Clin Oncol 2020: 38 (suppl; abstr 9002) 16 Rudin CM et al.: J Clin Oncol 2020: 38 (suppl; abstr 9001) 17 Leal T et al.: J Clin Oncol 2020: 38 (suppl; abstr 9000) 18 Grønberg BH et al.: J Clin Oncol 2020: 38 (suppl; abstr 9007) 19 Forde PM et al.: J Clin Oncol 2020: 38 (suppl; abstr 9003) 20 Pagano M et al.: J Clin Oncol 2020: 38 (suppl; abstr 9004)
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...