Aktuelles aus der Therapie des frühen und fortgeschrittenen Mammakarzinoms
Bericht:
Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Wenn sich neue Substanzen im metastasierten Setting als Gamechanger erwiesen haben, geht es immer darum, wie diese möglichst rasch auch ins Early-Breast-Cancer-(EBC)-Setting implementiert werden können. Dies war auch Gegenstand der Eröffnungssession bei der zweijährlich stattfindenden SGBCC (St. Gallen Breast Cancer Conference). Das Programm war vielfältig gestaltet, wobei die Debatte, ob ein oligometastatisches Mammakarzinom das Potenzial für eine komplette Kurabilität aufweist, besonders spannend war.
Valide Surrogatparameter für das Gesamtüberleben
Wesentlich in der Population, die in kurativer Intention therapiert wird, ist es, eine Verlängerung des Gesamtüberlebens (OS) zu erzielen und dafür Surrogatparameter zu definieren, die eine Prädiktion ermöglichen. Diese Thematik wurde von Prof. Dr. Giuseppe Curigliano, Universität Mailand, Italien, umfassend erörtert. Er zeigte anhand von Beispielen, dass ein und derselbe Surrogatparameter nicht auf jede Brustkrebssubentität anwendbar ist. In der offenen Studie MonarchE1 zum Zusatz von Abemaciclib (Abema) zur endokrinen Therapie (ET) bei HR+ HER2– EBC wurde das Überleben frei von invasiver Krankheit (IDFS) als primärer Endpunkt definiert. Auch nach fünf Jahren konnte die anhaltende signifikante Überlegenheit im Abema-haltigen Regime vs. den Kontrollarm bestätigt werden.2 Curigliano vermutete, dass sich der IDFS-Benefit sehr wohl in einen OS-Benefit übersetzen lässt. „Ein guter Endpunkt sollte Studien- und Patient:innenlevel miteinbeziehen. Die Assoziation zwischen diesen beiden Parametern wird statistisch mittels des Bestimmungskoeffizienten R2 gemessen. Ein R2-Wert ≥0,7 deutet auf eine starke, ein R2-Wert zwischen 0,50 und 0,69 hingegen auf eine moderate Korrelation hin“, erklärte Curigliano. Blondeaux et al. haben eine Metaanalyse von verschiedenen adjuvanten Studien durchgeführt und den R2-Wert auf Studien- und Patient:innenlevel bestimmt.
In einigen Studien wie jenen zum tripelnegativen Mammakarzinom (TNBC) konnte eine klare Korrelation zwischen den Surrogatparametern IDFS und EFS (ereignisfreies Überleben) mit dem OS festgestellt werden.3 Im neoadjuvanten Setting wurde die pCR(pathologisch komplette Response)-Rate beim TNBC als Surrogatparameter für das OS mit einem R2-Wert von deutlich ≥0,7 identifiziert. Dass ein und derselbe Endpunkt jedoch nicht auf jede Subentität übertragbar ist, geht aus dem negativen Ergebnis zum HR+ HER2– EBC von R2 <0,3 hervor.4 „Dies ist ein Aspekt, den wir bei der Konzeption von klinischen Studien im EBC-Setting bedenken sollen! Validierte Surrogatendpunkte sind für die beschleunigte Zulassung von Substanzen essenziell“, machte Curigliano in Hinsicht auf das prioritäre Ziel der OS-Verlängerung bei EBC-Patient:innen aufmerksam.
Neue endokrine Therapien
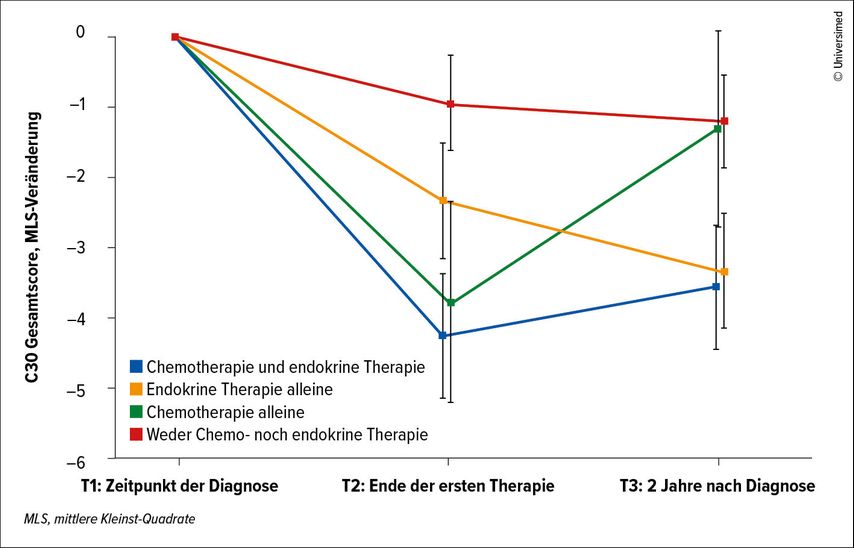
Bei der Entwicklung von neuen Substanzen geht es vordergründig darum, erworbene Resistenzen zu überwinden. Im Fall des HR+ HER2– Mammakarzinoms ist es auch relevant, zu erwähnen, dass ein beachtlicher Teil der Patient:innen die ET aufgrund von intolerablen Nebenwirkungen (AE) abbricht. In einer groß angelegten Untersuchung mit 1177 Patient:innen wurde die Adhärenz anhand des Serumspiegels von Tamoxifen untersucht und dabei bei 16% (n=188) eine Non-Adhärenz festgestellt. Nachweislich geht das vorzeitige Absetzen der ET aber mit einem signifikant kürzeren fernmetastasenfreien Überleben (DDFS) einher als bei Adhärenz (3-Jahres-DDFS: 89,5 vs. 95,4%; p=0,036).5 Zu den vorrangigen Gründen, warum eine ET vorzeitig abgebrochen wird, zählt auch, dass die ET nachteilige Effekte auf die Lebensqualität (QoL) hat, besonders wenn konkomitant auch noch eine Chemotherapie verabreicht wird (Abb. 1).6
Abb. 1: Die Therapieadhärenz nimmt am stärksten unter einer Kombination von Chemo- und endokriner Therapie ab, da dies die Lebensqualität erheblich beeinträchtigt (mod. nach Ferreira AR et al.)6
„Neue ET, die nicht am Östrogenrezeptor ansetzen, könnten sich als Backbone bei HR+ EBC-Patient:innen als erfolgreich erweisen“, äußerte sich Prof. Dr. Fabrice André, Institute Gustave Roussy, Villejuif, Frankreich, hoffnungsvoll. Die Tatsache, dass eine klassische ET für ≥5 Jahre eingenommen werden soll, bezeichnete er im Kontext mit der Non-Adhärenz als „unmet medical need“. Die beim metastasierten Mammakarzinom bereits zugelassene Substanzklasse der SERD (selektive Östrogenrezeptor-Degrader) ist jedenfalls vielversprechend und hat sich besonders bei HR+ Brustkrebspatient:innen mit dem Nachweis einer ESR1-Mutation in Kombination mit dem CDK4/6-Inhibitor Abema als hocheffektiv erwiesen.7
Im EBC-Setting liegen Daten aus einer Phase-II-Studie zu Giredestrant (G) + Palbociclib (Palbo) vs. den Aromataseinhibitor (AI) Anastrozol + Palbo vor. Mit dem Nachweis einer Ki67-Reduktion von 75% im Prüf- vs. 67% im Kontrollarm in Woche 2 vs. Baseline wurde der primäre Endpunkt erreicht. Das Nebenwirkungsprofil der Kombination G + Palbo erwies sich als tolerabel.8 „Bei EBC-Hochrisikopatient:innen sollten AI auf alle Fälle durch SERD ersetzt werden“, unterstrich André die überlegene Effektivität und ergänzte: „Außerdem benötigen wir neue Methoden wie die Bestimmung der ctDNA, um Patient:innen mit einem hohen Rezidivrisiko zu identifizieren.“ Für Patient:innen mit intermediärem Risiko kann er sich die Gabe eines SERD bei Nachweis von ctDNA im Zuge des Follow-ups (FU) unter einer Standard-ET vorstellen. Bei Niedrigrisikopatient:innen könnte untersucht werden, ob SERD zu einer Verbesserung der QoL und einer höheren Adhärenz vs. AI führen. Zurzeit sind einige Studien mit SERD im EBC-Setting im Gange.
ADC – Gamechanger auch bei EBC?
Keines der für das metastasierte Mammakarzinom (MBC) zugelassenen Antikörper-Wirkstoff-Konjugate (ADC) ist bislang für das EBC zugelassen. Dr. Sara Tolaney, Dana-Farber Cancer Institute, Boston, Massachusetts, USA, beleuchtete die möglichen Hürden, die bei der Transition ins EBC-Setting auftreten könnten. Sie ging auch der Frage nach, wie die pCR-Raten durch entsprechende Studiendesigns noch erhöht werden können und durch welche De- bzw. Eskalationsstrategien dies zu schaffen wäre.
„Beim HR EBC und beim frühen TNBC wurden bereits einige ADC im neoadjuvanten Setting geprüft. Dabei handelt es sich zwar um kleine Patient:innenpopulationen, jedoch sind die Ergebnisse zu den pCR-Raten ernüchternd“, berichtete Tolaney. Beispielsweise belief sich die pCR-Rate in der offenen Phase-II-Studie VALENTINE zu Hochrisikopatient:innen mit HR+ HER2– EBC unter der Kombination von Patritumumab Deruxtecan (HER3-DXd) + Letrozol auf nur 4,2%. Bei näherer Betrachtung der Krankheitscharakteristika kristallisiert sich jedoch heraus, dass nur ca. 20% der Patient:innen einen High-Grade-Tumor hatten.8 Könnte es daran liegen, dass die Target-Expression zu niedrig war? So wie in der Phase-II-Studie TALENT zu Trastuzumab Deruxtecan (T-DXd) +/– ET Patient:innen mit HR+ HER2low (IHC 1+ oder 2+) EBC nur 10% eine Expression von IHC 2+ aufgewiesen haben.9 Andererseits war der Nachweis einer TROP2-Expression in der Investigator-initiierten Studie NeoSTAR zu den gegen TROP2 gerichteten ADC Sacituzumab Govitecan (SG) bei lokalisiertem TNBC kein Prädiktor für das Erreichen einer pCR: Von den Patient:innen mit einer TROP2-Expression erzielten knapp 80% unter SG eine pCR, etwas mehr als 80% wiesen eine RD (Residualerkrankung) auf – dabei waren die Unterschiede in den H-Scores zwischen den Gruppen nicht signifikant. Interessant ist auch, dass bei Patient:innen mit Stadium-I-Erkrankung mit 50% die höchste pCR-Rate erzielt wurde und die pCR-Rate mit der Höhe des Stadiums abfiel.10
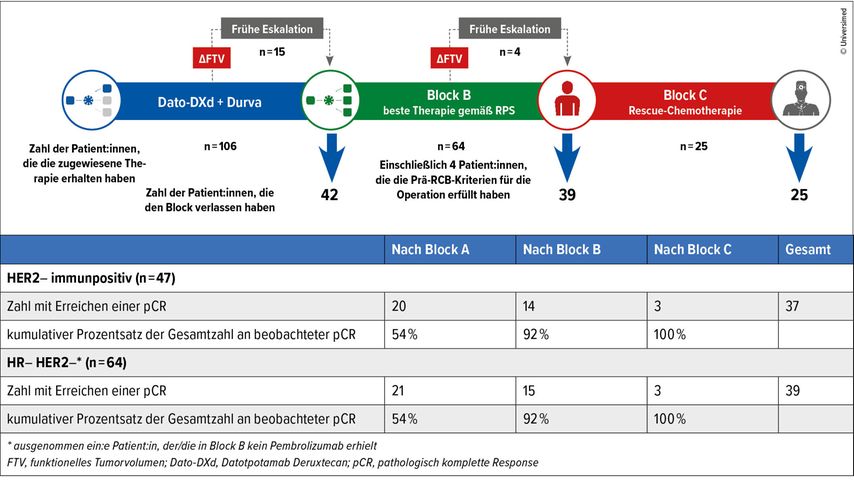
„Möglicherweise sollten wir eine sequenzielle neoadjuvante Therapie durchführen, um die pCR-Raten zu erhöhen, so wie dies in I-SPY 2.2 praktiziert wurde“, führte Tolaney als Beispiel für die Optimierung der pCR-Raten an. I-SPY 2.2 ist eine Studienplattform, in der bei Hochrisiko-EBC-Patient:innen (HR–/HER2– und HER2+ Patient:innen mit positiver Immunsignatur [Immun+]) Eskalations- bzw. Deeskalationsstrategien untersucht worden sind. Patient:innen, die in Block A (Datopotamab Deruxtecan [DatoDXd] + Durvalumab) eine pCR erzielt hatten (gemäß MRT-Untersuchung und Biopsieergebnis), wurden ohne weitere neoadjuvante Therapie der Operation zugeführt. Dieses Ziel wurde bei immerhin 54% der Patient:innen erreicht. Block B setzte sich aus optimalen Kombinationstherapien zusammen,11 die im Rahmen von I-SPY 212 und anderen praxisverändernden Studien identifiziert worden waren. Nach Block B wurde bei 92% eine pCR verzeichnet. D.h., nur 8% mussten einer CTx (Adriamycin + Cyclophosphamid) zugeführt werden. Danach lag die pCR-Rate bei 100% (Abb. 2).11 Zurzeit sind einige Studien zum sequenziellen Design bei EBC im Gange. So werden beispielsweise in der Phase-II-Studie HERTHENA-Breast03 (NCT06797635) HER3-DXd + Pembrolizumab +/– CTx bei Patient:innen mit TNBC oder HR niedrig+ HER2– EBC untersucht.
Stellenwert der ctDNA im EBC-Setting
Wann und wie könnte die Bestimmung der ctDNA beim EBC zukünftig zum Einsatz kommen? „In Screening und Diagnose sind wir mit der Bildgebung sehr gut, auch während der neoadjuvanten Therapie sind bislang keine Ergebnisse für den Nachweis eines klinischen Nutzens für das Monitoring von ctDNA erbracht worden. Das spannendste Potenzial liegt im Monitoring der adjuvanten Therapie, indem der molekulare Relaps früher als mittels Bildgebung detektiert werden könnte“, berichtete Prof. Dr. François-Clément Bidard, Institut Curie, Paris, Frankreich, der über den Einsatz der ctDNA referierte.
Loi et al. haben anhand einer Subgruppe der Patient:innen (n=1397) der MonarchE-Studie1 die Prädiktion eines IDFS-Events anhand der Bestimmung der ctDNA vor Therapiestart und während der zweijährigen Therapie (Monat 3, 6 und 24) untersucht. Bei Patient:innen mit ctDNA-Positivität zu Baseline trat bei rund 75% ein IDFS-Ereignis auf, bei ctDNA-Negativität lag dieser Prozentsatz bei etwa 11%. Nach zwei Jahren stellte sich bei den initial ctDNA-positiven Patient:innen ein Plateau ein, in diesem Zeitraum traten zunehmend mehr IDFS-Events im initial ctDNA-negativen Kollektiv auf. Angemerkt werden muss, dass die Sensitivität des hier verwendeten Signatera-Tests bei etwa 40% lag.13 „Bei den gegenwärtig verfügbaren Tests liegt das LoD („limit of detection“) bei 100–1000ppm. Entgegen unserer Hoffnung können diese bei ctDNA-negativen Patient:innen nicht für die Therapiedeeskalation zum Einsatz kommen. Bei Anwendung der Tests der 1. und 2. Generation hatten die ctDNA-positiven Patient:innen zum Zeitpunkt der Bildgebung bereits ein klinisches Rezidiv entwickelt. Dies könnte sich nun ändern, da neue ultrasensitive Tests verfügbar sind, die ein LoD von 1–10ppm aufweisen“, erläuterte Bidard und präsentierte drei rezente Studienergebnisse: Sehr vielversprechend ist dabei, dass bei keiner/keinem der initial ctDNA-negativ getesteten Patient:innen im Verlauf ein Event verzeichnet worden ist.14–16
Am Ende seines Vortrags ging Bidard auf die „lead time“ ein, d.h. die Zeitspanne zwischen molekularem (Nachweis mittels ctDNA) und klinischem Rezidiv (Nachweis durch die Bildgebung). Sie wird zunehmend in Bezug auf die rechtzeitige Therapieinitiierung bzw. dem Switch der Therapie eine wichtige Rolle spielen. Da auch die bildgebenden Verfahren immer sensitiver werden, besteht Hoffnung, dass die „lead time“ zukünftig immer kürzer wird.
„Needs“ bei der Konzeption von klinischen Studien
Eine eigene Session war der Thematik gewidmet, was bei der Erstellung von Studiendesigns beachtet werden sollte. Unter anderen referierte darüber der Kliniker Prof. Dr. David Cameron, Edinburgh University, Schottland, die ehemalige Präsidentin von Europa Donna, Tanja Spanic, äußerte sich dazu aus Patient:innenperspektive.
Cameron betonte, dass die Rekrutierung einer idealen Patient:innenpopulation notwendig ist, um akkurate Berechnungen hinsichtlich Wirksamkeit und Tolerabilität erstellen zu können. Das typische „Problem“ dabei ist, dass die Ergebnisse dieser Studienpopulation nicht zwangsläufig die Effektivität und Verträglichkeit im Real-World-Setting widerspiegeln. Als weiteren Aspekt führte er an, dass die Toxizitäten zwar mit dem gut etablierten CTCAE (Common Toxicity Criteria AE) graduiert werden, diese jedoch nichts über die individuellen Effekte auf den Patienten/die Patientin aussagen: So kann eine Grad-1-Diarrhö den/die Betroffene:n „ans Haus fesseln“ und die Ausübung des Berufs verunmöglichen – z.B. bei einem Lehrberuf. Hingegen hat eine Grad-3-Neutropenie keine Effekte auf den Lebensstil. „Wir haben nur in den seltensten Fällen einen zusammengesetzten Endpunkt zur Balance zwischen Effizienz und Toxizität und können demnach diese Ergebnisse nicht personalisieren“, brachte es Cameron auf den Punkt. Um ideale Designs zu konzipieren, plädiert er dafür, dass unter Einbindung von Patient:innen eine konstruktive Kooperation zwischen regulatorischen Behörden, Statistiker:innen, Industrie und klinischen Onkolog:innen stattfindet.
Tanja Spanic wies auf die Erfolge der Einbindung von Patient:innen als gleichwertige Stakeholder hin: Während es 2014 Patient:innen noch nicht erlaubt war, am ESMO-Kongress teilzunehmen, haben sie jetzt freien Zugang zu sämtlichen onkologischen Kongressen und sind auch in wissenschaftliche Komitees eingebunden. Allerdings besteht noch ein großes Manko, was die Einbindung von Patient:innen in die Konzeption von klinischen Studien anbelangt. „Gegenwärtig erfahren wir erst über die Designs, wenn die jeweilige Studie schon von der Ethikkommission genehmigt worden ist. Wir sollten jedoch schon zu einem viel früheren Zeitpunkt involviert werden!“, wies Spanic auf dieses „urgent unmet need“ hin.
Oligometastatische Erkrankung – heilbar?
Besonders spannend und auch vom Moderator des Panel Consortium, Dr. Harold Burstein, Dana-Farber Cancer Institute, Boston, Massachusetts, USA, als eines der Highlights der diesjährigen Konferenz erachtet, war die Debatte zur Kurabilität von oligometastatischem Mammakarzinom. In dieser Debate-Session lieferten sich je zwei Kontrahent:innen stichhaltige Argumente, weshalb sie pro bzw. kontra Heilbarkeit von OMD („oligometastatic disease“) sind, und untermauerten diese anhand von Studienergebnissen. Als Basis für die Diskussion wurde OMD als das Vorliegen von 1–5 Metastasen bei Verfügbarkeit sämtlicher infrastruktureller Ressourcen für ein multimodales Therapiemanagement definiert.17
Prof. Dr. Virginia Kaklamani, University of Texas Health, San Antonio, USA, bezog sich zu Beginn ihres Vortrags auf diverse internationale Guidelines, in denen die Kurabilität bestimmter Formen des fortgeschrittenen Mammakarzinoms nicht infrage gestellt wird. So ist in den Guidelines der European Society of Medical Oncology (ESMO) zu lesen, dass das Expertenpanel mit einer Mehrheit von 91% der Meinung ist, dass bei OMD oder einem Low-Volume-MBC mit einem kurativen, multimodalen Therapieansatz unter Miteinbezug der Metastasenlokalisationen eine komplette Remission erzielt und diesen Patient:innen ein langes OS ermöglicht werden kann.18 Analog dazu sprach sich auch das Consensuspanel der SGBCC 2023 mehrheitlich – und abhängig vom Mammakarzinomsubtyp – für diese Vorgehensweise mit Betonung auf einer zusätzlichen Metastasen-gerichtete Therapien aus.19
Als weitere Argumente pro kurative Vorgehensweise führte Kaklamani an, dass bei De-novo-Diagnose noch nicht umfassend viele genomische Alterationen vorliegen und in selektionierten Fällen daher der Tumorevolution präventiv entgegengewirkt werden kann.
Anhand von Beispielen aus klinischen Studien und Fallserien demonstrierte sie, dass das Erreichen einer NED („no evidence of disease“) bei Vorliegen eines Stadiums IV bei Diagnose sehr wohl möglich ist. Sie legte das u.a. anhand der Studie von Wang et al. mit 483 neu im Stadium IV diagnostizierten HER2+ Brustkrebspatient:innen dar, die mit Trastuzumab +/– Pertuzumab und lokoregionär behandelt worden waren. Die 63 Patient:innen, die eine NED erreicht hatten, wiesen ein progressionsfreies Überleben von 5 bis 10 Jahren und ein Gesamtüberleben von 98 bzw. 100% auf.20 Mit Betonung auf einer sorgfältigen Selektion der Patient:innen, bei denen realistischerweise eine NED angestrebt werden kann, ist Kaklamani absolut davon überzeugt, dass OMD das Potenzial für Kurabilität aufweist.
Prof. Dr. Stephen Chia, University of British Columbia, Vancouver, Kanada, versuchte dagegenzuhalten und brachte Daten aus klinischen Studien, wonach bei OMD-Patient:innen durch Zusatz von anderen Therapiemodalitäten zur SOC(Standard of Care)-Erstlinientherapie kein nachweislicher Outcome-Benefit erzielt werden konnte. Er räumte jedoch ein, dass in den wenigen dazu vorliegenden Studienergebnissen ein erhebliches Selektions-Bias besteht. Die Evaluierungen sind retrospektiv und entweder wurden Rezidivpatient:innen eingeschlossen21,22 oder solche mit diversen Tumorentitäten,21 woraus natürlich eine hohe Heterogenität resultiert.
Die Thematik OMD wurde auch im Rahmen des Consensus-Meetings am 15. März behandelt: Der Vorsitzende Harold Burstein schloss sich der Meinung von Kaklamani an, indem er konstatierte: „Ich glaube, dass es der klinischen Praxis entspricht, dass wir evaluieren, welche Patient:innen für eine Therapie in kurativer Intention geeignet sind.“
Prof. Dr. Monika Morrow, Memorial Sloan Kettering Cancer Center, Manhattan, New York, argumentierte, dass neue, speziell für OMD designte, prospektive Studien und längere FU-Perioden erforderlich sind, um Evidenz auf diesem Sektor zu schaffen. Die Ergebnisse des Panel-Votums zur Frage, ob bei Patient:innen mit sehr limitierter metastatischer Erkrankung bei der Verfügbarkeit von hocheffektiven Therapieoptionen eine definitive lokale Therapie stark in Betracht gezogen werden sollte, stimmen jedenfalls sehr zuversichtlich: 87,1% sprachen sich dafür aus, 12,9% waren dagegen.
Quelle:
19th SGBCC 2025, 12. – 15. März 2025, Wien
Literatur:
1 Johnston SRD et al.: J Clin Oncol 2020; 38(34): 3987-98 2 Rastogi P et al.: J Clin Oncol 2024; 442(9): 987-93 3 Blondeaux E et al.: J Clin Oncol 2024; EClinicalMedicine 2024; doi: 10.1016/j.eclinm.2024.102501 4 Conforti F et al.: J Clin Oncol 2025; doi: 10.1200/JCO-24-01360 5 Pistilli B et al.: J Clin Oncol 2020; 38(24): 2762-277 6 Ferreira AR et al.: Ann Oncol 2020; 30(11): 1784-95 7 Jhaveri KL et al.: N Engl J Med 2025; 392(12): 1189-202 8 Oliveira M et al.: SABCS 2024; Abstr. #LB1-06 9 Bardia A et al.: SABCS 2023; Abstr. #GS2-03 10 Spring LM et al.: Ann Oncol 2023; 35(3): 293-301 11 Trivedi S et al.: ESMO 2024; Abstr. #LBA15 12 Wang H, Yee D: Curr Breast Cancer Rep 2019; 11(4): 303-10 13 Loi S et al.: ASCO 2024; Abstr. #LBA507 14 Garcia-Murillas I et al.: Ann Oncol 2025; https://doi.org/10.1016/j.annonc.2025.01.021 15 Cabel L et al.: SABCS 2024; Poster #P2-01-25 16 Elliott MJ et al.: Clin Cancer Res 2025; doi: 10.1158/1078-0432.CCR-24-3472 17 Vargas C et al.: Ecancer 2019; 31(12): 1623-49 18 Cardoso F et al.: Ann Oncol 2020; 31(12): 1623-49 19 Curigliano G et al.: Ann Oncol 2023; 34(11): 970-86 20 Wong Y et al.: Oncologist 2019; 24: 313-18 21 Palma D et al.: J Clin Oncol 2020; 38(25): 2830-8 22 Chmura SJ et al.: ASCO 2022; Abstr. #1007
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...