Aktuelle Behandlungsstrategien für das Pankreaskarzinom
Autor:innen:
Dr. med. Louisa Hempel
Dr. med. Saskia Hussung
PD Dr. med. Ralph Fritsch
Klinik für Medizinische Onkologie und Hämatologie
Universitätsspital Zürich
Korrespondenz:
E-Mail: chiaralouisa.hempel@usz.ch
Adenokarzinome des Pankreas (PC) stellen unverändert eine grosse klinische Herausforderung dar. Die Heilungschancen für Betroffene sind selbst bei Karzinomen in lokalisierten Stadien schlecht, der Behandlungsansatz bei lokal fortgeschrittenen und metastasierten Tumoren ist palliativ. Wichtige Fortschritte zeichnen sich in der Weiterentwicklung multimodaler Behandlungsstrategien, der Verbesserung systemischer Therapiemöglichkeiten und in der molekular getriebenen Präzisionsbehandlung ab.
Keypoints
-
Resektable PC werden primär reseziert, die neoadjuvante Chemotherapie bleibt umstritten.
-
Die optimale neoadjuvante Strategie für Borderline-resektable PC ist unvollständig geklärt.
-
Erstlinienbehandlung mit einer Chemotherapie-Triplette (FOLFIRINOX) ist ein wichtiger Behandlungsstandard für jüngere, fitte Patienten.
-
Molekulares Tumorprofiling und Keimbahntestung gehören bei PC zum klinischen Standard.
-
Die Präzisionsbehandlung für definierte molekulare Subgruppen erweitert die Behandlungsmöglichkeiten beim PC.
Resektable Pankreaskarzinome
Die anatomische Resektabilität von Pankreaskarzinomen wird präoperativ CT-/MRT-basiert beurteilt. Dies erfolgt nach den Kriterien des National Comprehensive Cancer Network (NCCN) und modifiziert nach der IAP(Internationale Akademie für Pathologie)-Guideline. Dabei wird die anatomische Lage des Tumors in Hinsicht auf wichtige arterielle und venöse Strukturen – den Truncus coeliacus und seine Äste, die Arteria mesenterica superior und das Pfortadersystem – bewertet. Resektable Tumoren dürfen keinerlei Kontakt zu den vorgenannten Arterien und allenfalls minimalen Venenkontakt zeigen.1 Zudem ist bei der Entscheidung für die Resektion der Ausschluss von Fernmetastasen obligat. Therapiestandard für resektable Pankreaskarzinome ist unverändert die primäre Resektion, gefolgt von einer adjuvanten Chemotherapie mit modifiziertem FOLFIRINOX (5-FU, Leukovorin, Irinotecan, Oxaliplatin) basierend auf den Daten der PRODIGE-24-Studie.2
Der Wert einer neoadjuvanten Therapie wird schon seit längerer Zeit diskutiert. Diese Fragestellung untersucht gegenwärtig die amerikanische Alliance-A021806- Studie.3 Eine kleinere randomisierte skandinavische Phase-II-Studie (NORPACT-1) wurde kürzlich vorgestellt.4 Hier zeigte sich kein Vorteil durch die neoadjuvante Therapie; die Studie wurde wegen einer auffällig geringen Dosisdichte im neoadjuvanten Arm jedoch überwiegend kritisch kommentiert. Eine neoadjuvante Therapie resektabler Pankreaskarzinome wird in der neuen ESMO(European Society for Medical Oncology)-Leitlinie5 nicht empfohlen. Dagegen empfehlen aktuelle NCCN-Guidelines6 eine neoadjuvante Chemotherapie alternativ zur primären Resektion, was auf relevante Unterschiede in den Behandlungsstandards auf beiden Seiten des Atlantiks hinweist.
Borderline-resektable Pankreaskarzinome
Borderline-resektable Pankreaskarzinome (BRPC) sollten nie primär reseziert werden.5,6 Über die optimale Gestaltung der Vorbehandlung herrscht jedoch aufgrund der unzureichenden Datenlage wenig Einigkeit. In der randomisierten Phase-II-Studie ESPAC-5 zeigte sich ein Vorteil für neoadjuvante Therapie im Vergleich zur sofortigen Resektion.7 Allerdings lässt die niedrige Fallzahl keinen Vergleich zwischen den unterschiedlichen neoadjuvanten Protokollen (FOLFIRINOX, Gemcitabin plus Capecitabin, Radiochemotherapie) zu.
In den niederländischen Phase-III-Studien PREOPANC8 und PREOPANC-29 wurden resektable PC und BRPC zusammen untersucht, was die Aussagekraft der Ergebnisse insgesamt limitiert. In PREOPANC-2 fand sich in diesem Setting kein Vorteil für eine neoadjuvante Therapie mit FOLFIRINOX gegenüber neoadjuvanter Gemcitabin-basierter Radiochemotherapie, wobei das Studiendesign auch wegen geringer Dosisdichte im FOLFIRINOX-Arm (max. 8 Zyklen, keine adjuvante Therapie) kritisiert wurde.
Lokal fortgeschrittene und metastasierte Pankreaskarzinome
Für die systemische Therapie fortgeschrittener PC ergaben sich in den letzten Jahren kaum Weiterentwicklungen. Unverändert wird für Patienten mit einem ECOG Performance Status von 0–1 eine Kombinationschemotherapie empfohlen, entweder mit FOLFIRINOX oder Gemcitabin/nab-Paclitaxel. FOLFIRINOX wird in Leitlinien generell für die Erstlinienbehandlung bei Patienten mit einem guten ECOG-Status bevorzugt.10 Gemcitabin/nab-Paclitaxel ist in der Erstlinienbehandlung aufgrund des unterschiedlichen und im klinischen Alltag milderen Toxizitätsprofils im Vergleich zu FOLFIRINOX für Patienten in höherem Alter oder mit Begleiterkrankungen eine gute Alternative.
Die vor Kurzem publizierte Phase-III-Studie NAPOLI-3 zeigte ein verlängertes Gesamtüberleben in einer molekular nicht vorselektionierten Population unter der auf der Basis von FOLFIRINOX entwickelten Triplette NALIRIFOX gegenüber Gemcitabin/nab-Paclitaxel.11 Diese Daten unterstreichen zwar die Überlegenheit einer Erstlinientriplette gegenüber einer Doublette, der klinische Einsatz von NALIRIFOX wird jedoch aufgrund fehlender Überlegenheit gegenüber konventionellem FOLFIRINOX im Quervergleich bei gleichzeitig weitaus höheren Kosten als obsolet wahrgenommen. Für die Zweit- und Drittlinientherapie empfehlen aktuelle Leitlinien die Umstellung der Chemotherapie abhängig von der Erstlinienwahl.5
Präzisionsbehandlung von Pankreaskarzinomen
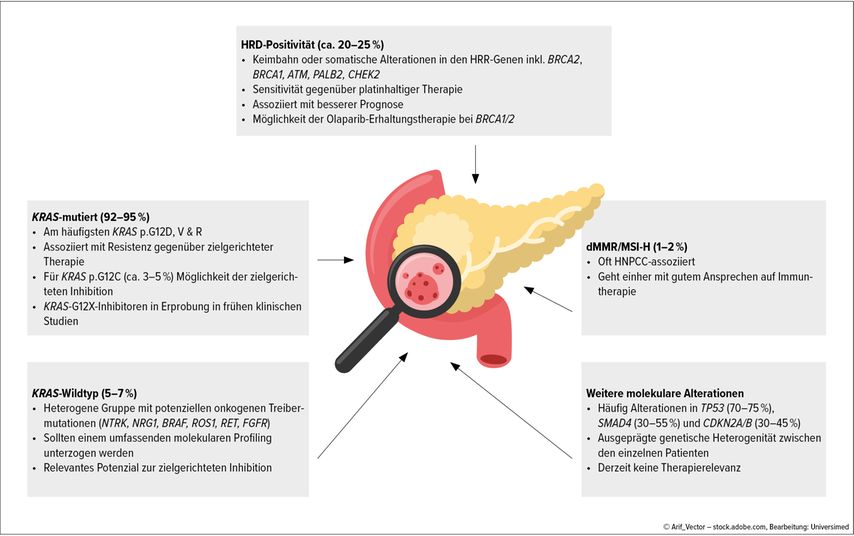
Wichtige Fortschritte wurden in der Präzisionsbehandlung definierter molekularer PC-Subgruppen erzielt (Abb. 1). Gleichzeitig liegt in der Weiterentwicklung molekular zielgerichteter Therapien, besonders der Hemmer des KRAS-Signalwegs, viel Potenzial für die PC-Behandlung. Dementsprechend empfehlen NCCN- und ESMO-Leitlinien mittlerweile molekulares Tumorprofiling für alle Patienten mit fortgeschrittenem PC.5,6 Darüber hinaus sollten alle Patienten einer Keimbahntestung für BRCA1 und BRCA2 unterzogen werden.
Abb. 1: Molekulare Subgruppen des Pankreaskarzinoms. Mutationen im KRAS-Gen sind charakteristisch für das duktale Adenokarzinom der Bauchspeicheldrüse (PC). Allerdings werden zunehmend weitere therapierelevante Veränderungen identifiziert (modifiziert nach Akhoundova D et al.17)
HRD-Pankreaskarzinome
Die häufigsten molekularen Alterationen mit therapeutischer Konsequenz beim PC sind Alterationen in homologen Rekombinationsreparatur-Signalwegen (HRR). Pankreaskarzinome mit homologem Rekombinationsdefekt (HRD-PC) zeigen exquisite Platinsensitivität und sollten in der Erstlinienbehandlung mit platinhaltiger Chemotherapie behandelt werden. Dies impliziert, dass die molekulare Testung möglichst vor dem Einleiten der Erstlinientherapie erfolgen soll, vor allem, wenn eine platinfreie Therapie geplant ist.5
Bei BRCA1/2-mutierten PC steht zudem eine Erhaltungstherapie mit Olaparib auf Basis der POLO-Studie zur Verfügung.12
KRAS-WT-Pankreaskarzinome
Die zweite wichtige Gruppe sind jene 5–7% aller PC, die keine KRAS-Mutation tragen (KRAS-WT-PC). Bei diesen Tumoren finden sich mitunter therapeutisch angehbare seltene onkogene Treiber. Diese können zum Beispiel Klasse-2-BRAF-Mutationen sowie genomische Rearrangements in NTRK, NRG1, BRAF, ROS1, RET und FGFR-Genen umfassen. KRAS-WT-PC sollten daher stets einer umfassenden genomischen Analyse unterzogen werden.10
KRAS-gerichtete Therapien
Aktivierende Mutationen im KRAS-Gen sind die häufigste genomische Alteration bei PC. Derzeit kann Patienten mit der spezifischen KRAS-Punktmutation p.G12C (Inzidenz PC: 2–3%) eine zielgerichtete Therapie mit Sotorasib angeboten werden. Die Wirksamkeit von Sotorasib bei bestätigter KRAS-p.G12C wurde in der Phase-I/II-Studie CodeBreaK 100 nachgewiesen. Weiterhin wurde Adagrasib in KRYSTAL-1 (Phase-II-Studie) untersucht.13,14
Neue Studiendaten für den ersten Pan-RAS-Inhibitor, der auch bei anderen KRASPunktmutationen zum Einsatz kommen könnte, wurden auf dem ESMO 2023 präsentiert. Die Phase-I-Studie RMC-6236-001 untersuchte die Studiensubstanz RMC-6236 unter anderem bei 46 Patienten mit intensiv vorbehandeltem PC mit KRAS-p.G12X-Mutationen.15 Es wurden eine Gesamtansprechrate (ORR) von 20% sowie eine Krankheitskontrollrate (DCR) von 87% berichtet. Zahlreiche weitere neue Inhibitoren von KRAS und KRAS-abhängiger Signalübertragung sind auf dem Weg in frühe klinische Studien, sodass die KRAS-Inhibition sicherlich die derzeit aufregendste Neuentwicklung in der Therapie des PC darstellt.
MSI-H-Pankreaskarzinome
Selten (etwa 1%), aber therapeutisch hochrelevant sind «mismatch repair»-defiziente (dMMR), Mikrosatelliten-instabile PC. Sie zeigen exquisite Sensitivität gegenüber Anti-PD-1-/PD-L1-Checkpoint-Inhibitoren. Eine vor Kurzem publizierte multinationale Kohortenstudie unterstreicht dies eindrücklich.16 In der klinischen Routine ist es wichtig, diese wenigen Patienten nicht zu übersehen und ihnen konsequent Immuntherapie anzubieten.
Literatur:
1 Kwaśniewska D et al.: How a patient with resectable or borderline resectable pancreatic cancer should be treated—a comprehensive review. Cancers (Basel) 2023; 15(17): 4275 2 Conroy T et al.: FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med 2018; 379(25): 2395-406 3 Chawla A et al.: Alliance A021806: a phase III trial evaluating perioperative versus adjuvant therapy for resectable pancreatic cancer. J Clin Oncol 2023; 41(16_suppl): TPS4204 4 Labori KJ et al.: Short-course neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer: a multicenter randomized phase-II trial (NORPACT-1). J Clin Oncol 2023; 41(17_suppl): LBA4005 5 Conroy T et al.: Pancreatic cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(11): 987-1002 6 Tempero MA et al.: Pancreatic adenocarcinoma, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2021; 19(4): 439-57 7 Ghaneh P et al.: Immediate surgery compared with short-course neoadjuvant gemcitabine plus capecitabine, FOLFIRINOX, or chemoradiotherapy in patients with borderline resectable pancreatic cancer (ESPAC5): a four-arm, multicentre, randomised, phase 2 trial. Lancet Gastroenterol Hepatol 2023; 8(2): 157-68 8 Versteijne E et al.: Neoadjuvant chemoradiotherapy versus upfront surgery for resectable and borderline resectable pancreatic cancer: long-term results of the Dutch randomized PREOPANC trial. J Clin Oncol 2022; 40(11): 1220-30 9 Janssen QP et al.: Total neoadjuvant FOLFIRINOX versus neoadjuvant gemcitabine-based chemoradiotherapy and adjuvant gemcitabine for resectable and borderline resectable pancreatic cancer (PREOPANC-2 trial): study protocol for a nationwide multicenter randomized controlled trial. BMC Cancer 2021; 21: 300 10 Conroy T et al.: Pancreatic cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(11): 987-1002 11 Wainberg ZA et al.: NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. Lancet 2023; 402(10409): 1272-81 12 Kindler HL et al.: Overall survival results from the POLO trial: a phase III study of active maintenance olaparib versus placebo for germline BRCA-mutated metastatic pancreatic cancer. JClini Oncol 2022; 40(34): 3929-39 13 Strickler JH et al.: Sotorasib in KRAS p.G12C–mutated advanced pancreatic cancer. N Engl J Med 2023; 388(1): 33-43 14 Bekaii-Saab TS et al.: KRYSTAL-1: Updated activity and safety of adagrasib (MRTX849) in patients (pts) with unresectable or metastatic pancreatic cancer (PDAC) and other gastrointestinal (GI) tumors harboring a KRAS G12C mutation. JClin Oncol 2022; 40(4_suppl): 519 15 Sacher A et al.: Single-agent divarasib (GDC-6036) in solid tumors with a KRAS G12C mutation. N Engl J Med 2023; 389(8): 710-21 16 Taïeb J et al.: Efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repair-deficient advanced pancreatic adenocarcinoma: an AGEO European Cohort. Eur J Cancer 2023; 188: 90-7 17Akhoundova D et al.: Precision oncology for hepato-pancreato-biliary (HPB) cancers state of the art and future directions. healthbook TIMES Oncology Hematology 2020; 5(3): 52-9
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...