Hirntumor, oder doch etwas anderes? Wenn andere Erkrankungen bösartige Hirntumoren bildgebend imitieren
Autoren:
Dr. med. Johanna Maria Lieb
Dr. med. Julian Gehweiler
Abteilung diagnostische und interventionelle Neuroradiologie
Klinik für Radiologie und Nuklearmedizin
Universitätsspital Basel
Korrespondierende Autorin:
Dr. med. Johanna Maria Lieb
E-Mail: johanna.lieb@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Überbegriff «Hirntumor» stellt ein Spektrum an Gewebewucherungen des Gehirns oder umgebender Strukturen dar. Gutartige Hirntumoren wachsen langsam und können meist kurativ behandelt werden (z.B. Meningeome oder Schwannome). Bösartige Hirntumoren (z.B. höhergradige Astrozytome) wachsen schneller und dringen infiltrativ in das umliegende Hirngewebe ein, eine Heilung ist oft nicht möglich. Andere Erkrankungen wie demyelinisierende Erkrankungen, Blutungen oder Hirnabszesse können bösartige Tumoren im MRI imitieren; auf diese wird im Folgenden näher und mit bildgebenden Beispielen eingegangen.
Keypoints
-
Es gibt viele nicht tumoröse Erkrankungen, die einen Hirntumor im MRI nachahmen können. Eine Differenzierung kann im MRI mit speziellen Sequenzen/Techniken gelingen, was eine Operation/Biopsie verhindern und eine Therapie präzisieren kann.
-
Demyelinisierende Erkrankungen können tumefaktiv sein, eine Kontrastmittelaufnahme in Form eines offenen Rings zeigen, sind meist um Venulen zentriert (zentrale Vene) oder haben entzündliche Begleiterscheinungen (Optikusneuritis, spinale Läsionen oder auffälligen Liquor).
-
Hirnabszesse sind zumeist gehäuft, haben eine mit Granulationsgewebe ausgekleidete Kapsel, eine reduzierte Diffusionsfähigkeit aufgrund ihres viskösen Inhalts und zeigen Abbauprodukte der bakteriellen Fermentation/Proteolyse in der MR-Spektroskopie.
-
Intraparenchymatöse Blutungen können in unterschiedlichen Stadien, Umbau- und Abbauphasen schwierig von Tumoren abgegrenzt werden. Perfusionsanalysen oder eine CT können bei der Abgrenzung helfen. Auch unter «einfach» imponierenden Blutungen können sich Tumoren verbergen. Verlaufsuntersuchungen sind hier unerlässlich.
Oft wird eine Raumforderung bereits in einer Computertomografie (CT) des Schädels entdeckt, diese ist aber nicht obligatorisch und ersetzt keine Magnetresonanztomografie (MRI). Eine CT kann ergänzend durchgeführt werden, wenn es um die Beurteilung von Knocheninfiltration, Verkalkungen oder Blutanteile geht. Eine multiparametrische MRI mit Tumorprotokoll ist die Methode der Wahl, um unklare Raumforderungen zu charakterisieren. Das hierfür benötigte Protokoll ist nicht standardisiert, sollte aber eine 3D-T1-Wichtung ohne und mit Kontrastmittel, eine T2- und FLAIR-Wichtung, die Diffusionswichtung, ggf. eine Perfusionsanalyse und bei Bedarf auch eine MR-Spektroskopie beinhalten.1
Dieses ausführliche MR-Protokoll ist notwendig, da nicht tumoröse raumfordernde Prozesse bzw. Erkrankungen maligne Tumoren imitieren können. Eine präzise Diagnose bzw. Differenzierung ist notwendig, um unnötige Biopsien oder operative Eingriffe zu verhindern und um andererseits zügig die richtigen Therapien einzuleiten. Klinisch-neurologische Informationen, Patientenalter, Medikamente, Reiseanamnese und Angaben zum Immunstatus sind für die Zuordnung tumoröser oder tumefaktiver Veränderungen oft zwingend notwendig.
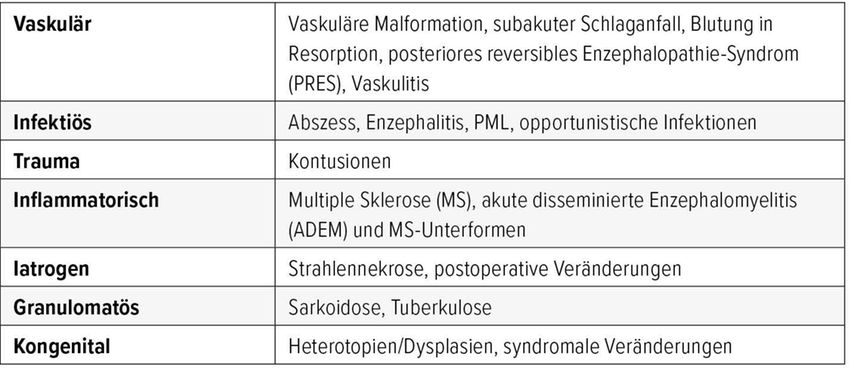
Tab. 1 zeigt eine Übersicht über verschiedenste Krankheitsbilder und Veränderungen, die einen Hirntumor imitieren können. Demyelinisierende Läsionen, Blutungen und Hirnabszesse werden in diesem Artikel näher erläutert, da die Diagnosestellung wichtig ist, um die betroffenen Patienten zielgerichtet medikamentös, ohne Operation oder sogar auch ohne Biopsie zu behandeln.
Demyelinisierende Erkrankungen
Generell haben entzündlich-demyelinisierende Läsionen oft eine klassische Verteilung und Lokalisation, sind häufig ovalär periventrikulär und finden sich typisch an der callososeptalen Oberfläche. Demyelinisierende Läsionen treten zudem meist gehäuft und nicht singulär auf. Auch das Nebeneinander von Läsionen mit und ohne Schrankenstörung ist typisch.2
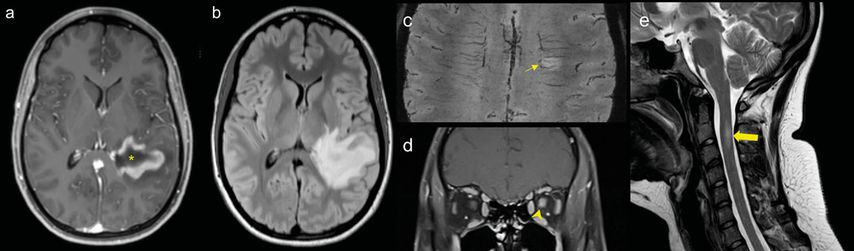
Demyelinisierende Erkrankungen wie die Multiple Sklerose (MS) oder die akute disseminierte Enzephalomyelitis (ADEM) können sich ebenfalls als raumfordernder (= tumefaktiver) Prozess manifestieren.3 Diese Differenzialdiagnose muss insbesondere dann in Betracht gezogen werden, wenn es sich um junge Patienten handelt. Sind die Läsionen grösser und aktiv, haben sie oft ein umgebendes Ödem mit assoziierter Kontrastmittelaufnahme (= Schrankenstörung) und können damit höhergradige Gliome oder Lymphome nachahmen (Abb.1a und 1b); typischerweise haben die Läsionen aber weniger umgebendes Ödem als zerebrale Neoplasien.4
Bei bösartigen Hirntumoren/Metastasen ist die Diffusionsfähigkeit von Wasser in den soliden Anteilen eingeschränkt, wohingegen sie bei demyelinisierenden Läsionen eher erhöht ist. Auch in der Durchblutung/Perfusion unterscheiden diese sich. Die Perfusion von demyelinisierenden Läsionen ist im Vergleich zu Hirntumoren eher normal bis allenfalls gering erhöht.5
Ein diagnostischer Hinweis ist das Vorhandensein einer Kontrastmittelaufnahme in Form eines offenen Rings («open ring enhancement», Abb.1a). Der kontrastmittelaufnehmende Wall repräsentiert hierbei die fortschreitende Demyelinisierung und zeigt eher in Richtung der weissen Substanz.6
Der Nachweis einer zentralen Vene auf einer T2*-gewichteten Sequenz (Abb.1c) kann ein zusätzlicher Marker für eine Multiple Sklerose sein, da sich die Entzündung meist perivenulär ausdehnt.7 Das Zeichen ist nicht pathognomonisch, aber kann helfen, eine MS mit einer hohen Sensitivität/Spezifität von anderen Erkrankungen (u.a. von «small vessel disease», NMO)8,9 zu differenzieren, wenn ein Grossteil der Läsionen ein solches «central vein sign» zeigt. Auch die MR-Spektroskopie kann bei der Abgrenzung von Tumoren und demyelinisierenden Läsionen manchmal helfen,10,11 jedoch gibt es Überschneidungsbereiche vor allem im akuten Stadium von entzündlichen Läsionen.12
Bei dem Verdacht auf eine entzündlich-demyelinisierende Erkrankung ist zusätzlich eine MRI-Untersuchung der gesamten spinalen Achse empfohlen, da eine spinale und insbesondere zervikale Beteiligung bei der Multiplen Sklerose nicht selten ist (Abb.1e).13 Eine begleitende oder stattgehabte Optikusneuritis (Abb.1d) und auch der Nachweis von oligoklonalen Banden und einer lymphozytären Pleozytose in der Lumbalpunktion helfen bei der Diagnosestellung.14 Gelingt die Differenzierung mittels Bildgebung und mittels Verlaufs-MRI-Untersuchungen über die Zeit nicht, kann auch bei tumefaktiven entzündlichen Läsionen eine Biopsie zur sicheren Differenzierung zum Tumor notwendig werden. Sehr selten kann auch diese allerdings fehlinterpretiert werden.15
Abb. 1: Schädel-MRI einer Patientin mit tumefaktiver Multipler Sklerose. (a) Klassisch ist die Kontrastmittelaufnahme eines offenen Rings (Asterisk). (b) Grosse Läsionen können ein perifokales Ödem in FLAIR aufweisen. (c) Der Nachweis einer zentralen Vene spricht für eine demyelinisierende Erkrankung, genauso wie das Vorliegen einer (d) Optikusneuritis (Pfeilspitze) oder der Nachweis von (e) spinalen Läsionen (breiter Pfeil)
Hirnabszess
Ein Hirnabszess ist eine abgekapselte, am häufigsten bakterielle Infektion des Hirnparenchyms. Abszesse können durch Durchbruch einer Otomastoiditis/Sinusitis entstehen, posttraumatisch/operativ oder durch hämatogene Streuung.
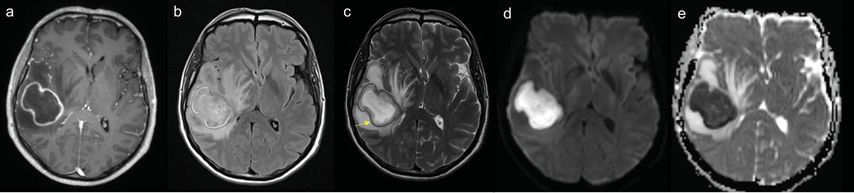
Im MRI präsentieren sich diese meist als ringförmig kontrastmittelaufnehmende raumfordernde Läsionen mit perifokalem Ödem (Abb.2a und 2b). Damit können sie nekrotische Tumoren und Metastasen perfekt nachahmen. In den meisten Fällen treten Hirnabszesse gehäuft auf.
Aufgrund ihrer hohen Viskosität zeigen Abszesse eine verminderte Diffusionsfähigkeit von Wasser (Diffusionsrestriktion mit hellem Signal in DWI, Abb.2d, und niedrigem/dunklem Wert in ADC, 2e). Dieses charakteristische Signalverhalten hat eine sehr hohe Sensitivität, ist jedoch nicht pathognomonisch für Abszesse.16-18 Erwähnenswert ist in diesem Kontext, dass auch Lymphome aufgrund ihrer sehr hohen Zelldichte eine Diffusionsrestriktion aufweisen.
Typisch für Abszesse ist zudem eine in der T2-Wichtung hypointense Kapsel, die sich bei Hirntumoren nicht abgrenzen lässt. Manchmal lässt sich in T2 oder der blutungssensitiven SWI-Sequenz innerhalb dieser Kapsel ein weiterer Saum abgrenzen (sog. «dual rim sign», Abb.2c). Man nimmt an, dass dieses Zeichen durch die Auskleidung der fibrokollagenen Abszesskapsel durch Granulationsgewebe zustande kommt.16
Abb. 2: Schädel-MRI eines Abszesses in den folgenden Sequenzen: (a) axiale T1w post KM mit ringförmiger Kontrastmittelaufnahme, (b) deutlichem perifokalem Ödem in FLAIR, (c) einer T2w-hypointensen Kapsel mit «dual rim sign» (gelber Pfeil) und einer Diffusionsrestriktion mit (d) DWI-hyperintensem Signal mit (e) ADC-Absenkung
In der dynamischen Kontrastmitteluntersuchung zeigt sich die Perfusion des kontrastmittelaufnehmenden Anteils bei Abszessen im Gegensatz zu höhergradigen Gliomen deutlich vermindert.17 Die Unterscheidung vermag auch in der MR-Spektroskopie zu gelingen, es lassen sich in bakteriellen Abszessen oft Endprodukte der bakteriellen Fermentation und Proteolyse nachweisen (Acetat, Sukzinat, Lipide und andere zytosolische Aminosäuren).18,19 Das Fehlen dieser Nachweise schliesst einen pyogenen Ursprung aber nicht aus.20
Hirnblutungen
Parenchymblutungen können aufgrund verschiedenster Ursachen entstehen, am häufigsten durch Traumata oder hypertensiv. Tritt die Blutung spontan auf, liegt keine Hypertonie vor oder ist die Blutung atypisch lokalisiert, muss an seltenere Ursachen gedacht werden: vaskuläre Malformationen, subakute Schlaganfälle, subakute Blutungen oder andere vaskuläre Ätiologien, wie z.B. die Amyloidangiopathie.21 Insbesondere eine Blutung im subakuten Stadium kann täuschend einem eingebluteten Tumor ähneln, da diese manchmal eine kapselartige randständige Kontrastmittelaufnahme mit perifokalem Ödem aufweisen kann.22
Andersherum kann sich auch ein Tumor innerhalb einer einfach imponierenden Blutung verstecken («maskiert sein»). Insbesondere das Glioblastom und hier vor allem das Oligodendrogliom zeigen vereinzelt Einblutungen.23 Auch manche Metastasen (z.B. Melanome und auch Nierenzell-, Chorion-, Lungen-, Mamma- und Schilddrüsenkarzinome) neigen zur Einblutung.24 Daher sind bildgebende Verlaufsuntersuchungen in und nach der Phase der Blutungsresorption unerlässlich.
Im MRI stellt diese Differenzierung/Fragestellung eine diagnostische Herausforderung dar, da sich je nach Blutungsstadium das Signal und eine Kontrastmittelaufnahme stark unterscheiden können. Begleiterscheinungen (weitere Mikroblutungen, Gefässveränderungen/-malformationen, Thrombosen) helfen bei der Einordnung. Auch die Ergänzung einer initialen Computertomografie oder einer MRI-Perfusionsanalyse ist sinnvoll.
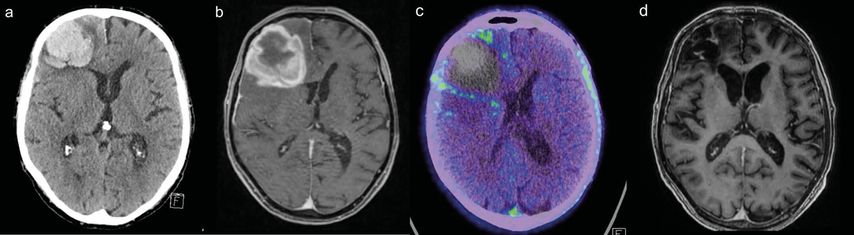
Wesentlich sind die Betrachtung des gesamten zeitlichen Verlaufes und auch die bildgebende Verlaufskontrolle der Blutung. Eine «gewöhnliche» Parenchymblutung sollte über die Zeit eine rückläufige Grösse zeigen (negative Dynamik). Abbildung 3 visualisiert einen Fall, bei dem eine Parenchymblutung zeitweise einem Tumor ähnelte. Im Verlauf wird nach Blutungsresorption ein zugrunde liegender Tumor ausgeschlossen.
Abb. 3: Panel (a) zeigt ein Schädel-CT eines Patienten mit atypischer atraumatischer Lobärblutung rechts frontal. (b) Ein Monat später in der MRI-Verlaufskontrolle ähnelte diese nun subakute Blutung einem raumfordernden Tumor. (c) Die anschliessend zum Tumorausschluss durchgeführte F-18-Fluorethyltyrosin-Positronen-Emissions-Tomografie (FET-PET) zeigt keinen Hinweis auf anreicherndes Tumorgewebe innerhalb der Blutung. (d) 5 Monate nach der ersten Computertomografie resorbiert sich die Blutung zunehmend und hinterlässt einen Defekt, ein zugrundeliegender Tumor lag nicht vor
Zusammenfassung
Einige nicht tumoröse Erkrankungen können differenzialdiagnostisch Hirntumoren imitieren. Eine treffende Beurteilung ist oft erst im Gesamtkontext der Krankengeschichte vor dem Hintergrund des Patientenalters, existierender oder zu erhebender Laborbefunde, des Immunstatus, von Zusatzerkrankungen und auch mittels kurzfristiger Verlaufsuntersuchungen oder ergänzender spinaler Untersuchungen möglich. Im Zweifel und bei fehlender negativer Dynamik oder sogar Befundprogress sollte eine bioptische Diagnosesicherung angestrebt werden.
Literatur:
1 Kaufmann TJ et al.: Consensus recommendations for a standardized brain tumor imaging protocol for clinical trials in brain metastases. Neuro Oncol 2020; 22(6): 757-72 2 Sarbu N et al.: White matter diseases with radiologic-pathologic correlation. Radiographics 2016; 36(5): 1426-47 3 Dagher AP, Smirniotopoulos J: Tumefactive demyelinating lesions. Neuroradiology 1996; 38(6): 560-5 4 Hayashi T et al.: Inflammatory demyelinating disease mimicking malignant glioma. J Nucl Med 2003; 44(4): 565-9 5 Hartmann M et al.: Funktionelle MR-Verfahren in der Diagnostik intraaxialer Hirntumoren: Perfusions- und Diffusions-Bildgebung. RöFo Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren. Stuttgart – New York: Georg Thieme Verlag, 2002; 174: 955-64 6 Masdeu JC et al.: Open-ring imaging sign: highly specific for atypical brain demyelination. Neurology 2000; 54(7): 1427-33 7 Gaitán MI et al.: Evolution of the blood-brain barrier in newly forming multiple sclerosis lesions. Ann Neurol 2011; 70(1): 22-9 8 Tallantyre EC et al.: A comparison of 3T and 7T in the detection of small parenchymal veins within MS lesions. Invest Radiol 2009; 44(9): 491-4 9 Suh CH et al.: The “central vein sign” on T2*-weighted images as a diagnostic tool in multiple sclerosis: a systematic review and meta-analysis using individual patient data. Sci Rep 2019; 9(1): 18188 10 Law M et al.: Spectroscopic magnetic resonance imaging of a tumefactive demyelinating lesion. Neuroradiology 2002; 44(12): 986-9 11 Cianfoni A et al.: Metabolite findings in tumefactive demyelinating lesions utilizing short echo time proton magnetic resonance spectroscopy. Am J Neuroradiol 2007; 28(2): 272-7 12 Saindane AM et al.: Proton MR spectroscopy of tumefactive demyelinating lesions. Am J Neuroradiol 2002; 23(8): 1378-86 13 Rovira Á et al.: Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis - clinical implementation in the diagnostic process. Nat Rev Neurol 2015; 11(8): 471-82 14 Dobson R et al.: Cerebrospinal fluid oligoclonal bands in multiple sclerosis and clinically isolated syndromes: a meta-analysis of prevalence, prognosis and effect of latitude. J Neurol Neurosurg Psychiatry 2013; 84(8): 909-14 15 Hunter SB et al.: Multiple sclerosis mimicking primary brain tumor. Arch Pathol Lab Med 1987; 111(5): 464-8 16 Toh CH et al.: Differentiation of pyogenic brain abscesses from necrotic glioblastomas with use of susceptibility-weighted imaging. Am J Neuroradiol 2012; 33(8): 1534-8 17 Holmes TM et al.: Distinction between cerebral abscesses and high-grade neoplasms by dynamic susceptibility contrast perfusion MRI. Am J Roentgenol 2004; 183(5): 1247-52 18 Grand S et al.: Necrotic tumor versus brain abscess: importance of amino acids detected at 1H MR spectroscopy - initial results. Radiology 1999; 213(3): 785-93 19 Harting I et al.: Tumor-simulierende Läsionen in der kranialen MRT. RöFo Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren. Stuttgart - New York: Georg Thieme Verlag, 2004; 176: 302-12 20 Pal D et al.: In vivo proton MR spectroscopy evaluation of pyogenic brain abscesses: a report of 194 cases. Am J Neuroradiol 2010; 31(2): 360-6 21 Kidwell CS, Wintermark M: Imaging of intracranial haemorrhage. Lancet Neurology 2008; 7(3): 256-67 22 Kamide T et al.: A chronic encapsulated intracerebral hematoma mimicking a brain tumor: findings on arterial spin labeling of MRI. Neuroradiol J 2016; 29(4): 273-6 23 Kondziolka D et al.: Significance of hemorrhage into brain tumors: clinicopathological study. J Neurosurg 1987; 67(6): 852-7 24 Mandybur TI: Intracranial hemorrhage caused by metastatic tumors. Neurology 1977; 27(7): 650-5
Das könnte Sie auch interessieren:
Nahrungsergänzungsmittel bei ME/CFS: neue Hoffnung oder falsche Versprechen?
Chronische Erschöpfung, die nicht vergeht, Schmerzen, Konzentrationsprobleme, ein Leben in Zeitlupe. Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom (ME/CFS) betrifft weltweit ...
Schlafbezogene Bewegungsstörungen: Was ist bekannt, was ist neu?
Schlafbezogene Bewegungsstörungen sind eine heterogene Krankheitsgruppe. Viele Krankheitsbilder treten nur selten auf. Einige wie die periodischen Beinbewegungen im Schlaf („periodic ...
Highlights zu neurodegenerativen Erkrankungen vom EAN-Kongress
Prof. Dr. Elena Moro, Präsidentin der European Academy of Neurology (EAN), eröffnete den elften Kongress der Vereinigung in Helsinki. Führende Expert:innen verschiedener Fachrichtungen ...