Schlafbezogene Bewegungsstörungen: Was ist bekannt, was ist neu?
Autorinnen: Dr. Magdalena Wildt* Dr. Merve Aktan Süzgün* Dr. Ambra Stefani, PhD
Universitätsklinik für Neurologie
Medizinische Universität Innsbruck
E-Mail: ambra.stefani@i-med.ac.at
* Beide Autorinnen haben gleichermaßen zu diesem Manuskript beigetragen.
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Schlafbezogene Bewegungsstörungen sind eine heterogene Krankheitsgruppe. Viele Krankheitsbilder treten nur selten auf. Einige wie die periodischen Beinbewegungen im Schlaf („periodic limb movements in sleep“, PLMS) sind derzeit nur ein polysomnografischer Befund mit ungeklärter klinischer Bedeutung. Andere wie das Restless-Legs-Syndrom (RLS) können hingegen bei Patient:innen zu schweren Beeinträchtigungen führen. Aber auch noch weniger bekannte Krankheiten wie die Restless Sleep Disorder (RSD) können bei den Patient:innen zu bedeutendem Leidensdruck führen.
Keypoints
-
Die Pathogenese des RLS ist multifaktoriell. Verschiedene Faktoren beeinflussen sich gegenseitig.
-
Die Eisentherapie hat große Bedeutung und wird ab einem Ferritinwert von ≤100ng/mL oder einer Transferrinsättigung <20% empfohlen.
-
Als Erste-Linie-Therapie des RLS gelten α2δ-Liganden. In Europa sind diese bisher nur „off-label“ zugelassen. Europäische Guidelines befinden sich derzeit in Überarbeitung.
-
Dopaminerge Therapien sollten nur in bestimmten Fällen über den kürzestmöglichen Zeitraum und in der minimaleffektiven Dosierung eingesetzt werden. Frühes Erkennen und Therapieren einer Augmentation sind essenziell.
-
Die RSD ist eine neue diagnostische Kategorie in der Schlafmedizin. Verstärkte Bewegun-gen großer Muskelgruppen während des Schlafs beeinflussen die Schlafarchitektur negativ und sind auch mit einer Beeinträchtigung alltägliche Aktivitäten verbunden.
-
Pathophysiologisch steht die RSD ähnlich wie das RLS wahrscheinlich im Zusammenhang mit Eisenmangel des zentralen Nervensystems, erhöhter Schlafinstabilität und gestörter autonomer Regulation.
-
Obwohl die offiziellen Diagnosekriterien der RSD derzeit nur für die pädiatrische Altersgruppe gelten, gibt es überzeugende Hinweise auf die klinische Relevanz von RSD im Erwachsenenalter. Das gilt für RSD als eigenständige Entität und auch als Komorbidität anderer Schlafstörungen.
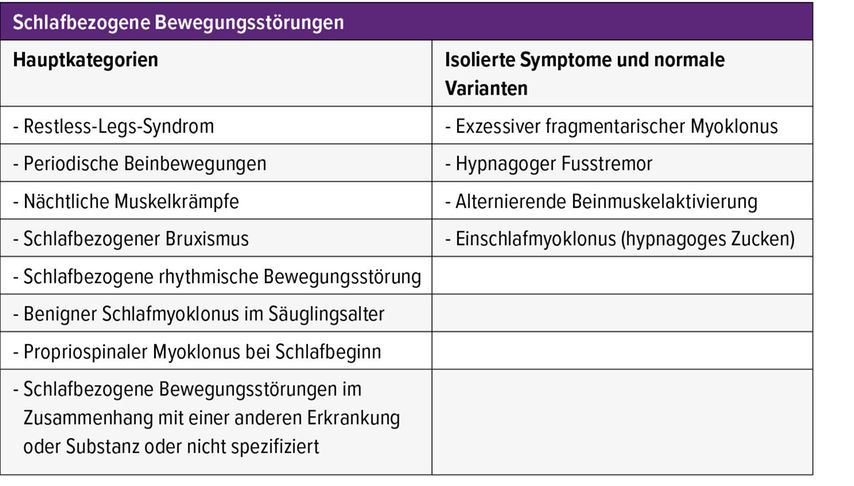
Nach der aktuellen Version der Internationalen Klassifikation der Schlafstörungen (International Classification of Sleep Disorders, Version 3, Text Revision, ICSD-3-TR) werden schlafbezogene Bewegungsstörungen in isolierte Symptome und normale Varianten eingeteilt (Tab.1).1 Viele schlafbezogene Bewegungsstörungen treten nur selten auf oder stellen elektrophysiologische Befunde ohne nachgewiesene klinische Relevanz dar. In diesem Artikel wird daher die häufigste Form der schlafbezogenen Bewegungsstörungen, das RLS, einschließlich aktueller Behandlungsempfehlungen dargestellt. Des Weiteren wird die Restless Sleep Disorder (RSD) dargestellt, welche bislang nicht in der ICSD klassifiziert ist, jedoch potenziell bedeutende klinische Implikationen im Kontext schlafbezogener Bewegungsstörungen aufweist.
Tab. 1: Schlafbezogene Bewegungsstörungen; Kategorien laut der aktuellen Klassifizierung (ICSD-3-TR)
RLS: die häufigste Form der schlafbezogenen Bewegungsstörungen
RLS ist mit einer geschätzten weltweiten Prävalenz von 11% eine sehr häufige Erkrankung. Südamerika und Europa weisen mit 16% die höchsten Prävalenzen auf. Frauen sind mit einer Prävalenz von 11% im Vergleich zu Männern mit 7% häufiger betroffen.2 Betroffene leiden unter Beeinträchtigungen des Schlafes sowie sozialer Funktionen und der Produktivität am Arbeitsplatz.3
Diagnose
Für die Diagnose eines RLS müssen laut International Restless Legs Syndrome Study Group (IRLSSG) folgende fünf Kriterien erfüllt sein:4
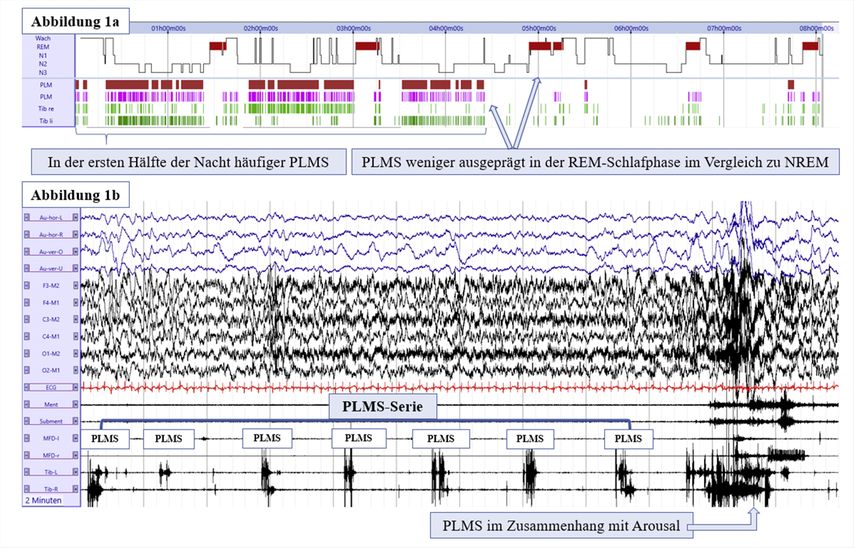
Die klinisch-neurologische Untersuchung und die Anamnese sind in der Diagnosestellung insbesondere aufgrund des Fehlens eines diagnostischen biologischen Markers von großer Bedeutung. EMG und neurologische Untersuchung sind bei RLS unauffällig, die Symptomatik ist zirkadian, es besteht Ansprechen auf dopaminerge Therapie und familiäres Auftreten sowie Assoziation mit Eisenmangel sind häufig.5 Patient:innen beschreiben die Symptomatik unterschiedlich, beispielsweise als Drang, aufzustehen, zu gehen, zu laufen oder sich zu dehnen. Sie berichten teils von einem Gefühl, als würden Ameisen über das Bein laufen. Die Empfindungen können unter anderem als unangenehm, schmerzhaft, kribbelnd,6 brennend oder juckend beschrieben werden.7 Häufig sind PLMS mit RLS assoziiert.5 So können sich in der Polysomnografie (PSG) typische PLMS zeigen (Abb. 1).
Abb. 1: Fallbeispiel und typische Merkmale von periodischen Beinbewegungen im Schlaf („periodic limb movements in sleep“, PLMS) bei Patient:innen mit Restless-Legs-Syndrom. 1a: Hypnogramm und Übersicht über die PLMS über die ganze Nacht. 1b: einzelne PLMS, PLMS-Serien und ein PLMS, der eine Arousal-Reaktion auslöst, in einem zweiminütigen Schlafabschnitt. REM: Rapid-Eye-Movements-Schlafstadium, NREM: Non-Rapid-Eye-Movements-Schlafstadium (Zentrum für Schlafmedizin, Univ.-Klinik für Neurologie, Medizinische Universität Innsbruck)
Pathogenese
Ein Zusammenspiel von genetischen Risikofaktoren, Komorbiditäten und Umwelteinflüssen kann RLS auslösen.8 Mittels genomweiter Assoziationsstudien wurden genetische Varianten mit erhöhtem Risiko für RLS identifiziert, die Vererbbarkeit des RLS wird auf 50–60% geschätzt.9,10 Außerdem soll hier vor allem auf die Rolle des Eisenstatus sowie von Dopamin bei RLS eingegangen werden, aufgrund der daraus entstehenden therapeutischen Ansätze. Insbesondere der Eisenstatus im zentralen Nervensystem ist in der Pathogenese des RLS von Bedeutung.11 Bei RLS-Patient:innen wurden erniedrigte Ferritin- und erhöhte Transferrin-Werte im Liquor nachgewiesen bei gleichzeitig normalen Werten im Serum.12 Magnetresonanztomografie(MRT)-Studien zeigten reduzierte Eisenkonzentrationen in bestimmten Gehirnarealen durch Beeinträchtigung des Eisentransportes in die Substantia nigra und den Plexus choroideus.11 Zudem ist eine reduzierte mitochondriale Funktion durch mitochondrialen Eisenmangel mit RLS vergesellschaftet13 und bei nichtmedikamentös behandelten RLS-Patient:innen sind die Hepcidin-Werte sowie die Hepcidin/Ferritin-Ratio im Vergleich zu gesunden Kontrollen erhöht.14 Insgesamt leiden bis zu 30% der Patient:innen mit Eisenmangel unter RLS.11
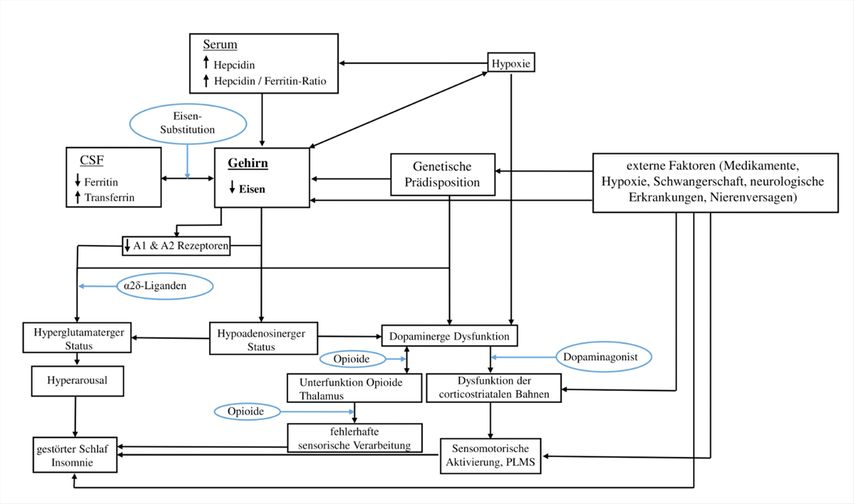
Andererseits lassen sich erhöhtes striatales Dopamin und eine verminderte Anzahl an D2-Rezeptoren bei RLS nachweisen.11,15 Man unterscheidet zwischen einem hyperdopaminergen präsynaptischen Status mit erhöhter Dopaminsynthese, Freisetzung und verminderter Dopaminaufnahme sowie einem hypodopaminergen postsynaptischen Status mit Reduktion der D2/D3-Rezeptoren.15 Bei Initiation einer dopaminergen Therapie ist es wichtig zu beachten, dass es durch die dopaminerge Stimulation zu einer weiteren postsynaptischen Herabregulierung der Dopaminrezeptoren D2/D3 und zu einem relativen Dopamindefizit abends und nachts kommt. So werden nur kurzfristig Effekte durch eine Therapie mit Levodopa erzielt und es kommt zur Augmentation.11 Das Zusammenspiel der verschiedenen Faktoren in der Pathogenese des RLS, die sich gegenseitig beeinflussen, gestaltet sich kompliziert (siehe Abb. 2).
Abb. 2: Ein Überblick über die Pathogenese des Restless-Legs-Syndroms (RLS) und die Wirkmechanismen von Medikamenten (adaptiert von Manconi et al.5 und Gonzalez-Latapi et al.20)
Therapie
Auslösende oder aggravierende Faktoren, zu denen Alkohol- und Koffeinkonsum, antihistaminerge, serotonerge und antidopaminerge Therapie und unbehandelte obstruktive Schlafapnoe zählen, sollen vermieden werden.16
Die Eisentherapie wird sowohl von den Guidelines der International Restless Legs Syndrome Study Group (IRLSSG) als auch von jenen der American Academy of Sleep Medicine (AASM) empfohlen.16,17 Zu einer Eisentherapie per os wird ab einem Ferritinwert von ≤75ng/mL oder einer Transferrinsättigung <20% geraten, bei einem Ferritinlevel <100ng/mL soll die Therapie intravenös erfolgen.17
Ein bei der Therapie von RLS wichtiger zu beachtender Aspekt ist das Verhindern einer Augmentation. In den IRLSSG-Guidelines werden α2δ-Liganden als initiale Therapie empfohlen, da dabei kein Augmentationsrisiko in der Langzeitanwendung besteht, jedoch stehen diese in Europa nur „off-label“ zur Verfügung. Dopaminerge Therapie soll nur bei Beeinträchtigung der Lebensqualität und so kurz wie möglich und in der kleinsten effektiven Dosierung eingesetzt werden. Wenn notwendig kann sie mit einer nichtdopaminergen Therapie kombiniert werden. Lang wirksame Dopamin-Agonisten sind mit einem geringeren Augmentationsrisiko verbunden als kurz wirksame und sollen daher vorgezogen werden.17 In den AASM-Guidelines wird hingegen von einer Therapie mit Levodopa, Pramipexol, transdermalem Rotigotin und Ropinirol ganz abgeraten. Nur falls davon auszugehen ist, dass für die Patient:innen ein größerer Nutzen im Rahmen einer kurzfristigen Anwendung im Vergleich mit Schäden durch die langfristige Anwendung entsteht, sind diese Therapieoptionen geboten.16 Gabapentin enacarbil, Gabapentin, Pregabalin und intravenös Eisencarboxymaltose werden in den AASM-Guidelines empfohlen, intravenös niedermolekulares Eisendextran, intravenös Eisenoxytol, eisenhaltige Sulfate, Dipyridamol, erweitert freigesetztes Oxycodon und andere Opioide sowie bilaterale Hochfrequenzstimulation des N. peroneus werden nur eingeschränkt empfohlen. Von Cabergolin wird generell abgeraten.16 Bei der bilateralen Hochfrequenzstimulation des N. peroneus handelt es sich um eine neuartige nichtpharmakologische Therapieoption, deren Effektivität und Sicherheit u.a. bei therapieresistentem RLS in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie bestätigt wurden.18
Augmentation
Unter Augmentation wird nach den Kriterien des Max-Planck-Instituts19eine paradoxe Reaktion auf die dopaminerge Behandlung bei RLS, im Sinne einer Beschwerdezunahme bei Dosissteigerung und Abnahme bei Reduktion, verstanden. Es kommt zu einem vier Stunden früheren Symptombeginn oder einem zwei bis vier Stunden früheren Symptombeginn zusammen mit einer kürzeren Latenzzeit in Ruhe, Symptomausbreitung auf andere Körperregionen oder gesteigerter Intensität.19
Bei Augmentation sollten zuallererst auslösende Faktoren wie bestimmte Medikamente, Alkohol oder Schlafmangel reduziert werden. Bei einem Serumferritin <50–100μg/mL soll eine Eisentherapie erfolgen. Die weitere Therapie bei Augmentation unterscheidet sich für milde im Vergleich zu schwerer Augmentation. Bei milder Augmentation kann dieselbe dopaminerge Therapie fortgeführt werden, wobei die Dosis entweder aufgeteilt oder früher eingenommen wird. Bei ausbleibender Verbesserung kann die Dosis gesteigert werden, jedoch nicht über die maximal zugelassene. Die maximal empfohlenen Dosierungen sind 0,75mg pro Tag für Pramipexol, 4mg pro Tag für Ropinirol und 3mg pro Tag für Rotigotin. Nächster Schritt ist der Wechsel zu einem α2δ-Liganden, Rotigotin oder einem lang wirksamen Dopamin in submaximaler Dosierung. Bei schwerer Augmentation soll die Therapie mit kurz wirksamen Dopamin-Agonisten gestoppt oder zumindest reduziert werden und stattdessen eine Therapie mit einem lang wirksamen Dopamin-Agonisten, Rotigotin oder einem α2δ-Liganden implementiert werden. Lang wirksame Opioide sind schweren Fällen vorbehalten. Für die Therapieumstellung stehen drei verschiedene Strategien zur Verfügung:
-
die Kreuztitration: Beginn mit α2δ-Ligand und schrittweise Reduktion bis zum Absetzen des Dopamin-Agonisten falls möglich,
-
Wechsel von einem kurz wirksamen Dopamin-Agonisten zu einem lang wirksamen oder Rotigotin,
-
10-Tage-Washout (bei Therapiebedarf Start mit einem α2δ-Liganden oder Opioid).17
Da die Augmentationstherapie äußerst komplex sein kann, ist der wichtigste Schritt, die Entwicklung einer Augmentation zu vermeiden.
Restless Sleep Disorder: eine neue schlafbezogene Bewegungsstörung
Hin- und Herwälzen im Bett während der Nacht, mit zerwühlten Bettlaken aufwachen und sich nach dem Schlaf nicht erholt fühlen: Bis vor Kurzem entsprachen diese Beschwerden keiner klar definierten Diagnose einer bekannten Schlafstörung.1 Erst aktuelle Forschungsergebnisse, die auf klinischen Beobachtungen pädiatrischer Fälle basieren, brachten Aufschluss: Kinder, die sich während des Schlafes übermäßig bewegen und tagsüber unter Symptomen wie Aufmerksamkeitsstörungen oder Tagesmüdigkeit leiden, werden als „hyperkinetische Schläfer“ bezeichnet. Sie wurden erstmals 1981 von Busby et al. beschrieben21 und schließlich benannten 2018 DelRosso et al. die Beschwerden als eigenständige Schlafstörung mit Restless Sleep Disorder (RSD).22
In einer Pilotstudie zur Untersuchung der klinischen Merkmale von RSD zeigte sich, dass diese Störung im Gegensatz zum RLS durch eine normale Einschlaflatenz gekennzeichnet ist, es jedoch zu deutlich mehr nächtlichen Bewegungen als bei RLS und gesunden Kontrollpersonen kommt.22 Basierend auf der Charakterisierung dieser Fälle, die 7,7% der Patient:innen in einem Schlafzentrum ausmachten,23 wurden folgende diagnostische Kriterien für RSD bei Personen im Alter von 6–18 Jahren festgelegt:24
-
Eine subjektive Beschwerde über unruhigen Schlaf muss von dem Patienten oder der Patientin oder dessen/deren Angehörigen berichtet werden.
-
Es müssen Bewegungen großer Muskelgruppen, des gesamten Körpers, der Extremitäten oder des Kopfes vorliegen, die im Video deutlich sichtbar sind. Dazu zählen häufige Lagewechsel im Bett, Herausfallen aus dem Bett, verrutschte Bettlaken oder Aufwachen in einer deutlich anderen Position als die Einschlafposition. Diese Bewegungen müssen von anderen bekannten Schlafstörungen abgrenzbar sein und dürfen nicht rhythmisch oder repetitiv auftreten.
-
Die Bewegungen müssen während des Schlafs auftreten.
-
Die PSG muss einen Index für Bewegungen großer Muskelgruppen („large muscle movements“, LMM) von 5 oder mehr pro Stunde dokumentieren. Der LMM-Index wird berechnet, indem die Gesamtanzahl der bewerteten Bewegungen durch die gesamte Schlafdauer dividiert wird; er kann auch für jede Schlafphase separat erfasst werden.
-
Unruhiger Schlaf sollte mindestens dreimal pro Woche über mindestens drei Monate auftreten.
-
Es müssen tagsüber Symptome auftreten, die mit RSD assoziiert sind, z.B. exzessive Tagesschläfrigkeit („excessive daytime sleepiness“, EDS), Müdigkeit, Stimmungsinstabilität, Konzentrationsstörungen oder Impulsivität, die zu Problemen im Verhalten, schulischen, sozialen oder beruflichen Bereich führen.
-
Die Beschwerden dürfen nicht durch eine Verhaltens- oder medizinische Störung, Medikamente oder Drogen erklärbar sein.
-
Unterstützendes Kriterium 1: LMM können während der gesamten Nacht und in allen Schlafstadien auftreten im Gegensatz zu periodischen Beinbewegungen oder Non-REM(NREM)-Parasomnien, die hauptsächlich in der ersten Nachthälfte vorkommen.
-
Unterstützendes Kriterium 2: Einschlafprobleme oder verlängerte Einschlaflatenzen sind bei RSD nicht zu erwarten.
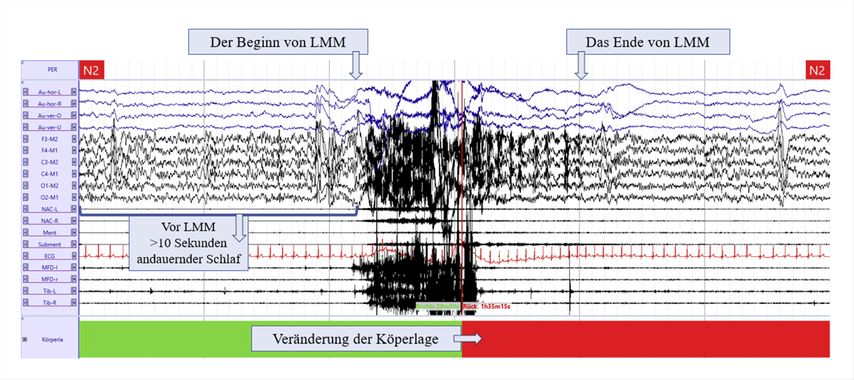
Nach Einführung der diagnostischen Kriterien für RSD legte die IRLSSG Mindestanforderungen und Regeln für die Bewertung von LMM fest.25 In einer PSG-Aufzeichnung, die gemäß dem aktuellen Manual der AASM durchgeführt wird,26 muss zur Bewertung eines LMM ein Anstieg der elektromyografischen (EMG) Aktivität auf mindestens das Doppelte der Basisamplitude in mindestens zwei beliebigen Kanälen oder ein Bewegungsartefakt beobachtet werden. Dieser Anstieg der EMG-Aktivität oder die Bewegungsartefakte müssen ausschließlich während des Schlafzustandes auftreten. Dem Auftreten eines LMM muss eine mindestens zehnsekündige Phase ohne motorische Aktivität im Schlaf vorausgehen. Die Dauer eines LMM beträgt mindestens 3 Sekunden und maximal 30 Sekunden bei Kindern bzw. 45 Sekunden bei Erwachsenen (siehe Abbildung 3 als Beispiel). Zwei LMM, die weniger als eine Sekunde auseinanderliegen, werden als eine Bewegung gewertet. LMM, die durch externe Faktoren, z.B. das Betreten des Zimmers durch eine:n Techniker:in, ausgelöst werden, mit im AASM-Manual definierten Bewegungen oder die mit typischen Verhaltensmerkmalen wie epileptischen Anfällen oder Parasomnien übereinstimmen, müssen ausgeschlossen werden.
Abb. 3: Polysomnografisches Erscheinungsbild von Bewegungen großer Muskelgruppen („large muscle movements“, LMM) in einem 1-minütigen Schlafabschnitt (Zentrum für Schlafmedizin, Univ.-Klinik für Neurologie, Medizinische Universität Innsbruck)
Für die klinisch und elektrophysiologisch definierte RSD ist bislang keine einheitlich erklärbare Pathophysiologie bekannt. Derzeitige Evidenz weist auf drei einander überlappende Mechanismen hin: gehirnspezifischer Eisenmangel, erhöhte Schlafinstabilität und gesteigerte Aktivität des sympathischen Nervensystems.27 Bei RSD-Patient:innen wurden signifikant erniedrigte Ferritinwerte nachgewiesen und eine klinische Verbesserung nach intravenöser oder oraler Eisensubstitution unterstützt die eisenassoziierte Pathophysiologie.26 Zusätzlich zeigen Analysen der Herzrhythmusvariabilität (HRV) eine Verschiebung hin zu einer erhöhten sympathischen Aktivität sowie das Vorkommen eines kurzen, auf Weckbarkeit basierenden, rasch zyklisch alternierenden Musters („cyclic alternating pattern“, CAP) im NREM-Schlaf als Hinweise auf Schlafinstabilität mit abnormer sympathischer Aktivierung.27
In den letzten Jahren konnte zunehmende Evidenz die Relevanz von unruhigem Schlaf und einer potenziellen RSD-Diagnose auch bei Erwachsenen belegen. Erste Normdaten von Ibrahim et al. ergaben bei 100 gesunden Erwachsenen einen medianen LMM-Index von 6,8 pro Stunde mit einem Interquartilsbereich von 4,5–10,8 pro Stunde.28 Zudem wurde eine positive Korrelation zwischen LMM-Index, Schlafphasenwechsel, Arousal-Index und Apnoe-Index festgestellt, was einen signifikanten Zusammenhang zwischen LMM und Schlaffragmentierung nahelegt.28 Eine andere Studie konzentrierte sich auf Erwachsene mit unruhigem und nicht erholsamem Schlaf ohne bekannte Schlafstörungen, welche als „mögliche RSD“ („probable RSD“, pRSD) kategorisiert wurden.29 In dieser Gruppe lag der LMM-Index bei 10,4 (4,2–14,4) pro Stunde und war signifikant höher als bei RLS, NREM-Parasomnien und gesunden Kontrollpersonen.29 Zudem zeigte sich eine negative Korrelation zwischen LMM-Index und dem Anteil an NREM3-Tiefschlafstadien, parasympathischen Parametern von HRV sowie Ferritin- und Transferrinsättigung im Serum.29 Die Autoren schlugen einen Schwellenwert von ≥7,2 pro Stunde (AUC=0,736) zur Abgrenzung von pRSD gegenüber gesunden Erwachsenen vor.29 Da es bislang keine etablierten Diagnosekriterien für Erwachsene gibt, müssen diese Ergebnisse in größeren multizentrischen Studien validiert werden.
Unruhiger Schlaf wirkt sich nicht nur als eigenständige Störung, sondern auch als Begleitsymptom anderer Schlafstörungen negativ auf den Nachtschlaf aus. So zeigten erwachsene RLS-Patient:innen mit hohem LMM-Index eine ausgeprägte Schlaffragmentierung, eine reduzierte Schlafeffizienz und eine starke sympathische Aktivierung, unabhängig von der Schwere der RLS-Symptome.30,31 Zudem war bei unbehandelter obstruktiver Schlafapnoe unruhiger Schlaf mit hohen LMM-Indizes mit der Schwere der exzessiven Tagesschläfrigkeit korreliert, selbst nach Anpassung an respiratorische Parameter.32 Diese Daten unterstreichen die Bedeutung nächtlicher Unruhe bei Erwachsenen und betonen die Notwendigkeit zukünftiger Studien zur umfassenden Charakterisierung der LMM sowohl als eigenständiges Phänomen als auch in Zusammenhang mit anderen Schlafstörungsprozessen im Hinblick auf Biomarker, therapeutische Strategien und Langzeitfolgen.33
Literatur:
1 American Academy of Sleep Medicine: International classification of sleep disorders. 3rd edition, text revision. Darien, Illinois; 2023 2 Broström A et al.: Worldwide estimation of restless legs syndrome: a systematic review and meta-analysis of prevalence in the general adult population. J Sleep Res 2023; 32(3): e13783 3 Allen RP et al.: Prevalence and disease burden of primary restless legs syndrome: results of a general population survey in the United States. Mov Dis 2011; 26(1): 114-20 4 Allen RP et al.: Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (IRLSSG) consensus criteria – history, rationale, description, and significance. Sleep Med 2014; 15(8): 860-73 5 Manconi M et al.: Restless legs syndrome. Nat Rev Dis Primers 2021; 7(1): 80 6 Kerr S et al.: Descriptors of restless legs syndrome sensations. Sleep Med 2012; 13(4): 409-13 7 Karroum EG et al.: Sensations in restless legs syndrome. Sleep Med 2012; 13(4): 402-8 8 Trenkwalder C et al.: Restless legs syndrome associated with major diseases: a systematic review and new concept. Neurology 2016; 86(14): 1336-43 9 Schormair B et al.: Identification of novel risk loci for restless legs syndrome in genome-wide association studies in individuals of European ancestry: a meta-analysis. Lancet Neurol 2017; 16(11): 898-907 10 Schormair B et al.: Genome-wide meta-analyses of restless legs syndrome yield insights into genetic architecture, disease biology and risk prediction. Nat Genet 2024; 56(6): 1090-9 11 Allen RP: Restless leg syndrome/Willis-Ekbom disease pathophysiology. Sleep Med Clin 2015; 10(3): 207-14 12 Earley CJ et al.: Abnormalities in CSF concentrations of ferritin and transferrin in restless legs syndrome. Neurology 2000; 54(8): 1698-700 13 Haschka D et al.: Association of mitochondrial iron deficiency and dysfunction with idiopathic restless legs syndrome. Mov Dis 2019; 34(1): 114-23 14 Dauvilliers Y et al.: Association between serum hepcidin level and restless legs syndrome. Mov Dis 2018; 33(4): 618-27 15 Earley CJ et al.: Connectome and molecular pharmacological differences in the dopaminergic system in restless legs syndrome (RLS): plastic changes and neuroadaptations that may contribute to augmentation. Sleep Med 2017; 31: 71-7 16 Winkelman JW et al.: Treatment of restless legs syndrome and periodic limb movement disorder: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med 2025; 21(1): 137-52 17 Garcia-Borreguero D et al.: Guidelines for the first-line treatment of restless legs syndrome/Willis-Ekbom disease, prevention and treatment of dopaminergic augmentation: a combined task force of the IRLSSG, EURLSSG, and the RLS-foundation. Sleep Med 2016; 21: 1-11 18 Bogan RK et al.: Efficacy and safety of tonic motor activation (TOMAC) for medication-refractory restless legs syndrome: a randomized clinical trial. Sleep 2023; 46(10): zsad190 19 Garcia-Borreguero et al.: Diagnostic standards for dopaminergic augmentation of restless legs syndrome: report from a World Association of Sleep Medicine-International Restless Legs Syndrome Study Group consensus conference at the Max Planck Institute. Sleep Med 2007, 8(5):520-30 20 Gonzalez-Latapi P, Malkani R: Update on restless legs syndrome: from mechanisms to treatment. Curr Neurol Neurosci Rep 2019; 19(8): 54 21 Busby K et al.: Sleep patterns in hyperkinetic and normal children. Sleep 1981; 4(4): 366-83 22 DelRosso LM et al.: Restless sleep disorder in children: a pilot study on a tentative new diagnostic category. Sleep 2018; 41(8) 23 DelRosso LM, Ferri R: The prevalence of restless sleep disorder among a clinical sample of children and adolescents referred to a sleep centre. J Sleep Res 2019; 28(6): e12870 24 DelRosso LM et al.; International Restless Legs Syndrome Study Group (IRLSSG): Consensus diagnostic criteria for a newly defined pediatric sleep disorder: restless sleep disorder (RSD). Sleep Med 2020; 75: 335-40 25 Ferri R et al.: Scoring of large muscle group movements during sleep: an International Restless Legs Syndrome Study Group position statement. Sleep 2021; 44(9): zsab092 26 American Academy of Sleep Medicine: The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. Version 3.0. Darien, Illinois; 2023 27 DelRosso LM et al.: Restless sleep disorder. Sleep Med Clin 2021; 16(2): 381-7 28 Ibrahim A et al.: Large muscle group movements during sleep in healthy people: normative values and correlation to sleep features. Sleep 2023; 46(8): zsad129 29 Aktan Suzgun M et al.: Analysis of large-muscle movements in the diagnosis of possible restless sleep disorder in adult population. Sleep 2024; 47(7): zsae102 30 Mogavero MP et al.: Large muscle group movements during sleep in restless leg syndrome: neurophysiological and clinical implications. Sleep 2024; 47(7): zsae113 31 Mogavero MP et al.: Autonomic correlates of large muscle group movements during NREM sleep in restless legs syndrome: a comparative analysis with periodic and non-periodic leg movements. Sleep 2025: zsaf194 32 Aktan Suzgun M et al.: The role of large muscle movements on excessive daytime sleepiness in patients with obstructive sleep apnea. Sleep Breath 2024; 28(6): 2547-56 33 Benbir Senel G, DelRosso LM: Restless sleep disorder in children: an educational review on diagnosis, pathophysiology, and management. Mov Disord Clin Pract 2025; doi: 10.1002/mdc3.70155. Online ahead of print
Das könnte Sie auch interessieren:
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...
Nahrungsergänzungsmittel bei ME/CFS: neue Hoffnung oder falsche Versprechen?
Chronische Erschöpfung, die nicht vergeht, Schmerzen, Konzentrationsprobleme, ein Leben in Zeitlupe. Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom (ME/CFS) betrifft weltweit ...
Highlights zu neurodegenerativen Erkrankungen vom EAN-Kongress
Prof. Dr. Elena Moro, Präsidentin der European Academy of Neurology (EAN), eröffnete den elften Kongress der Vereinigung in Helsinki. Führende Expert:innen verschiedener Fachrichtungen ...