Deeskalation und Personalisierung der Therapie beim Endometriumkarzinom
Autorin:
PD Dr. med. Franziska Siegenthaler
Leitende Ärztin stationäre Gynäkologie und gynäkologische Onkologie
Universitätsklinik für Frauenheilkunde
Inselspital Bern
E-Mail: franziska.siegenthaler@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Endometriumkarzinom ist der häufigste gynäkologische Tumor und weist eine steigende Inzidenz auf.1 Obwohl die Prognose mit einer 5-Jahres-Überlebensrate von über 80% insgesamt günstig erscheint, wurde in den letzten Jahren ein Anstieg der Mortalität beim Endometriumkarzinom beobachtet.2,3 In diesem Kontext ist eine zusätzliche Verbesserung und Personalisierung der Therapie des Endometriumkarzinoms von grosser Relevanz.
Keypoints
-
Die molekulare Klassifikation hat die Grundlage der Risikostratifizierung beim Endometriumkarzinom grundlegend verändert.
-
Die Etablierung der Sentinellymphknotenbiopsie hat in den letzten Jahren zu einer Deeskalation der chirurgischen Therapie beim Endometriumkarzinom geführt.
Molekulare Klassifizierung als Grundlage für die personalisierte Medizin
Die traditionelle Einteilung des Endometriumkarzinoms in Typ-I- und Typ-II-Karzinome ist in den letzten Jahren zunehmend in den Hintergrund getreten, da diese dualistische Einteilung der biologischen Vielfalt dieser Erkrankung nicht gerecht wird. Neben etablierten Risikofaktoren wie histologischem Subtyp, Grading oder lymphovaskulärer Invasion hat vor allem die molekulare Klassifikation das Verständnis des Endometriumkarzinoms grundlegend verändert. 2013 definierte das Cancer-Genome-Atlas(TCGA)-Projekt vier molekulare Subtypen des Endometriumkarzinoms, die später zur klinisch anwendbaren Klassifikation Proactive Molecular Risk Classifier for Endometrial Cancer (ProMisE) weiterentwickelt wurden: POLEmut (Polymerase-ε-ultramutiert), MMRd (Mismatch-Repair-defizient), p53abn (p53-aberrant) und NSMP («non-specific molecular profile»).4,5 Sie sind heute fester Bestandteil der 5. Auflage der WHO-Klassifikation weiblicher Genitaltumoren, der europäischen Leitlinien sowie des revidierten FIGO-Staging-Systems von 2023.6–8 Die molekulare Klassifikation ist prognostisch unabhängig von diversen histopathologischen Parametern9–11 und stellt eine reproduzierbare Grundlage für personalisierte Therapieentscheidungen und eine präzise Risikostratifizierung dar.
Adjuvante Therapie: Personalisierung auf molekularer Basis
Die molekularen Subgruppen beeinflussen somit zunehmend die Empfehlungen zur adjuvanten Therapie: Patientinnen mit High-Risk-MMRd-Tumoren erhalten zusätzlich zur Chemotherapie nun eine Immuncheckpoint-Inhibition mit Pembrolizumab,12 während bei p53abn-Tumoren bereits ab Nachweis einer Myometriuminfiltration die Empfehlung zur kombinierten Radiochemotherapie gilt.2,13 Zudem wird eine Erhaltungstherapie mit PARP-Inhibitoren diskutiert, da bis zu 46% dieser Tumoren HR-defizient sind.14,15 Bei Hormonrezeptor-positiven NSMP-Tumoren wird eine Deeskalation zugunsten hormoneller Therapie erwogen, bei POLEmut-Tumoren kann meist vollständig auf eine adjuvante Therapie verzichtet werden.16,17 Die prospektive RAINBO-Studie untersucht derzeit die klinische Umsetzung dieser personalisierten Strategien.16 Dies könnte die Therapielandschaft des Endometriumkarzinoms nachhaltig verändern – hin zu einer präzisen, prognosebasierten Behandlung.
Nachsorge und Rezidivmuster im Kontext molekularer Subtypen
Etwa 18% der Patientinnen erleiden ein Rezidiv, meist innerhalb der ersten zwei Jahre, und auch im Rezidiv bleibt die molekulare Subgruppe prognostisch relevant.9,18 Bei 9% aller Patientinnen tritt das Rezidiv mehr als 5 Jahre nach Diagnose auf, dies betrifft hauptsächlich POLEmut- und NSMP-Tumoren, nicht jedoch p53abn-Karzinome.9 Auch variiert das Rezidivmuster je nach molekularem Subtyp: MMRd-Tumoren rezidivieren eher lokoregionär, p53abn abdominal und NSMP zeigen häufiger Fernmetastasen.9,18 Diese Unterschiede sollten bei der Planung individueller Nachsorgekonzepte berücksichtigt werden.
Chirurgisches Staging
Minimalinvasive Chirurgie: Trend zur Deeskalation
Die chirurgische Therapie wurde in den letzten Jahren zunehmend deeskaliert und minimalinvasive Eingriffe gelten heute als Standard.19 Zwei grosse, randomisierte Studien belegen die onkologische Sicherheit dieser Methode.20,21 Der Einsatz intrauteriner Manipulatoren ist jedoch weiterhin umstritten. Eine retrospektive Studie aus Spanien zeigte, dass Patientinnen, die mit uterinen Manipulatoren operiert wurden, ein kürzeres Überleben hatten.22 Ähnliche Ergebnisse wurden in einer multizentrischen schweizerischen Studie bestätigt: 8% der Patientinnen mit Endometriumkarzinom, die minimalinvasiv operiert wurden, zeigten während der Operation eine Konversion der Peritonealzytologie von negativ zu positiv, was mit schlechteren onkologischen Ergebnissen assoziiert war.23
Ovarerhalt: eine differenzierte Abwägung
Obwohl das Endometriumkarzinom typischerweise postmenopausal auftritt, sind rund 15% der Patientinnen bei Erstdiagnose jünger als 50 Jahre mit einem Anstieg an Neuerkrankungen in der Altersgruppe zwischen 30 und 40 Jahren. Damit rückt die Frage nach Ovarerhalt bei prämenopausalen Patientinnen zunehmend in den Fokus. Jedoch haben bis zu 15% der Patientinnen mit Endometriumkarzinom synchrone Ovarialkarzinome oder ovarielle Metastasen, welche in etwa 40% der Fälle makroskopisch nicht erkennbar sind.24 Es bleibt daher eine Herausforderung, jene Patientinnen zu identifizieren, die von einem Ovarerhalt profitieren. Gemäss Leitlinien kann ein Ovarerhalt prämenopausalen Patientinnen ohne genetisches Risiko mit einem «low-Grade» (G1 oder G2) endometrioiden Endometriumkarzinom Stadium IA angeboten werden.2,13 Aktuelle Daten zeigen jedoch ein erhöhtes Risiko für Ovarbefall bei MMRd- und p53abn-Tumoren mit bis zu 50% – hier ist Vorsicht geboten.25
Fertilitätserhalt: strenge Selektion erforderlich
Die Nachfrage nach fertilitätserhaltenden Therapien beim Endometriumkarzinom hat in den letzten Jahren zugenommen – nicht zuletzt aufgrund des steigenden Alters der Frauen bei der ersten Geburt. Auch in diesem Kontext gelten klare Selektionskriterien: Es muss sich um ein endometrioides G1-Karzinom handeln ohne Myometriuminfiltration und ohne Nachweis einer p53-Mutation. Empfohlen wird in diesen Fällen eine Gestagentherapie – entweder mittels Levonorgestrel-haltiger intrauteriner Spirale (52mg), Medroxyprogesteronacetat oder Megestrolacetat.2,13 NSMP-Tumoren sprechen am besten auf die endokrine Therapie an, während MMRd- und p53abn-Tumoren eine geringere Ansprechrate und ein höheres Rezidivrisiko aufweisen.26
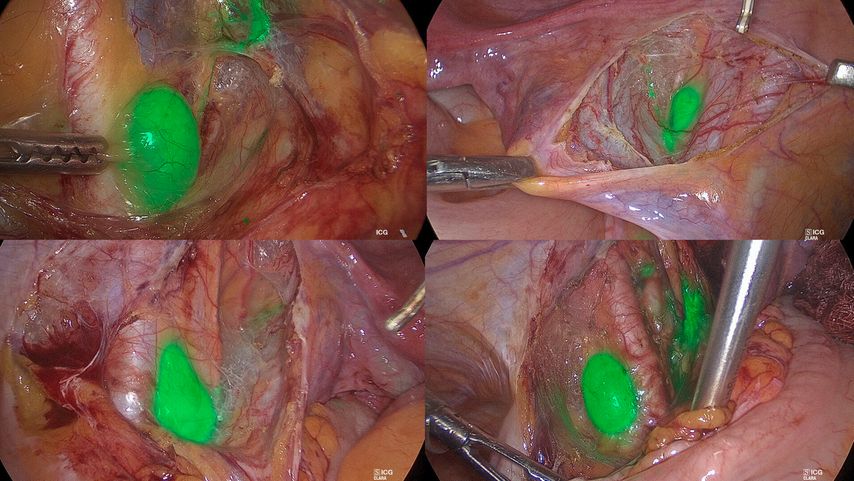
Lymphknotenstaging: Sentinellymphknoten(SLN)-Biopsie als Standardverfahren
Obwohl der Lymphknotenstatus zu den wichtigsten prognostischen Faktoren beim Endometriumkarzinom zählt, konnte bisher kein therapeutischer Vorteil einer systematischen Lymphadenektomie nachgewiesen werden.27,28 Die SLN-Biopsie hat sich als zuverlässige und schonende Alternative zur systematischen Lymphadenektomie etabliert, mit hoher Sensitivität und geringer Morbidität.29,30 Die minimalinvasive SLN-Biopsie mittels Indocyaningrün (Abb. 1) in Kombination mit dem histopathologischen Ultrastaging ermöglicht eine gezielte Lymphknotenbeurteilung für eine präzise Risikostratifizierung zur adjuvanten Therapieentscheidung.31,32 Inzwischen ist sie als Standardverfahren in die europäischen Leitlinien zur Behandlung des Endometriumkarzinoms aufgenommen worden.8 Aktuelle Studien zeigen, dass sowohl die Häufigkeit als auch der prognostische Stellenwert einer SLN-Beteiligung vom molekularen Subtyp des Endometriumkarzinoms abhängen. Die höchste Rate an SLN-Metastasen findet sich bei MMRd- und p53abn-Tumoren – mit Nachweisen bei bis zu 24%.33,34 Zudem stellen SLN-Makrometastasen bei MMRd-Tumoren einen unabhängigen prognostischen Risikofaktor dar. Im Gegensatz dazu scheint ihre Präsenz bei p53abn-Karzinomen keinen signifikanten Einfluss auf das onkologische Outcome zu haben.34
Abb. 1: Sentinellymphknotenbiopsie mit Indocyaningrün
Peritoneales Staging: Renaissance eines unterschätzten Prognosefaktors
Eine positive peritoneale Zytologie deutet auf eine mikroskopische Tumorausbreitung ausserhalb des Uterus hin und ist ein bekannter prognostischer Faktor bei verschiedenen abdominalen Krebserkrankungen.35 Beim Endometriumkarzinom ist die Relevanz der Zytologie jedoch umstritten, weshalb die Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) die peritoneale Zytologie aus dem Staging-System entfernt hat.7,36 Trotzdem zeigen mehrere Studien, dass eine positive peritoneale Zytologie beim Endometriumkarzinom mit einer niedrigeren Überlebensrate verbunden ist.10,23,37 Besonders häufig tritt sie bei p53abn-Tumoren auf. In dieser molekularen Subgruppe ist eine positive Spülzytologie auch ein unabhängiger Risikofaktor sowohl für ein Rezidiv als auch für die Mortalität.10
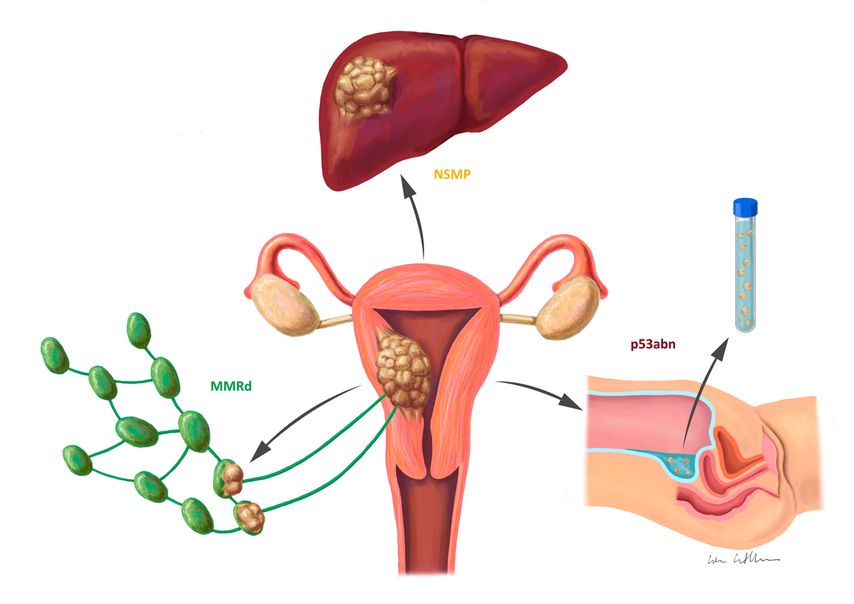
Ausblick: Einfluss der molekularen Subgruppen auf das chirurgische Staging
Die molekularen Subgruppen des Endometriumkarzinoms unterscheiden sich jeweils durch ihre spezifische intrinsische Tumorbiologie, was sich auch in ihren bevorzugten Disseminationswegen widerspiegelt (Abb. 2). So zeigen MMRd-Tumoren eine Tendenz zur lymphogenen Ausbreitung, während p53abn-Tumoren häufiger eine peritoneale Dissemination aufweisen.9,10,34 NSMP-Tumoren hingegen bleiben meist lokal begrenzt, können jedoch zu spät auftretenden Fernrezidiven führen.9 Vor diesem Hintergrund stellt sich die Frage, ob das chirurgische Staging künftig nicht auch an die molekulare Subgruppe angepasst werden sollte. Wird die SLN-Biopsie insbesondere bei MMRd-Tumoren zum Standard? Und sollte die peritoneale Zytologie insbesondere bei p53abn-Karzinomen wieder verstärkt Anwendung finden? Und sollten Entscheidungen zum Ovar- oder Fertilitätserhalt nicht konsequenterweise unter Einbezug des molekularen Profils getroffen werden? Eine präzise, molekularbiologisch fundierte Risikostratifizierung könnte somit auch die Grundlage für eine individualisierte chirurgische Behandlung schaffen.
Das könnte Sie auch interessieren:
Parvovirus B19 in der Schwangerschaft
Parvovirus B19 ist ein oft unterschätzter Erreger mit potenziell gravierenden Folgen für Mutter und Kind. Während viele Infektionen symptomlos verlaufen, kann das Virus in der ...
Management der Hypertonie in der Schwangerschaft
Hypertensive Erkrankungen treten bei 6–8% aller Schwangerschaften auf und sind eine der wesentlichen Ursachen für mütterliche und perinatale Morbidität und Mortalität. Dabei lassen sich ...
Amenorrhö in der Adoleszenz
Ein Meilenstein in der weiblichen Entwicklung ist das Eintreten der ersten Periodenblutung, der Menarche. Bleibt diese in der Adoleszenz aus, sollten weitere Abklärungen zur ...