Thrombopenie und Thrombose als Folge von Covid-19-Impfung
Bericht: Dr. Norbert Hasenöhrl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der tragische Tod mehrerer Patienten nach Covid-19-Impfung führte zur Entdeckung und Charakterisierung eines seltenen, aber gefährlichen Krankheitsbildes: der „vaccine-induced immune thrombotic thrombocytopenia“, kurz VITT, wie Univ.-Prof. Dr. Sabine Eichinger-Hasenauer, Wien, berichtete.
Keypoints
-
Die „vaccine-induced immune thrombotic thrombocytopenia“,VITT, ist ein neues Krankheitsbild, das klinisch der Heparin-induzierten Thrombopenie ähnelt und zu Verbrauchskoagulopathie sowie venösen (teils an ungewöhnlichen Stellen lokalisierten) und arteriellen Thrombosen führt.
-
Symptome treten frühestens 5 Tage nach Covid-19-Impfung und ohne vorhergegangene Heparinexposition auf.
-
Ein spezifischer diagnostisch-therapeutischer Algorithmus liegt vor.
-
Leitbefunde sind hohesD-Dimer und niedrige Thrombozytenzahl.
-
Die Initialtherapie besteht in hoch dosierten i.v. verabreichten Immunglobulinen und intensiver Antikoagulation mit einem zu Heparin alternativen Antikoagulans.
Ich möchte im Folgenden zunächst den Fall jener 49-jährigen Frau referieren, die nach einer Impfung mitdem Covid-Impfstoff von AstraZeneca im AKH Wien gestorben ist“, begann Univ.-Prof. Dr. Sabine Eichinger-Hasenauer, Universitätsklinik für Innere Medizin I, MedUni Wien, ihren Vortrag.
Fallbericht
Die Patientin hatte als Pflegeassistentindie Impfung im Februar 2021 erhalten und klagte danach über Kopf- und Gliederschmerzen sowie Müdigkeit, keineswegs ungewöhnliche Nebenwirkungen bei diesem Impfstoff. Nach zwei bis drei Tagen kam es zur Besserung. Am Tag 5 berichtete sie jedoch über zunehmende Übelkeit, Appetitlosigkeit, Völlegefühl, Unwohlsein im Oberbauch und Erbrechen. Die weiter zunehmende Symptomatik führte am Tag 10 zur stationären Aufnahme. Die Patientin war zu diesem Zeitpunkt SARS-CoV-2-negativ in der PCR. Im Labor auffallend waren vor allem sehr niedrige Thrombozytenzahlen und ein massiv erhöhtes D-Dimer. Aufgrund der Symptomatik wurde eine CT durchgeführt, die den Befund einer Pfortaderthrombose und einer peripheren Pulmonalembolie ergab. Daraufhin wurde die Patientin ins Wiener AKH transferiert.
Dort zeigten sich weiter sehr niedrige Thrombozyten- und sehr hohe, nochmals angestiegene D-Dimer-Werte. Zu diesem Zeitpunkt waren auch die Transaminasen und die LDH sowie das CRP mäßig erhöht.
Der Allgemeinzustand war zunächst unverändert, RR, Herzfrequenz und Temperatur waren normal. Am Abend des Tags 10 (Aufnahme im AKH) erhielt die Patientin 4000IE Enoxaparin s.c., eine prophylaktische Dosis.
Am nächsten Tag wurden die Bauchschmerzen massiv stärker und eine neuerliche CT des Abdomens zeigte folgenden dramatischen Befund: vollständiger Verschluss der V. portae bis in die Peripherie, Verschluss der V. lienalis und der V. mesenterica superior einschließlich eines Großteils der zuführenden Äste; diffuses Wandödem des Colon ascendens, des Colon transversum und multipler Dünndarmschlingen, ausgeprägte Minderperfusion der Milz nach Milzinfarkt sowie wandständige Thromben in der infrarenalen Aorta und A. iliaca communis.
Die Patientin hatte zu diesem Zeitpunkt bereits massive Bauchschmerzen, die nur noch mittels Opioiden zu beherrschen waren.
Ein multidisziplinäres Konsil ergab keinenHinweis auf eine zielführende Therapieoption, eine Lyse wurden wegen des hohen Blutungsrisikos verworfen. Die Patientin wurde mit unfraktioniertem Heparin, 500IE/h i.v., behandelt. Nach 1,5 Stunden kam es zu einer Tachykardie und erhöhten Laktatwerten, worauf ein Transfer auf die ICU erfolgte. Dort erlitt die Patientin vier Stunden später massive Hämatemesis und starb schließlich im hämorrhagischen Schock.
Mögliche Differenzialdiagnosen
„Die Patientin zeigte klare Zeichen einer disseminierten intravaskulären Koagulopathie, kurz DIC“, führte Eichinger-Hasenauer aus. Diese Störung kommt häufig bei Malignomen vor. Es gab jedoch weder in den CT noch in der Autopsie Hinweise auf ein malignes Geschehen. Eine Sepsis als DIC-Ursache war aufgrund des stabilen CRP und des normalen Procalcitonins auszuschließen, ebenso wie andere mögliche DIC-Ursachen, wie Trauma, Verbrennung, schwere Hepatopathie oder Fruchtwasserembolie.
Ein sogenanntes katastrophales Antiphospholipidsyndrom war aufgrund einer normalen aPTT sowie negativer Antikörper gegen Cardiolipin und β2-Glykoprotein ebenfalls auszuschließen.
Eine weitere mögliche Ursache für Thrombose plus Thrombozytopenie ist die thrombotisch-thrombozytopenische Purpura (TTP). Für diese Diagnose wäre jedoch eine Hämolyse erforderlich, die bei der Patientin nicht vorlag: Retikulozyten, Haptoglobin und Bilirubin waren normal, die LDH war nur mäßig erhöht, es lagen keine Fragmentozyten vor. „Außerdem haben TTP-Patienten üblicherweise Mikro- und keine Makrothrombosen“, so die Gerinnungsspezialistin.
Heparin-induzierte Thrombopenie
Die Heparin-induzierte Thrombopenie, kurz als HIT bezeichnet, war ebenfalls eine mögliche Ursache für die Erkrankung der Patientin, da sie sowohl zu Thrombopenie als auch zu Makrothrombosen führt. „Wenn man einem Patienten Heparin gibt, kann es auf zwei Wegen zur Thrombopenie kommen“, so Eichinger-Hasenauer. „Aufgrund unspezifischer, nichtimmunologischer Mechanismen kann eine milde Thrombopenie entstehen. Die zweite Möglichkeit ist eine immunmediierte Thrombopenie.“
Die immunmediierte Thrombopenie ist das, was als HIT bezeichnet wird. Dieses Krankheitsbild war zunächst nur als Folge der Gabe von unfraktioniertem Heparin bekannt. 1991 wurde es dann auch als Folge der Gabe von niedermolekularem Heparin erstmals beschrieben.1
„Allerdings ist natürlich die Voraussetzung für eine HIT, dass der Patient Heparin bekommen hat. Die Erkrankung tritt unter unfraktioniertem Heparin bei 2,6%, unter niedermolekularem Heparin bei 0,2% der Patienten auf“, fuhr die Expertin fort. Außerdem liegt in der Regel eine Latenzzeit von mindestens fünf Tagen zwischen Heparingabe und Auftreten der HIT, da es sich um einen Antikörper-mediierten Prozess handelt.
Bei HIT kommt es bei 30 bis 70% der Betroffenen zu venösen Thrombosen (auch in ungewöhnlichen Lokalisationen), bei 15 bis 30% zu arteriellen Thrombosen, bei 10% zu Hautläsionen an Heparininjektionsstellen und bei 10% zu akuten systemischen Reaktionen nach i.v. Heparingabe.
Die molekulare Basis der HIT ist eine Komplexbildung aus Plättchenfaktor 4 (PF4), der von Thrombozyten freigesetzt wird, und Heparin. Diese PF4-Heparin-Komplexe lassen sich mittels ELISA als Screeningtest nachweisen. Sie bilden ein Neoantigen, gegen das manche Menschen IgG-Antikörper bilden. Der nächste Schritt besteht darin, dass die so entstandenen Komplexe aus PF4/Heparin und IgG-Antikörpern an die Fc-Rezeptoren der Thrombozyten binden. Das führt zu einer massiven Aktivierung der Thrombozyten und damit auch zu einer weiteren Freisetzung von PF4. „Die Thrombozyten aktivieren sich gegenseitig, und sie werden dabei auch verbraucht, deshalb die niedrigen Thrombozytenzahlen“, erläuterte die Expertin. Die hochaktiven Thrombozyten aktivieren auch das plasmatische Gerinnungssystem, was dann zur Ausbildung von Thrombosen führt. Die Aktivierung der Thrombozyten lassen sich mit Bestätigungstests wie dem HIPA-Test nachweisen.
Die Entdeckung der VITT
„Allerdings hatte unsere Patientin vor Auftreten ihrer Symptome gar kein Heparin bekommen“, schränkte Eichinger-Hasenauer ein. „Außerdem gehören schwere DIC-Formen nicht zum klassischen Krankheitsbild der HIT.“
Es gibt allerdings Autoimmun-HIT-Syndrome, die auf dem gleichen Mechanismus wie die HIT beruhen, aber durch andere Faktoren ausgelöst werden.2 „Hier gibt es auch schwere Formen, die mit sehr niedrigen Thrombozytenzahlen und DIC verbunden sind“, so Eichinger-Hasenauer.
„All das hat uns auf die Spur dessen gebracht, was wir heute die ,vaccine-induced immune thrombotic thrombocytopenia‘, kurz VITT, nennen“, berichtete die Expertin.3 Im Gegensatz zu den erwähnten Autoimmun-HIT-Syndromen ist allerdings beim VITT der HIPA-Test negativ.
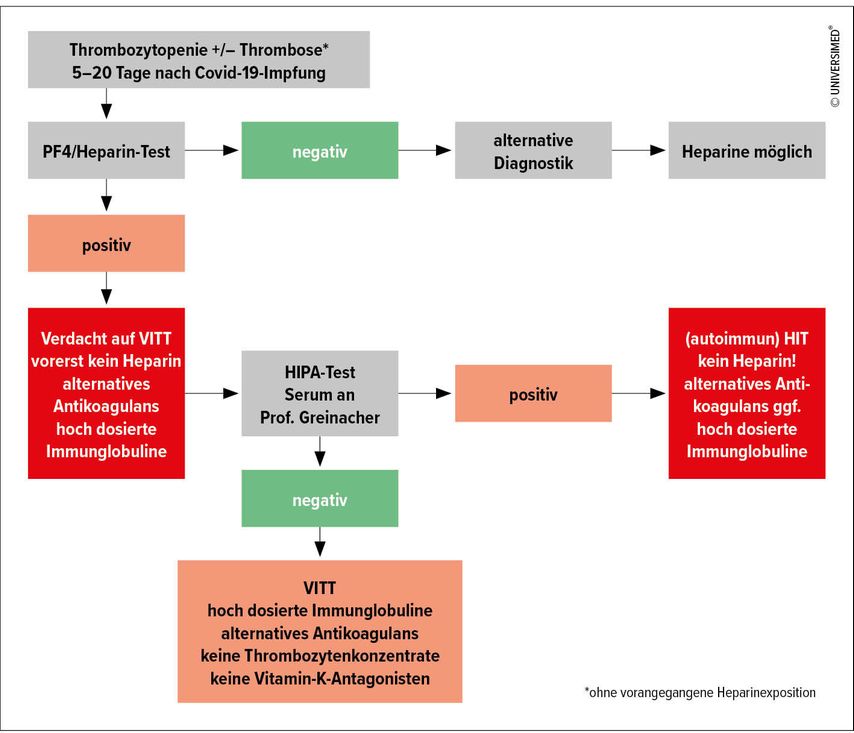
Ein diagnostisch-therapeutischer Algorithmus für VITT liegt bereits vor und ist online abrufbar (Abb. 1).4 „Derzeit haben wir in Österreich noch keine spezifischen Tests für VITT, die Sera sollten daher an die Universität Greifswald, Deutschland, ins Labor von Prof. Greinacher geschickt werden“, erklärte Eichinger-Hasenauer.
Abb. 1: Algorithmus zur Diagnostik und Therapie von VITT (modifiziert nach Eichinger-Hasenauer S et al. 2021)4
Die initiale Therapie des VITT besteht in hochdosiertem intravenös verabreichtem Immunglobulin (IVIG). Es sollte ein alternatives Antikoagulans, kein Heparin, verwendet werden. Thrombozytenkonzentrate und Vitamin-K-Antagonisten sind zu vermeiden. Als alternative Antikoagulanzien kommen infrage: Argatroban, Danaparoid oder ein NOAK, das kein Heparin-Lead-in benötigt, d.h. Rivaroxaban oder Apixaban.
Quelle:
„Thrombopenie und Thrombose – seltene, aber schwere Impffolgen“; Vortrag von Univ.-Prof. Dr. Sabine Eichinger-Hasenauer, Universitätsklinik für Innere Medizin I, MedUni Wien, im Rahmen des Giftigen Live-Streams „Impfungen – Reaktogenität und Nebenwirkungen“, 12. April 2021
Literatur:
1 Eichinger S et al.: Thrombocytopenia associated with low-molecular-weight heparin. Lancet 1991; 337(8754): 1425-6 2 Greinacher A et al.: Autoimmune heparin-induced thrombocytopenia. J Thromb Haemost 2017; 15(11): 2099-114 3 Greinacher A et al.: Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. N Engl J Med 2021; doi: 10.1056/NEJMoa2104840 4 Eichinger-Hasenauer S et al.: Auftreten von Thrombosen im Zusammenhang mit einer Covid-19-Impfung – vaccine-induced immune thrombotic thrombocytopenia (VITT) – Empfehlungen zur Diagnostik und Therapie (Stand: 12.4.2021), auf Anregung des österreichischen nationalen Impfgremiums. https://www.oegho.at/fileadmin/Benutzer/GTH_Stellungnahme_AstraZeneca_engl._3_29_2021.pdf ; zuletzt aufgerufen am 17.5.2021
Das könnte Sie auch interessieren:
Diskriminierung von Menschen mit HIV in Deutschland und Österreich
Leider müssen Menschen, die mit HIV leben, auch im Jahr 2025 noch mit Schlechterbehandlung und Ablehnung leben – überwiegend in Hinblick auf Leistungen im Gesundheitsbereich. Die ...
Bakteriämie mit Staphylococcus aureus
Jede Bakteriämie mit Staphylococcus aureus ist eine ernsthafte Erkrankung mit hoher Mortalität und erfordert eine genaue Abklärung. Die Therapie orientiert sich primär an der Resistenz ...
Hepatitis-C-Versorgungskaskaden von HIV-infizierten Personen in Österreich
Direkt wirkende antivirale Medikamente (DAA) haben die Behandlung des Hepatitis-C-Virus (HCV) revolutioniert und eine Eliminierung des HCV bei HIV-koinfizierten Menschen in Westeuropa ...