CMV-Reaktivierung: Was kann man tun?
Bericht:
Dr. Norbert Hasenöhrl
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
CMV bleibt, wie alle Herpesviren, nach Erstinfektion lebenslang im Organismus und wird normalerweise vom Immunsystem in Schach gehalten. Schwierig wird es dann, wenn aus welchen Gründen auch immer eine Immunsuppression erfolgt, sei es medizinisch (vor allem nach Transplantationen) oder durch eine Grundkrankheit (z.B. HIV). Ein Konsensus der OEGIT befasst sich eingehend mit diesem Thema.
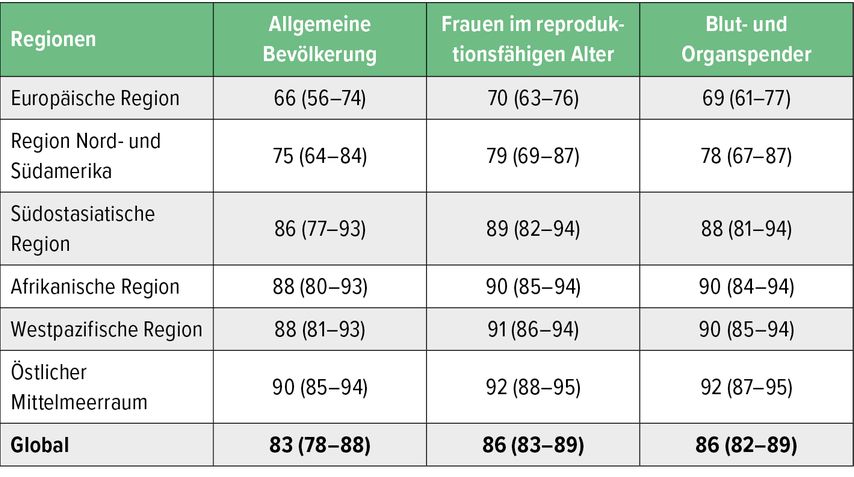
Die weltweite Prävalenz von CMV (Zytomegalievirus) wird mit 40 bis 90% angegeben und schwankt je nach Region (bzw. sozioökonomischem Status) und Studie. Einer relativ rezenten Arbeit zufolge liegt die weltweite CMV-Prävalenz in der Gesamtbevölkerung bei 83% (Tab. 1). Der Hauptübertragungsweg ist die Schmierinfektion. Die Inkubationszeit bei Erstinfektion liegt bei drei bis zwölf Wochen. In 90% der Fälle verläuft die Infektion bei immunkompetenten Personen asymptomatisch, bei weniger als 10% treten grippeähnliche Symptome auf. Durch CMV-Infektion gefährdet sind vor allem Patienten mit irgendeiner Form der Immundefizienz bzw. -suppression, wie z.B. Patienten nach hämatologischer Stammzell- oder solider Organtransplantation (HSCT, SOT).
Tab. 1: Geschätzte mittlere CMV-Seroprävalenz (% mit 95% CI) in unterschiedlichen WHO-Regionen und global per Population (modifiziert nach Zuhair M et al. 2019)
Virus und Erstinfektion
CMV besteht aus einem linearen, doppelsträngigen DNA-Genom, einem Nukleokapsid und einem proteinhaltigen Mantel (Tegument), der wiederum von einer doppelschichtigen Lipidhülle umschlossen wird. Es gibt vier Genotypen (gB1–gB4).
Nach Primärinfektion mit CMV wird das angeborene Immunsystem aktiv. Dies führt zur Freisetzung von proinflammatorischen Zytokinen und kostimulatorischen Molekülen aus Monozyten, Makrophagen und dendritischen Zellen. Sobald sich das Virus in myeloische Zellen wie Monozyten oder CD34-Zellen ausbreitet, entsteht – wie bei allen Herpesviren – eine latente Infektion. Dies führt zur Bildung von CMV-spezifischen CD4- und CD8-Zellen durch das adaptive Immunsystem. Dabei findet sich das Virusreservoir vor allem in CD34-Zellen, Monozyten und Endothelzellen. Aus der Latenzphase ist, vor allem durch Immunsuppression, jederzeit eine CMV-Reaktivierung möglich.
Pharmakologie
In den letzten 20 Jahren sind in der EU nur zwei neue antivirale Medikamente gegen CMV zugelassen worden: Letermovir und Maribavir. Die orale Bioverfügbarkeit liegt für Letermovir bei 35%, für Maribavir bei 25 bis 45% und für Valganciclovir (VGC) bei 60%. Allerdings bestehen hier größere interindividuelle Schwankungen. Die Halbwertszeiten liegen zwischen 2,2 Stunden für Cidofovir und 12 Stunden für Letermovir. Ganciclovir (GC)/VGC, Cidofovir und Foscarnet werden renal, Maribavir renal und über die Faeces und Letermovir vor allem über die Faeces ausgeschieden. Die Proteinbindung ist bei den alten Substanzen sehr niedrig (relativ am höchsten bei Foscarnet mit 20%), bei Letermovir und Maribavir hingegen mit 98% bzw. 99% sehr hoch.
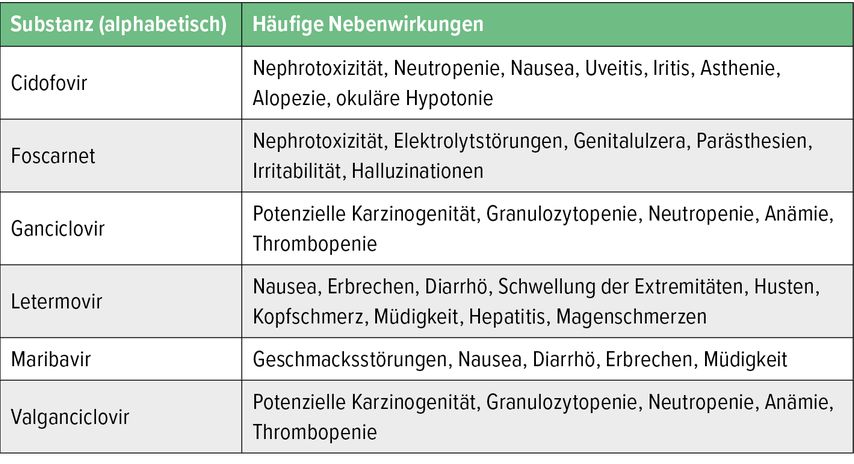
Tabelle 2 zeigt die häufigsten Nebenwirkungen der Anti-CMV-Medikamente.
Die meisten der genannten Medikamente müssen in ihrer Dosis an die Nierenfunktion angepasst werden. Eine Anpassung an eine reduzierte Leberfunktion ist zumeist nicht erforderlich. Bei einer Zirrhose im Stadium Child-Pugh C ist jedoch Vorsicht geboten. Während die alten Substanzen keine relevanten Interaktionen über das Cytochrom-P450(CYP)-System aufweisen, ist dies bei den neuen Substanzen sehr wohl der Fall. Neben CYP-Enzymen interagieren Letermovir und Maribavir auch mit verschiedenen Transportersystemen wie P-gp, OAT etc. Deshalb ist auf Interaktionen mit anderen Medikamenten, die über die gleichen Enzyme metabolisiert werden (wie z.B. Immunsuppressiva) zu achten. Nach Beginn der Gabe von Letermovir und nach dem Absetzen sollten jeweils zwei Wochen lang die Spiegel von Cyclosporin, Tacrolimus bzw. Sirolimus verstärkt monitiert werden.
Diagnostik
Die drei wesentlichen derzeit genützten diagnostischen Verfahren sind die Serologie (Nachweis virusspezifischer Antikörper), die quantitative PCR (qPCR; Nachweis virusspezifischer Nukleinsäure) und die Sequenzierung (Nachweis genetischer Variationen des Virus). Vielversprechend, aber noch nicht fix etabliert sind Immuntests zum Nachweis der virusspezifischen Immunantwort. Früher etablierte Tests wie Virusisolierung oder Bestimmung des pp65-Antigens sind heute im Wesentlichen als obsolet zu betrachten.
Der Nachweis CMV-spezifischer (IgG)Antikörper dient – bei Transplantationspatienten – vor allem der Bestimmung des Infektionsstatus von Donor (D) und Rezipient (R) vor der Transplantation. Daraus ergeben sich im Wesentlichen drei Risikokategorien: Ein hohes Risiko besteht bei D+/R–, ein moderates Risiko bei D+/R+ und ein geringes Risiko bei D–/R–.
Die quantitative Real-Time-PCR ist heute der Goldstandard für das Monitoring nach Transplantation. Mit dieser Methode sind die Detektion, Quantifizierung und damit auch Vergleichbarkeit geringer Viruskonzentrationen im Blut möglich. Die Viruslast korreliert mit dem Risiko für eine symptomatische Erkrankung. So können Cut-off-Werte für die Einleitung einer Therapie definiert werden.
Die Sequenzierung kann dem Nachweis genetischer Variationen dienen. Dies ist z.B. hilfreich bei der Beantwortung der Frage, ob bestimmte CMV-Varianten eher zu einer Erkrankung führen als andere. Wichtiger dürfte allerdings der Nachweis von Resistenzmutationen unter Therapie sein. Dies hat jedoch – da die Mutationsrate von CMV bei fehlendem Therapiedruck recht gering ist – erst dann einen Sinn, wenn bereits eine Therapie eingeleitet wurde.
Patientenpopulationen
Was die für eine CMV-Reaktivierung infrage kommenden Patientenpopulationen angeht, so lassen sich diese in fünf große Gruppen einteilen:
-
Patienten nach solider Organtransplantation
-
Patienten nach HSCT
-
HIV-Patienten (mit niedriger CD4-Zellzahl)
-
Kritisch kranke Patienten
-
Patienten mit medikamentös induzierter Immunsuppression (z.B. chronisch-entzündliche Darmerkrankungen, rheumatische Erkrankungen u.v.a.)
Therapie
Die Erstlinientherapie der CMV-Reaktivierung ist GC in einer Dosis von 2x5mg/kgKG i.v. bzw. das Prodrug VGC, das nach oraler Verabreichung (2x900mg täglich) schnell zu Ganciclovir metabolisiert wird. Foscarnet wird in einer Dosis von 3x60mg/kgKG am Tag 1, danach 1x90–120mg/kgKG alle 24h i.v. verabreicht und weist eine Nephrotoxizität von ca. 30% auf. Foscarnet kann verwendet werden, wenn die Verabreichung von GC/VGC nicht möglich ist. Cidofovir wird in der Erstlinientherapie, nicht zuletzt aufgrund seiner hohen Nephrotoxizität, so gut wie nicht mehr verwendet.
Die zwei wesentlichen unerwünschten Wirkungen von GC/VGC sind die schon erwähnte Nephrotoxizität und weiters auch die Myelotoxizität (insbesondere Leukopenie). Weiters sollten GC/VGC – ebenso wie alle anderen gegen CMV verwendeten Medikamente – bei bestehender oder möglicher Schwangerschaft unbedingt vermieden werden.
Bezüglich Zweitlinientherapie lautete vor der Einführung der neueren Substanzen Maribavir und Letermovir die Therapiesequenz entweder GC/VGC ▷ Foscarnet ▷ Cidofovir oder Foscarnet ▷ GC/VGC ▷ Cidofovir.
Bezüglich der neuen, oral anwendbaren Substanzen ist hier festzuhalten, dass Maribavir ausschließlich für die Therapie einer CMV-Infektion bei erwachsenen Patienten, die sich einer HSCT oder einer SOT unterzogen haben, zugelassen ist, wenn die Infektion refraktär gegenüber GC, VGC, Cidofovir oder Foscarnet war, also in der Zweitlinientherapie. Genau umgekehrt ist es bei Letermovir, das nur für die Prophylaxe einer CMV-Infektion nach HSCT oder Nierentransplantation, nicht aber für die Therapie zugelassen ist.
Eine CMV-Prophylaxe ist vor allem bei SOT üblich. Als Prophylaxemedikamente kommen GC, VGC oder (eingeschränkt) Letermovir infrage. Letermovir ist bei SOT derzeit nur für die Prophylaxe bei Nierentransplantation zugelassen. Letermovir besitzt auch eine Zulassung für die CMV-Prophylaxe bei allogener HSCT bei erwachsenen, CMV-seropositiven Empfängern. Was Kombinationen angeht, so sind Foscarnet/GC sowie Maribavir/GC auf jeden Fall kontraindiziert. Möglich wäre (natürlich „off-label“) eine Kombination von Maribavir und Letermovir in der Therapie der refraktären oder resistenten CMV-Infektion, um die Viruslast rascher zu senken und Resistenzen zu vermeiden.
Quelle:
CMV-Konsensus der Österreichischen Gesellschaft für Infektionskrankheiten und Tropenmedizin (OEGIT), in Vorbereitung. Ausführliche Literaturangaben siehe dort.
Literatur:
● Zuhair M et al.: Rev Med Virol 2019; 29(3): e2034 ● Chen SJ et al.: Trop Med Infect Dis 2022; 7(12)
Das könnte Sie auch interessieren:
Vom Kampf gegen Viren und Skeptiker
Das Risiko für Schlaganfall und Myokardinfarkt steigt durch eine Influenzaerkrankung um den Faktor 8, jenes für unterschiedlichste Diabeteskomplikationen nimmt um den Faktor 74 zu. Das ...
Guidelines 2025: ein Update
Im Oktober 2025 präsentierte die European AIDS Clinical Society (EACS) eine aktuelle Version ihrer europäischen Behandlungsleitlinien zum Thema HIV/Aids. Seit zwei Jahrzehnten stellen ...
Ungewöhnliche Erreger: was atypische Pneumonien atypisch macht
Sogenannte atypische Pneumonien werden durch ein charakteristisches Keimspektrum verursacht und unterscheiden sich auch klinisch von „typischen“ Pneumonien. Exakte Begriffsdefinitionen ...