Adipositas in der Geburtshilfe
Autorin:
Dr. med. Cora Alexandra Vökt
Schwerpunkt Feto-Maternale Medizin
Frauenklinik
Spital Grabs
E-Mail: Cora.Voekt@srrws.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
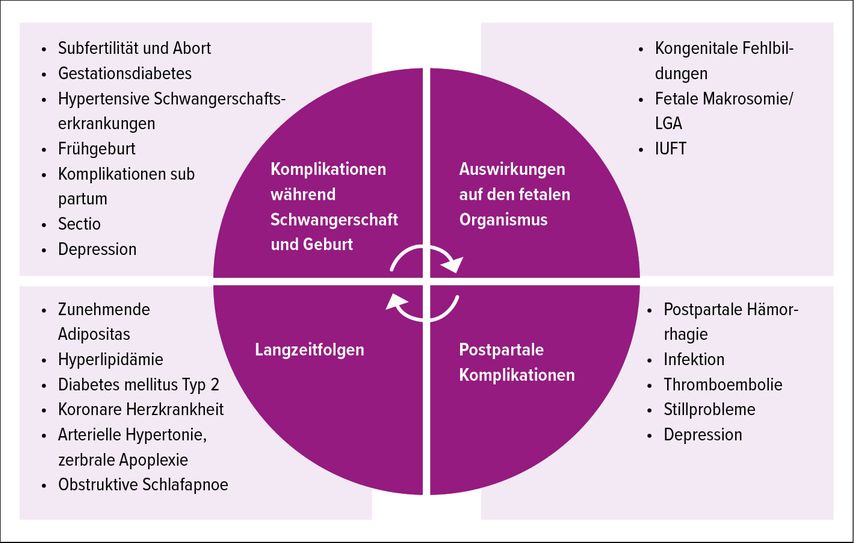
Übergewicht und Adipositas gehören zu den grössten globalen Herausforderungen für das Gesundheitssystem unserer Zeit. Auch in der Kinderwunschsprechstunde, Schwangerschaftsvorsorge und Geburtshilfe haben wir zunehmend mit den medizinischen Folgen von Übergewicht und Adipositas zu tun (Abb. 1). Aus diesem Grund wurde von der Arbeitsgemeinschaft der Wissenschaftlich Medizinischen Fachgesellschaften (AWMF) 2019 zu dieser Thematik eine S3-Leitlinie erstellt.1
Epidemiologie
Gemäss den aktuellen Zahlen des WHO European Regional Obesity Report 2022 sind bereits jetzt fast 60% aller Erwachsenen und ein Drittel aller Kinder übergewichtig oder fettleibig. In den USA sind 40% aller Frauen im Alter von 20 bis 39 Jahren adipös, knapp 10% haben einen Body-Mass-Index (BMI) von über 40.
In der Schweiz ist zwischenzeitlich jeder fünfte Erwachsene adipös.
Pathophysiologie
Die chronisch-positive Energiebilanz bei Adipositas führt zur Abspeicherung von Triglyzeriden mit konsekutiver Hypertrophie und Hyperplasie der Fettgewebszellen. Das Fettgewebe wirkt in der Folge proinflammatorisch, indem es vermehrt Zytokine und andere Signalstoffe freisetzt sowie Immunzellen moduliert. Hierdurch kommt es zur Störung diverser metabolischer und physiologischer Funktionen im Organismus. Unter anderem kann sich eine Insulinresistenz entwickeln.2
Subfertilität/Infertilität und Abortrate
Adipöse Frauen leiden häufiger an Menstruationsstörungen. Die Prävalenz von Oligo-/Anovulationen ist bei Adipositas dreimal häufiger als bei Normalgewichtigen.3 Die Konzeptionsrate pro Zyklus ist herabgesetzt. Gleichzeitig ist die Abortrate erhöht, da bei Adipositas die endometriale Implantation beeinträchtigt und die hormonelle Situation ungünstiger ist.4 Besonders bei gleichzeitig bestehendem PCO-Syndrom ist von einer Abortrate von 20–40% auszugehen. Bei Patientinnen mit rezidivierendem Abort verdoppelt sich bei bestehender Adipositas die Wahrscheinlichkeit für einen neuerlichen Abort.
Im Rahmen von Verfahren der assistierten Reproduktion sind höhere Gonadotropindosen erforderlich, es sind weniger Oozyten gewinnbar und diese sind vielfach von schlechterer Qualität.5
Was ist präkonzeptionell zu beachten ?
Adipöse Frauen mit Kinderwunsch sollten zu einer Lebensstiländerung motiviert werden:6 Essenziell ist die Umstellung der Ernährungsgewohnheiten auf eine gesunde, ausgewogene und vollwertige Ernährung mit möglichst niedriger Zufuhr von gesättigten Fettsäuren durch Vermeiden von Fast Food und sonstigen Fertigprodukten der Nahrungsmittelindustrie.
Eine Gewichtsabnahme von 5–10% ist oft bereits effektiv und kann zu einer Normalisierung des Zyklus und einer verbesserten Fruchtbarkeit führen. Die gleichzeitige Steigerung der körperlichen Aktivität wirkt sich zusätzlich günstig aus.
Eine Folsäureprophylaxe von mindestens 400 mcg/Tag ergänzend zu einer folatreichen, ausgewogenen Ernährung sollte mindestens 4 Wochen präkonzeptionell begonnen werden.7
Nach bariatrischer Chirurgie sollte in der Phase des Gewichtsverlusts in den ersten 12 bis 18 Monaten eine Schwangerschaft vermieden werden, da potenziell die Gefahr einer Minderversorgung der Schwangeren und des Fetus besteht. Das Steady State der Gewichtsabnahme und die Identifikation und Substitution möglicher nutritiver Defizite sollten bereits vor Eintritt der Schwangerschaft erreicht und optimiert sein.
Etwaige bestehende Begleiterkrankungen wie Diabetes mellitus und arterielle Hypertonie sollten idealerweise bereits präkonzeptionell erkannt und behandelt sowie bei Kinderwunsch auf schwangerschaftsverträgliche Medikamente umgestellt werden.
Nach bariatrischer Chirurgie ist eine Folsäureprophylaxe mit 800mcg täglich zu empfehlen.8
Schwangerschaftsvorsorge
Das Risiko für die Entwicklung einer gestationsbedingten Hypertonie und Präeklampsie (PE) steigt mit zunehmendem BMI.9 Das PE-Risiko liegt bei einem BMI von 30kg/m2 bei ca. 10% und verdoppelt sich mit jedem Anstieg des BMI um 5–7kg/m2. Deshalb wird in der S3-Leitlinie der AWMF ab einem BMI von 35 allen Frauen ab der 11+0 Schwangerschaftswoche die Einnahme von Acetylsalicylsäure 150mg 1x täglich abends bis zur vollendeten 36. Woche empfohlen. Alle Schwangeren mit einem BMI <35kg/m2 sollen im Rahmen des Ersttrimester-Screenings eine individuelle PE-Risikoberechnung zur Entscheidungsfindung, ob eine Aspirinprophylaxe indiziert ist oder nicht, erhalten.10–12
Das Gestationsdiabetes-Risiko steigt ebenfalls mit zunehmendem BMI. Wenn in der Frühschwangerschaft eine Glukosestoffwechselstörung ausgeschlossen wurde, ist ein oraler Glukosetoleranztest (sog. OGTT75) zum üblichen Zeitpunkt in der 24.–28. SSW indiziert.
Im Falle eines manifesten Gestationsdiabetes ist die spätere Entwicklung eines Diabetes mellitus Typ2 in bis zu 70% zu erwarten.12,13
Das venöse Thromboembolie(VTE)-Risiko ist bei allen Schwangeren bereits ab dem ersten Trimenon erhöht. Im Falle einer exzessiven Gewichtszunahme von mehr als 22kg während der Schwangerschaft steigt das VTE-Risiko weiter an. Adipositas ist ein wichtiger zusätzlicher Risikofaktor für VTE. Das höchste Risiko besteht in der ersten postpartalen Woche, insbesondere nach Kaiserschnittentbindung. Eine medikamentöse Prophylaxe mit LMWH («low molecular weight heparin») ist bei Übergewicht bereits in der Schwangerschaft zu erwägen, wenn mehr als zwei zusätzliche Risikofaktoren für VTE vorliegen sowie stets nach Kaiserschnittentbindung.15–17
Pränatale Diagnostik und Häufigkeit von Fehlbildungen
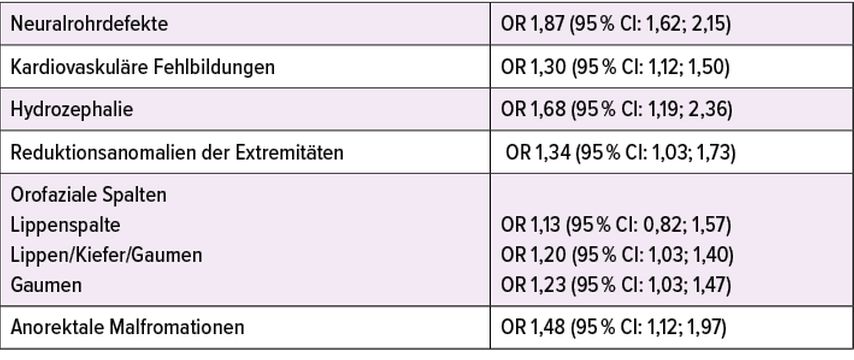
Mit zunehmendem BMI steigt das Risiko für einige fetale Entwicklungsstörungen, wie Herzfehler, Neuralrohrdefekte, orofaziale Spaltbildungen und Reduktionsanomalien (Tab. 1).18–22 Chromosomale Aberrationen und Einzelgenerkrankungen sind allerdings nicht häufiger. Leider sind die sonografische Aussagekraft und Sicherheit für die Detektion von fetalen Fehlbildungen bei adipösen Bauchdecken erniedrigt. Dies ist der Schwangeren zu kommunizieren und schriftlich zu dokumentieren. Hilfreich kann die ergänzende Anwendung der Transvaginalsonografie sein, um die Messqualität der Nackentransparenz zu optimieren, Zusatzmarker wie Trikuspidalregurgitation/Ductus venosus zu messen oder bereits in der 14. bis 16. Schwangerschaftswoche ein frühes Organscreening durchzuführen.23–27
Der non-invasive Pränataltest (NIPT) zeigt eine niedrigere diagnostische Sicherheit, da der Anteil an zellfreier fetaler DNA mit steigendem Gewicht der Frau sinkt.28,29 Ab einem BMI von 40 steigt auch das Abortrisiko nach Chorionzottenbiopsie und Amniozentese.
Höheres Risiko für Komplikationen und intrauterinen Fruchttod (IUFT)
Adipöse Schwangere haben ein signifikant erhöhtes spontanes Abortrisiko.5,30,31
Auch das Frühgeburtsrisiko ist erhöht, vor allem in Form der iatrogenen Frühgeburtlichkeit im Rahmen von Präeklampsie und intrauteriner Wachstumsrestriktion.32In mehreren Metaanalysen wurde eine erhöhte intrauterine Fruchttod(IUFT)-Rate festgestellt.33–35 Ein Grund dafür scheint bei einem Teil der adipösen Schwangeren die reduzierte Wahrnehmung der Kindsbewegungen zu sein. Auch das häufigere Vorkommen von (evtl. unerkannten) Fehlbildungen könnte eine Rolle spielen. Gemäss der S3-Leitlinie sollte eine Aufklärung über das erhöhte IUFT-Risiko bei Terminüberschreitung erfolgen.
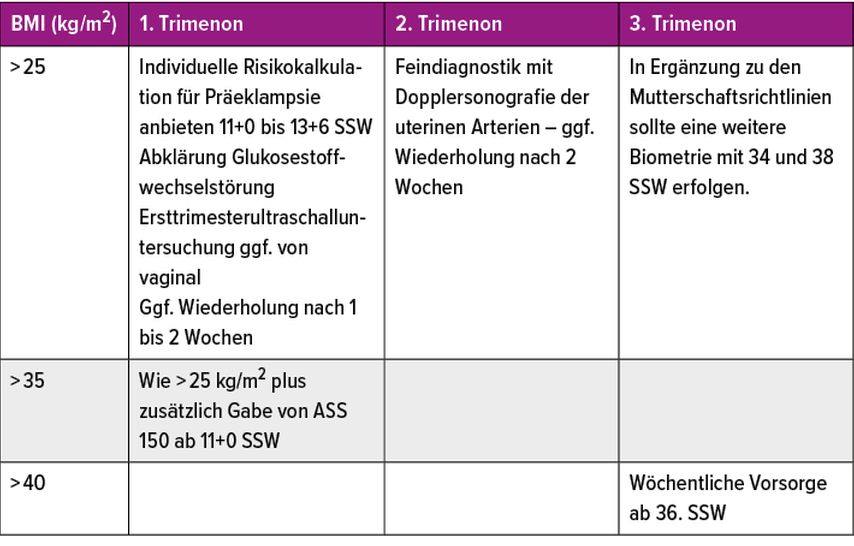
Im dritten Trimenon wird gemäss Leitlinie eine intensivierte klinische Überwachung empfohlen mit regelmässigen sonografischen Wachstumskontrollen zum Ausschluss einer IUWR/LGA. Bei BMI grösser 40 ist ab der 36. SSW eine wöchentliche klinische Kontrolle zu empfehlen, aber keine intensivierte CTG-Überwachung allein aufgrund des BMI (Tab. 2).1
Tab. 2: Übersicht über empfohlene Vorsorgeuntersuchungen bei adipösen Schwangerschaften ergänzend zu den in den Mutterschaftsrichtlinien vorgesehenen Untersuchungen (AWMF-S3-Leitlinie)1
Maternaler BMI und fetale Makrosomie
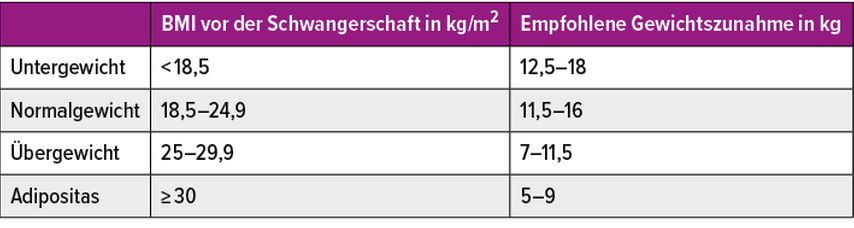
Eine exzessive maternale Gewichtszunahme oberhalb der vom Institute of Medicine (IOM) empfohlenen 5–9kg bei BMI >30kg/m2 sollte durch gute Aufklärung und Beratung zu Beginn der Schwangerschaft vermieden werden. Gemäss S3-Leitlinie kann ab einem BMI von 30 sogar eine Gewichtszunahme unterhalb der IOM-Empfehlungen von 5–9kg erwogen werden, d.h. weniger als 5kg während der gesamten Schwangerschaft (Tab. 3 und 4). Die Daten bezüglich der Gewichtszunahme unterhalb der IOM-Empfehlung sind allerdings uneinheitlich, eine Beeinträchtigung des fetalen Wachstums ist möglich.1
Tab. 3: Empfohlene Gewichtszunahme in der Schwangerschaft je nach BMI vor der Schwangerschaft, gemäss Institute of Medicine und Schweizerischer Gesellschaft für Ernährung (SGE).
Ein hoher BMI und eine exzessive Gewichtszunahme ist mit einem höheren Geburtsgewicht und/oder LGA-Fetus (>90. Perzentile) assoziiert.33,34,36 Entsprechend steigen die LGA-assoziierten Geburtskomplikationen wie protrahierter Geburtsverlauf, Notwendigkeit einer Wehenunterstützung mit Oxytocin bei sekundärer Wehenschwäche, Geburtsstillstand, vaginal-operativer Geburtsbeendigung und Schulterdystokie.34,37–39 Mit ansteigendem BMI treten Übertragungen vermehrt auf, Geburtseinleitungen sind häufiger erforderlich und nicht selten frustran. Die Rate an primären und sekundären Sectiones steigt mit zunehmendem BMI linear an.
Ein hoher BMI stellt a priori keine Indikation für eine Sectioentbindung dar und diese sollte wegen der erhöhten Komplikationsrate vermieden werden. Mit ansteigendem BMI treten anästhesiologische Komplikationen40 häufiger auf, das Risiko für primäre postpartale Hämorrhagien,33,37 Wundinfekte, Thromboembolien und Endomyometritis steigt.41
Bei Zustand nach Sectio und Adipositas besteht eine niedrigere Erfolgsrate einer vaginalen Probegeburt.42,43 Ab einem BMI von 40 steigt zudem das Risiko für eineUterusruptur und eine kindliche Verletzung.44
Es bedarf einer ausführlichen Aufklärung über die Erfolgschancen und Risiken der vaginalen Probegeburt als auch über die Risiken der I° oder II° Re-Sectio mit konsekutiv individueller Entscheidungsfindung.
Schwangerschaft nach signifikanter Gewichtsabnahme im Rahmen bariatrischer Chirurgie
Bei Schwangerschaft nach bariatrischer Chirurgie soll keine weitere Gewichtsreduktion mehr erfolgen.45 Während der Schwangerschaft sind die wichtigsten Stoffwechselparameter und Mikronährstoffe mindestens einmal pro Trimenon zu kontrollieren und hinsichtlich Substitution anzupassen. Das Risiko für ein maternales Nährstoffdefizit und die Entwicklung einer intrauterinen Wachstumsrestriktion ist erhöht. Regelmässige sonografische Wachstumskontrollen sind zu empfehlen. Gegebenenfalls ist eine diätetische Beratung zur Gewährleistung einer ausreichenden Nahrungszufuhr erforderlich.46
Die Entwicklung von Gestationsdiabetes und fetaler Makrosomie ist signifikant reduziert. Übertragungen sind seltener, die Sectiorate halbiert.
Nach Magenbypass, Omega-loop-Bypass, Duodenal Switch und biliopankreatischer Diversion sollte kein Zuckerbelastungstest im Sinne eines OGTT 75 durchgeführt werden, da es zu einem Dumpingeffekt mit Hypoglykämie kommen kann. Primär soll eine oder mehrere Nüchternblutzuckerbestimmungen erfolgen, bei Bedarf ergänzt durch postprandiale Messungen unter Normalkost.
Im Falle von abdominellen Beschwerden während der Schwangerschaft oder im Wochenbett ist differenzialdiagnostisch an eine innere, mesojejunale Hernie oder einen Darmvolvulus zu denken.
Stillförderung ist besonders wichtig
Adipöse Wöchnerinnen stillen weniger erfolgreich, weniger lang und seltener ausschliesslich.47 Medizinische, psychologische, physiologische und soziokulturelle Faktoren scheinen hierbei eine Rolle zu spielen. Der Progesteronspiegel fällt bei Adipösen nach der Geburt weniger stark ab und die Laktogenese kommt dadurch weniger gut in Gang. Die Neugeborenen haben häufiger Probleme, an der Brust anzudocken, wenn diese zu voluminös ist.
Fachkundige Beratung und Unterstützung erhöhen den Stillerfolg.
Erfolgreiches Stillen verbessert den mütterlichen Stoffwechsel, beschleunigt die Uterusrückbildung, fördert die postpartale Gewichtsabnahme und unterstützt die gesunde Entwicklung des Kindes. So haben gestillte Kinder u.a. ein deutlich niedrigeres Risiko, im späteren Leben Übergewicht und Adipositas zu entwickeln.
Kindliches Langzeit-Outcome
Maternales Übergewicht und präkonzeptionelle Adipositas sind assoziiert mit einem erhöhten Risiko für Übergewicht und Adipositas bei den Nachkommen im Kindes- und Erwachsenenalter. Dieses Risiko ist auf das 15-Fache erhöht, falls beide Elternteile adipös sind.48,49
Die In-utero-Exposition einer übermässigen maternalen Nahrungszufuhr geht mit einem erhöhten Risiko für die spätere Entwicklung einer arteriellen Hypertonie, Diabetes mellitus, koronarer Herzkrankheit und nichtalkoholischer Fettleber einher.
Fazit
Adipositas ist das häufigste Gesundheitsproblem von Frauen im fertilen Alter und bedarf eines langfristigen Managements und lebenslanger Unterstützung.50 Idealerweise sollte bereits vor der Planung einer Schwangerschaft eine Normalisierung des Körpergewichts und ein gesunder Lebensstil mit ausreichender körperlicher Aktivität angestrebt werden. Bereits eine Gewichtsreduktion um 5 bis 10% ist effektiv, um die Fertilität zu verbessern und geburtshilfliche Komplikationen während der Schwangerschaft zu reduzieren. Letzteres wird weiter unterstützt, wenn die Gewichtszunahme während der Schwangerschaft maximal 5–9kg beträgt. Es ist wichtig, bereits im ersten Trimenon die übergewichtige oder adipöse Schwangere diesbezüglich gut zu beraten und aufzuklären.
Literatur:
1 Obesity and Pregnancy. Guideline of the German Society of Gynecology and Obstetrics. https://register.awmf.org/assets/guidelines/015-081l_S3_Adipositas-Schwangerschaft_2020_06.pdf ; 2 Lyons CL et al.: Metabolic inflammation-differential modulation by dietary constituents. Nutrients 2016; 8: 247 3 Creanga AA et al.: Obesity in pregnancy. Review article. N Engl J Med 2022; 387: 248-59 4 Silvestris E et al.: Obesity as disruptor of the female fertility. Reprod Biol Endocrinol 2018; 16: 22 5 Practice Committee of the American Society for Reproductive Medicine. Obesity and reproduction: a committee opinion. Fertil Steril 2015; 104: 1116-26 6 SIM KA et al.: Weight loss improves reproductive outcomes in obese women undergoing fertility treatment. A randomized controlled trial. Clinical Obesity 2014; 4(2): 61-8 7 De-Regil LM et al.: Effects and safety of periconceptional oral folate supplematation for preventing birth defects. The Cochrane database of systematic reviews 2015; (12): CD007950 8 Stroh C et al.: Schwangerschaft nach Adipositas- und metabolischer Chirurgie – spezielle Risiken und mögliche Komplikationen. Zentralblatt für Chirurgie 2018; 143(4): 419-24 9 Deutsche Gesellschaft für Gynäkologie und Geburtshilfe. S2k-Leitlinie Diagnostik und Therapie hypertensiver Schwanger-schaftserkrankungen, 2019. https://www.awmf.org/uplo-ads/tx_szleitlinien/015-018l_S2k_Diagnostik_Therapie_hypertensiver_Schwangerschaftserkrankungen_ 10 Wright D et al.: A competing risks model in early screening for preeclampsia. Fetal Diagn Ther 2012; 32(3): 171-8 11 Rolnik DL et al.: Aspirin versus placebo in pregnancies at high risk for preterm preeclampsia. N Engl J Med 2017; 377(7): 613-22 12 Tan MY et al.: Prediction and prevention of small-for-gestational-age neonates. Evidence from SPREE and ASPRE. Ultrasound Obstet Gynecol 2018; 52(1): 52-5 13 Cavicchia PP et al.: Proportion of gestational diabetes mellitus attributable to overweight and obesity among non-hispanic black, non-hispanic white, and hispanic women in South Carolina. Matern Child Health J 2014; 18(8): 1919-26 14 Schneider S et al.: Gestational diabetes and preeclampsia – similar risk factor profiles? Early Hum Dev 2012; 88(3): 179-84 15 Virkus RA et al.: Risk factors for venous thromboembolism in 1,3 million pregnancies. A nationwide prospective cohort study. PloS One 2014; 9(5): e96495 16 Blondon M et al.: Pre-pregnancy BMI, delivery BMI, gestational weight gain and the risk of postpartum venous thrombosis. Thromb Res 2016; 145: 151-6 17 Sultan AA et al.: Development and validation of risk prediction model for venous thromboembolism in postpartum women. Multinational cohort study. BMJ 2016; 355: i6253 18 Stothard KJ et al.: Maternal overweight and obesity and the risk of congenital anomalies. A systematic review and meta-analysis. JAMA 2009; 301(6): 636-50 19 Blanco R et al.: Maternal obesity is a risk factor for orofacial clefts. A meta-analysis. Br J Oral Maxillofac Surg 2015; 53(8): 699-704 20 Izedonmwen OM et al.: What is the risk of having offspring with cleft lip/palate in pre-maternal obese/overweight women when compared to pre-maternal normal weight women? A systematic review and meta-analysis. J Oral Maxillofac Res 2015; 6(1): e1 21 Kutbi H et al.: Maternal underweight and obesity and risk of orofacial clefts in a large international consortium of population-based studies. Int J Epidemiol 2017; 46(1): 190-9 22 Cai G et al.: Association between maternal body mass index and congenital heart defects in offspring. A systematic review. Am J Obstet Gynecol 2014; 211(2): 91-117 23 Thornburg LL et al.: Fetal nuchal translucency thickness evaluation in the overweight and obese gravida. Ultrasound Obstet Gynecol 2009; 33(6): 665-9 24 Tsai P-JS et al.: Obesity and the challenges of ultrasound fetal abnormality diagnosis. Best Pract Res Clin Obstet Gynaecol 2015; 29(3): 320-7 25 Gandhi M et al.: Effect of increased body mass index on first-trimester ultrasound examination for aneuploidy risk assessment. Obstet Gynecol 2009; 112(4): 856-9 26 Racusin D, Stevens B, Campbell G, Aagaard KM: Obesity and the risk and detection of fetal malformations. Semin Perinatol 2012; 36(3): 213-21 27 Rose NC: Genetic screening and the obese gravida. Clin Obstet 2016; 59(1): 140-7 28 Ashoor G et al.: Fetal fraction in maternal plasma cell-free DNA at 11-13 weeks’ gestation. Relation to maternal and fetal characteristics. Ultrasound Obstet Gynecol 2013; 41(1): 26-32 29 Canick JA et al.: The impact of maternal plasma DNA fetal fraction on next generation sequencing tests for common fetal aneuploidies. Prenat Diagn 2013; 33(7): 667-74 30 Boots C, Stephenson MD: Does obesity increase the risk of miscarriage in spontaneous conception: a systematic review. Semin Reprod Med 2011; 29: 507-13 31 Cavalcante MB et al.: Obesity and recurrent miscarriage: a systemativ review and meta-analyses. J Obst Gynaecol Res 2019; 45: 30-8 32 McDonald SD et al.: Overweight and obesity in mothers and risk of preterm birth and low birth weight infants: systematic review and meta-analysis. BMJ 2010; 341: c3428 33 Vats H et al.: The impact of pre-pregnancy BMI on maternal, fetal and neonatal adverse outcomes in the worldwide populations: a systematic review and meta-analysis. Obes Res Clin Pract 2021; 15: 536-45 34 D’Souza R et al.: Maternal body mass index and pregnancy outcomes: a systematic review and meta-analysis. Am J Obstet Gynecol MFM 2019; 1(4): 100041 35 Aune D et al.: Maternal body mass index and the risk of fetal death, stillbirth, and infant death: systematic review and meta-analysis. JAMA 2014; 311: 1535-46 36 Gaudet I et al.: Maternal obesity and occurrence of fetal macrosomia: a systematic review and meta-analysis. Biomed Res Int 2014; 2014: 640291 37 Heslehurst N et al.: The impact of maternal BMI status on pregnancy outcomes with immediate short term obstetric resource implications: a meta-analysis. Obes Rev 2008; 9: 635-83 38 Heslehurst N et al.: Maternal body mass index and post-term birth: a systematic review and meta-analysis. Obes Rev 2017; 8: 293-308 39 Zhang C et al.: Maternal prepregnancy obesity and the risk of shoulder dystocia: a meta-analysis. BJOG 2018; 125: 407-13 40 Vricella LK et al.: Anaesthesia complications during scheduled cesarean delivery for morbidly obese women: Am J Obstet Gynecol 2010; 203(3): 276.e1-e5 41 Alanis MC et al.: Complications of cesarean delivery in the massively obese parturient. Am J Obstet Gynecol 2010; 203(3): 271.e1-7 42 Durnwald CP et al.: The impact of maternal obesity and weight gain on vaginal birth after cesarean section success. Am J Obstet Gynecol 2004; 191(3): 954-7 43 Chauhan SP et al.: Mode of delivery for the morbidly obese with prior cesarean delivery. Vaginal versus repeat cesarean section. Am J Obstet Gynecol 2001; 185(2): 349-54 44 Juhasz G et al.: Effect of body mass index and excessive weight gain on success of vaginal birth after cesarean delivery. Obstet Gynecol 2005; 106(4): 741-6 45 Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV): S3-Leitlinie Chirurgie der Adipositas und metabolischer Erkrankungen. Version 2.3, 2018. https://register.awmf.org/assets/guidelines/088-001l_S3_Chirurgie-Adipositas-metabolische Erkrankungen_2018-02.pdf ; 46 Stopp T et al.: Fertilität, Schwangerschaft und Stillzeit nach bariatrischen Operationen – eine OEGG-Stellungnahme. Geburtsh Frauenheilk 2018; 78: 1207-12 47 Ayton J et al.: Cumulative risks and cessation of exclusive breast feeding. Australian cross-sectional survey. Arch Dis Child 2015; 100(9); 863-8 48 Carling SJ et al.: Breastfeeding duration and weight gain trajectory in infancy: Pediatrics 2015, 135(1): 111-9 49 Uebel K et al.: Effect of maternal obesity with and without gestational diabetes on offspring subcutaneous and preperitoneal adipose tissue development from birth up to year-1. BMC Pregnancy Childbirth 2014; 14: 138 50 Heymsfield SB, Wadden TA: Mechanisms, pathophysiology, and management of obesity. N Engl J Med 2017; 376: 254-66
Das könnte Sie auch interessieren:
Adipositas und Schwangerschaft
Adipositas, eine über das normale Mass hinausgehende Vermehrung des Körperfetts, stellt ein zunehmendes gesellschaftliches Problem dar. Die weltweite Prävalenz von Adipositas steigt ...
Strahlenempfindlichkeit verschiedener Gewebe
Diagnostische Bildgebung und Strahlentherapie sind aus der modernen Medizin nicht mehr wegzudenken. Zweifellos bringen sie unseren Patienten grossen Nutzen, man darf jedoch nicht ...
Standard oder ein verzichtbarer Mehraufwand?
Die durchschnittliche Patientin mit einer zervikalen intraepithelialen Neoplasie (CIN) ist im reproduktiven Alter, im Mittel 30 Jahre alt und tendenziell werden die Patientinnenimmer jünger.1 Nahezu jede Exzisionsart an der Zervix uteri ist mit einer erhöhten perinatalen Morbidität behaftet. Die LLETZ («large loop excision of the transformation zone») und die LEEP («loop ...