Unkontrollierbarer Blutdruck & Blutzucker: An Nebenniere denken!
Bericht:
Reno Barth
Im Rahmen der 84. wissenschaftlichen Tagung der American Diabetes Association zeigte sich in der CATALYST-Studie, dass hinter einem schlecht einstellbaren Typ-2-Diabetes (T2D) ein erhöhter Cortisolspiegel stehen kann. Die FLOW-Studie demonstrierte einen signifikanten nephroprotektiven Effekt bei Therapie mit einem GLP-1-Analogon.
Keypoints
-
Im Studienkollektiv der CATALYST-Studie wurde mit einem Cut-off-Wert von 1,8 µg/dl bei 24% der Teilnehmer ein Hypercortisolimus diagnostiziert.
-
Aktuell wird bei Patienten mit Adenomen der bei Cushing-Syndrom eingesetzte Progesteron- und Glukokortikoidrezeptor-Antagonist Mifepriston in RCT-Studien untersucht.
-
In der FLOW-Studie zeigte der Einsatz von Semaglutid im Hochrisikokollektiv einen signifikanten Vorteil bezüglich renaler Komponenten im Vergleich zu Placebo.
-
Sekundäre Endpunkte zeigten hier die verlangsamte Abnahme der eGFR, die Reduktion schwerer kardiovaskulärer Ereignisse um 18% sowie eine 20%ige Senkung der Gesamtmortalität.
Hypercortisolismus äußert sich nicht immer in einem voll entwickelten Cushing-Syndrom mit Vollmondgesicht, Stammfettsucht, Hautatrophie, Muskelschwäche etc. Ein erhöhter Cortisolspiegel ist allerdings auch in weniger dramatischen Fällen mit metabolischen Anomalien wie gestörter Glukosetoleranz, Dyslipidämie und Hypertonie verbunden. Seit den 1990er-Jahren zeigt immer mehr Evidenz, dass Hypercortisolismus ein breites klinisches Spektrum umfasst,nicht selten als Zufallsbefund entdeckt wird und in solchen Fällen zumeist mit einer isolierten Cortisolüberproduktion in den Nebennieren beispielsweise infolge eines Tumors assoziiert ist. „Die meisten Menschen mit Hypercortisolismus sehen nicht aus, als hätten sie ein klassisches Cushing-Syndrom“, erläuterte dazu Prof. Dr. Richard Auchus, Universityof Michigan, USA, und fügte hinzu, dass ein zu hoher Cortisolspiegel deshalb noch lange nicht harmlos sei. „Wer würde gerne für den Rest des Lebens 5mg Prednison pro Tag einnehmen? Das entspräche dem Cortisolspiegel bei einem subklinischen Cushing-Syndrom“, so Auchus. Insbesondere ist Hypercortisolismus mit einer diabetischen Stoffwechsellage assoziiert – wie man sie nicht zuletzt als Komplikation einer längeren iatrogenen Steroidexposition kennt.
Hypercortisolismus kann relativ leicht mit dem Dexamethason-Suppressionstest diagnostiziert werden. Dabei wird durch die abendliche Einnahme von 1–2mg Dexamethason eine Hemmung der ACTH-Sekretion der Hypophyse angestoßen, was die körpereigene Cortisolproduktion unterdrückt. Kann die Cortisolproduktion bis zum nächsten Morgen nicht supprimiert werden, so ist die körpereigene Cortisolausschüttung vom Regelkreis entkoppelt und pathologisch. Als Cut-off-Wert empfiehlt Auchus den sehr niedrigen Cortisolwert von 1,8µg/dl. Bei diesem Wert ist zumindest eine weiterführende Abklärung indiziert.
Cortisolscreening bei schlecht einstellbarem Diabetes
Der Dexamethason-Suppressionstest (DST) könnte in Zukunft größere Bedeutung im Rahmen der Diabetesdiagnostik haben. Die Ergebnisse der im Rahmen des diesjährigen ADA-Kongresses vorgestellten CATALYST-Studie liefern einen neuen Ansatz im Verständnis des schwer kontrollierbaren T2D und legen den Verdacht nahe, dass Cortisol eine der Ursachen für eine therapieresistente Hyperglykämie sein könnte. Kandidaten für ein Screening seien, so Auchus, Patienten mit ungewöhnlicher Krankengeschichte oder ungewöhnlicher klinischer Präsentation. Schlechtes Ansprechen auf mehrere orale Antidiabetika, schwer einstellbare Hypertonie oder Insulinresistenz im jungen Alter bei negativer Familienanamnese sollten als Alarmsignale gewertet werden.
In der CATALYST-Studie wurde zunächst versucht, das Problem zu quantifizieren. Dazu wurden rund 1000 Patienten mit einem HbA1c zwischen 7,5% und 11,5% unter multiplen antidiabetischen Therapien rekrutiert und einem Dexamethason-Suppressionstest unterzogen. Alles in allem handelte es sich um eine Population unter Polymedikation: Rund 70% nahmen mindestens drei Antidiabetika, fast die Hälfte hatte bereits mindestens eine mikro- oder makrovaskuläre Komplikation hinter sich. Auch die Einnahme von Antihypertensiva war häufig: Rund 20% benötigten sogar mindestens drei Medikamente, um ihren Blutdruck zu kontrollieren. Auch die Einnahme psychiatrischer Medikation war mit 27,7% häufig.
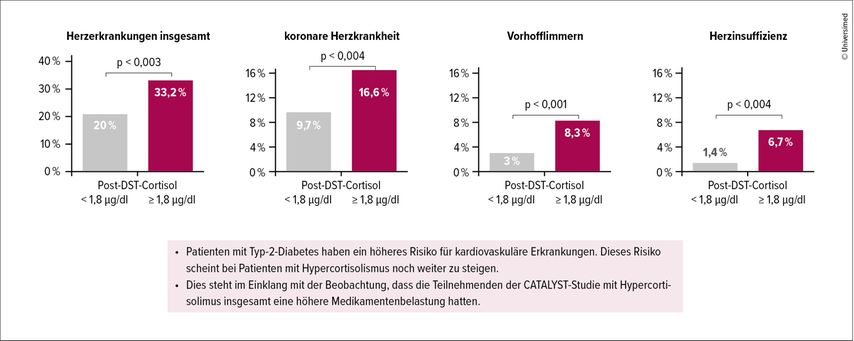
„Das Ergebnis übertraf die Erwartungen der Autoren bei Weitem“, so Prof. Dr. Vivian Fonseca, TulaneUniversity,New Orleans, USA. Bei einem Cut-off-Wert von 1,8µg/dl wurde bei 24% der Studienpopulation Hypercortisolismus diagnostiziert (Abb. 1). Der mittlere Cortisolwert nach dem Dexamethason-Hemmtest lag bei 3,5µg/dl – nicht mehr weit von jenen 5µg/dl entfernt, bei denen man bereits von einem Cushing-Syndrom sprechen kann. Der wahrscheinlichste Prädiktor für einen erhöhten Cortisolwert war die Einnahme von mindestens zwei Antidiabetika plus zwei Antihypertensiva. Wurden mindestens zwei Antidiabetika und mindestens drei Antihypertensiva eingenommen, so lag das Risiko für einen Hypercortisolismus bereits bei über 35%. „Ich sehe solche Patienten in meiner Klinik und habe diesen Aspekt immer übersehen“, so Fonseca. Eine Insulintherapie hat hingegen keinen Prädiktionswert. Auch der Body-Mass-Index beeinflusste das Risiko nicht. Hypercortisolismus ist jedoch mit kardiovaskulären Erkrankungen (koronare Herzkrankheit, Vorhofflimmern, Herzinsuffizienz) assoziiert.
Abb. 1: CATALYST-Studie: Komorbiditäten – Teilnehmer mit Hypercortisolismus hatten mehrere Herz-Kreislauf-Erkrankungen (präsentiert am ADA-Kongress 2024 von Dr. Vivian Fonseca)
Therapeutische Intervention?
Bei Patienten mit Hypercortisolismus wurden die Nebennieren mittels Bildgebung abgeklärt. Dabei zeigte sich, dass rund ein Drittel unter adrenalen Adenomen und einige wenige Patienten unter anderen Pathologien der Nebennieren litten. Bei 66% wurden keine Auffälligkeiten in der Bildgebung gefunden. Dabei handelt es sich allerdings nur um eine vorläufige Auswertung an den jeweiligen Zentren. Eine zentrale Befundung durch ein Expertenteam war zum Zeitpunkt der Präsentation noch nicht abgeschlossen und wird für den zweiten Teil der Studie von hoher Relevanz sein. Sie soll evaluieren, ob eine therapeutische Beeinflussung des Cortisolspiegels auch Einfluss auf die Kontrolle von Blutzucker und Blutdruck hat.
Die Therapie kann bei Patienten mit Adenomen chirurgisch erfolgen, jedoch soll in der Gruppe von Patienten, bei denen keine Indikation zur Operation besteht, die Wirksamkeit des beim Cushing-Syndrom eingesetzten Progesteron- und Glukokortikoidrezeptor-Antagonisten Mifepriston in einer randomisiert-kontrollierten Studie untersucht werden. „Sollte die Studie zeigen, dass die Behandlung von Hypercortisolismus mit einem Glukokortikoidrezeptor-Antagonisten Vorteile bringt, dann eröffnen sich zumindest konzeptuell neue Optionen im Management des Typ-2-Diabetes“, so Prof. Dr. John Buse, University of North Carolina, USA.
GLP-1-Analoga: Nierenschutz?
„Diabetische Nephropathie trägt in hohem Ausmaß zur Mortalität und Morbidität in einer Population von Menschen mit Diabetes bei“, so Prof. Dr. Peter Rossing vom Steno-Diabeteszentrum, Kopenhagen. Während bei T2D ohne Endorganschäden die 10-Jahres-Mortalität bei 11,5% liegt, so beträgt sie bei T2D in Verbindung mit Niereninsuffizienz bereits mehr als 30%.1 Daher werden als nephroprotektive Diabetesmedikation für Risikopatienten SGLT2-Inhibitoren empfohlen. Rossing weist allerdings darauf hin, dass diese Substanzen zwar in klinischen Studien das renale Risiko deutlich senkten, dass aber dennoch ein beträchtliches Restrisiko bestehen bleibe.
Weniger klar ist, ob und inwieweit auch die Gruppe der GLP-1-Analoga das renale Risiko senken kann. Die kardiovaskulären Endpunktstudien mit diesen Substanzen deuten in die Richtung günstiger Wirkungen auf die Niere. In der FLOW-Studie wurde unter dem primärenwie auch dem sekundären Endpunkt erstmals ein GLP-1-Analogon im Hinblick auf das renale Outcome untersucht. Verglichen wurden Semaglutid 1mg 1x/Woche mit Placebo in einer Hochrisikopatientenpopulation mit T2D. Nach dem KDIGO-Risiko-Chart fielen 93% der 3533 Patienten in die Kategorien hohes oder sehr hohes renales Risiko. Komorbiditäten waren häufig, fast die Hälfte der Studienpopulation hatte bereits einen Herzinfarkt oder Schlaganfall hinter sich oder litt unter Herzinsuffizienz.
Als primärer Endpunkt war die Zeit bis zu einem renalen Ereignis festgelegt, das u.a. als Abnahme der glomerulären Filtrationsrate um mindestens 50%, Nierenversagen (Abnahme der eGFR <15ml/min/1,73m2 oder Beginn einer Dialyse), als renaler Tod oder kardiovaskulärer Tod definiert war.2 Dieser primäre Endpunkt wurde in der FLOW-Studie durch die Behandlung mit Semaglutid signifikant um 24% reduziert. Angesichts dieses Vorteils wurde die Studie vorzeitig abgebrochen.3
Signifikante Vorteile hinsichtlich der renalen Komponente
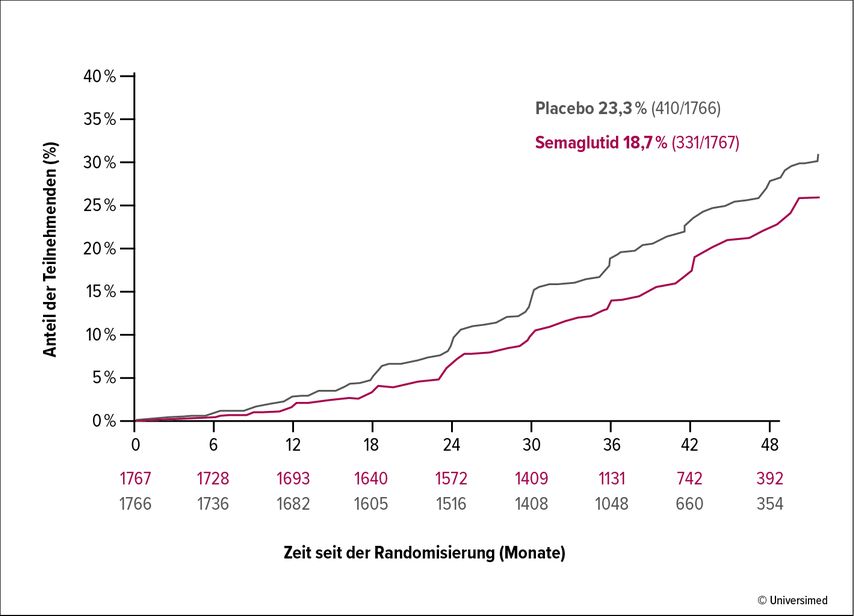
Anlässlich der Präsentation der Daten betonte Prof. Dr. Vlado Perkovic, Universityof New South Wales, Sydney, Australien, noch einmal den Hochrisikostatus der Studienpopulation der FLOW-Studie. In einem Zeitraum von 4 Jahren trat der primäre Endpunkt bei 18,7% der Patienten in der Verum- sowie bei 23,2% in der Placebogruppe ein. Die „number needed to treat“ (NNT) betrug nach 2 Jahren 37 und nach 3 Jahren 20 (Abb. 2).3 Der Vorteil von Semaglutid blieb signifikant, auch wenn lediglich die renalen Komponenten des primären Endpunkts berücksichtigt wurden und der kardiovaskuläre Tod ausgenommen wurde.
Abb. 2: FLOW-Studie – kombiniertes Ergebnis der Nierenendpunkte: primäres Ergebnis (nach Perkovic V et al., 2024)3
Im Hinblick auf sekundäre Endpunkte wurden unter Semaglutid u.a. eine verlangsamte Abnahme der eGFR, eine Reduktion der Zahl schwerer kardiovaskulärer Ereignisse um 18% sowie eine Senkung der Gesamtmortalität um 20% beobachtet. Semaglutid erwies sich mit einer Senkung des HbA1c um 0,87% im Vergleich zu 0,06% unter Placebo auch hinsichtlich der Diabeteskontrolle als überlegen. Der Beginn einer Insulintherapie war in der Semaglutidgruppe signifikant (um rund 40%) seltener erforderlich als in der Placebogruppe. Nicht zuletzt nahmen die Studienteilnehmer mit Semaglutid signifikant mehr Gewicht ab.
In beiden Studienarmen wurde zusätzlich zu Semaglutid oder Placebo nach „standard of care“ behandelt. Dies konnte, musste jedoch nicht den Einsatz eines SGLT2-Inhibitors inkludieren. In der Subgruppe der Patienten, die einen SGLT2-Inhibitor einnahmen, ging der Vorteil für Semaglutid gegenüber Placebo im Hinblick auf den primären Endpunkt verloren. Die Auswertungen der sekundären Endpunkte zeigen jedoch ein anderes Bild. So erwies sich Semaglutid im Hinblick auf die jährliche Abnahme der eGFR auch bei Patienten, die SGLT2-Inhibitoren einnahmen, im Vergleich zu Placebo als überlegen. Ebenso erwies sich Semaglutid hinsichtlich der Reduktion der kardiovaskulären Ereignisse sowie der Gesamtmortalität unabhängig von der SGLT2-Inhibitoreinnahme im Vergleich zu Placebo als wirksamer.4
Diabetes im Krankenhaus: CGM löst nicht alle Probleme
Kontinuierliche Glukosemessung (CGM) kann sowohl bei Typ-1- als auch bei Typ-2-Diabetes zu einer verbesserten glykämischen Kontrolle beitragen. Allerdings fehlen bislang prospektive Daten, die zeigen, dass dies auch bei T2D und im Krankenhaus-Setting funktioniert. Aus diesem Grund wurde die TIGHT-Studie („Time in Glucose Hospital Target“) durchgeführt. Die Autoren gingen von der Hypothese aus, dass die CGM bei hospitalisierten Patienten mit T2D außerhalb von Intensivstationen eine Einstellung auf niedrigere Blutzucker-Zielwerte (90−130mg/dl) erlaubt, ohne damit ein erhöhtes Risiko für Hypoglykämien zu provozieren. Einschlusskriterien der TIGHT-Studie waren ein Alter von mindestens 18Jahren, ein T2D, ein HbA1 ≥7% sowie zumindest eine Blutglukosemessung >180mg/dl im Krankenhaus. Tatsächlich lag der mittlere HbA1c der Studienpatienten bei 8,9% und 72% standen vor der Krankenhausaufnahme bereits unter Insulintherapie. Das Monitoring erfolgte in der Kontrollgruppe mit verblindeter CGM.
Die Ergebnisse wurden im Rahmen des diesjährigen ADA-Kongresses vorgestellt. Die Studienpatienten wurden randomisiert entweder unter CGM-Kontrolle auf Glukosezielwerte zwischen 90 und 130mg/dl eingestellt oder nach „standard of care“ behandelt, was im Krankenhaus-Setting in den USA einem Glukoseziel von 140−180mg/dl entspricht. Das Studienziel wurde nicht erreicht. In beiden Gruppen konnten weniger als 10% der Studienpatienten auf Glukosewerte zwischen 90 und 130mg/dl eingestellt werden. Auch hinsichtlich der Hypoglykämien zeigten sich keine signifikanten Unterschiede zwischen den Gruppen. Zwar waren Hypoglykämien im Standardarm häufiger, doch war die Inzidenz in beiden Armen mit weniger als einem Prozent sehr niedrig, sodass keine Signifikanz erreicht wurde.
Allerdings betonte Studienautor Prof. Dr. Guillermo Umpierrez, Emory University, Atlanta, USA, anlässlich der Präsentation der Daten, dass deutlich mehr intensiver behandelte Patienten in den Glukosebereich zwischen 140 und 180mg/dl kommen. Deutlich weniger Patienten aus der intensiv behandelten Gruppe (33% vs. 52%) waren mit einer Durchschnittsglukose über 180 mg/dl sehr schlecht eingestellt. „Zusammengefasst hat die TIGHT-Studie gezeigt, dass Patienten mit hohem HbA1c vor Krankenhausaufnahme sehr schwierig zu kontrollieren waren“, so Umpierrez. Lag das HbA1c bei Aufnahme unter 9%, so erwies sich das intensive Behandlungskonzept als überlegen. Im Rahmen der Diskussion wies Prof. Dr. Irl Hirsch, Universityof Washington School of Medicine, USA, auf die zahlreichen Schwierigkeiten hin, die mit der Planung einer Studie wie TIGHT verbunden sind. So erfolge das Glukosemanagement in den meisten Krankenhäusern nach hausinternen, nichtstandardisierten Protokollen, was ein multizentrisches Studiendesign erschwere. Es gebe, so Hirsch, auch keine Algorithmen für die Intensivierung der Therapie von hospitalisierten T2D-Patienten mit einem HbA1c über 9%. Gleichzeitig wurde in TIGHT jedoch eine sehr realistische Population untersucht, was entsprechenden Handlungs- und Forschungsbedarf nahelege.
Inkretin-Analogon wirkt unabhängig von Insulinsensitivität und Betazellfunktion
Aktuelle Daten wurden auch zu dem „Twinkretin“ Tirzepatid präsentiert, das in den USA und Europa zur Behandlung des Typ-2-Diabetes sowie der Adipositas zugelassen ist. Tirzepatid ist ein kombinierter GIP(glukoseabhängiges insulinotropes Peptid-) und GLP-1-Rezeptor-Agonist und damit ein Vertreter einer neuen Substanzklasse. Seine Wirkung wurde unter anderem in den Studien SURMOUNT-1 und SURMOUNT-2 untersucht. In SURMOUNT-1 konnte gezeigt werden, dass Tirzepatid bei Prädiabetes in Verbindung mit Übergewicht oder Adipositas das Risiko einer Progression zu Typ-2-Diabetes um 90% reduzieren kann.5 In SURMOUNT-2 wurde demonstriert, dass übergewichtige Patienten mit schlecht kontrolliertem Typ-2-Diabetes mit hochdosiertem Tirzepatid (15mg) über 72 Wochen im Mittel 15,7% ihres Körpergewichtes abnahmen.6
Dr. Tim Heise, Lead Scientist am Profil Institut für Stoffwechselforschung GmbH in Neuss, Deutschland, präsentierte im Rahmen der diesjährigen ADA Scientific Sessions Post-hoc-Auswertungen von SURMOUNT-2, die die Auswirkungen von Insulinsensitivität und Betazellfunktion auf die Wirksamkeit von Tirzepatid untersuchten. Die Analyse ergab keine relevanten Abhängigkeiten von Betazellfunktion oder Insulinsensitivität. Mit allen untersuchten Dosierungen von Tirzepatid wurden erhebliche Gewichtsreduktionen erzielt, auf die Betazellfunktion oder Insulinsensitivität keinen Einfluss hatten. In allen Gruppen war Tirzepatid im Vergleich zu Placebo signifikant und sehr deutlich überlegen.7
Ebenfalls im Rahmen des ADA Meetings diskutiert wurden die Ergebnisse der randomisierten, kontrollierten Studien SURMOUNT-OSA-1 und SURMOUNT-OSA-2, die die Wirkung einer Gewichtsreduktion mit Tirzepatid auf das obstruktive Schlafapnoe-Syndrom (OSA) untersuchten. Die beiden Studien wurden kürzlich auch publiziert und unterschieden sich insofern, als Patienten in SURMOUNT-OSA-1 keine CPAP-Therapie durchführten, während Teilnehmer von SURMOUNT-OSA-2 zu Studienbeginn bereits CPAP anwendeten und während der Studie fortführten. In beiden Studien reduzierte sich unter Therapie mit Tirzepatid nicht nur der Body-Mass-Index, sondern auch der Apnoe-Hypopnoe-Index (AHI), der angibt, wie viele Apnoeepisoden pro Stunde auftreten, signifikant. In beiden Studien ging der AHI um mehr als 50% zurück. Auch sekundäre Endpunkte wie Hypertonie oder hochsensitives C-reaktives Protein besserten sich unter Therapie mit Tirzepatid.8
Quelle:
American Diabetes Association, 84th Scientific Sessions von 21. bis 24.Juni 2024 in Orlando, Florida, USA
Literatur:
1 Afkarian M et al.: Kidney disease and increased mortality risk in type 2 diabetes. J Am Soc Nephrol 2013; 24(2): 302-8 2 Rossing P et al.: The rationale, design and baseline data of FLOW, a kidney outcomes trial with once-weekly semaglutide in people with type 2 diabetes and chronic kidney disease. Nephrol Dial Transplant 2023; 38(9): 2041-51 3 Perkovic V et al.: Effects of Semaglutide on chronic kidney disease in patients with type 2 diabetes. N Engl J Med 2024; 391(2): 109-21 4 Mann JFE et al.: Effects of semaglutide with and without concomitant SGLT2 inhibitor use in participants with type 2 diabetes and chronic kidney disease in the FLOW trial. Nat Med 2024; https://research.regionh.dk/en/publications/effects-of-semaglutide-with-and-without-concomitant-sglt2-inhibit ; zuletzt aufgerufen am 20.8.2024 5 Jastreboff AM et al.: Tirzepatide once weekly for the treatment of obesity. N Engl J Med 2022; 387(3): 205-16 6 Garvey WT et al.:Tirzepatide once weekly for the treatment of obesity in people with type 2 diabetes (SURMOUNT-2): a double-blind, randomised, multicentre, placebo-controlled, phase 3 trial Lancet 2023; 402(10402): 613-26 7 Heise T: Tirzepatide reduces HbA1c and body weight significantly more than placebo regardless of insulin sensitivity and beta-cell function—post hoc analysis from SURMOUNT-2.Presented at ADA 84th Scientific Meeting, June 22nd, Orlando 8 Malhotra A et al.: Tirzepatide for the treatment of obstructive sleep apnea and obesity. N Engl J Med 2024;online ahead of print
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...