TIR vs. HbA1c– was zählt für Menschen mit Diabetes mellitus?
Autor*innen:
Dr. Clemens Harer
Assoz. Prof. Priv.-Doz. Dr. Julia Mader
Klinische Abteilung für Endokrinologie und Diabetologie
Medizinische Universität Graz
E-Mail: clemens.harer@medunigraz.at
Das glykierte Hämoglobin (HbA1c) dient seit 1993 als etablierter diagnostischer Parameter sowie als prognostischer Surrogatmarker der Glukosekontrolle für Menschen mit Diabetes mellitus.1 Trotz der etablierten und vergleichsweise günstigen Bestimmung dieses Parameters haben der Einzug und die zunehmende Verbreitung von kontinuierlicher Glukosemessung (CGM) den klinischen Alltag verändert.
Keypoints
-
Bei Menschen mit Diabetes mellitus, die ein CGM-System nutzen, sollte das AGP („ambulatory glucose profile“) zur Beurteilung der glykämischen Kontrolle genutzt werden, anstatt diese allein auf den HbA1c zu basieren.
-
Um das Auftreten von diabetischen Spätfolgen zu minimieren, sollte eine TIR (70–180 mg/dl) >70% erreicht werden.
-
Langfristig werden CGM-basierte Outcomes den HbA1c als alleinigen Haupt-Outcome-Parameter bei klinischen Studien ablösen.
-
Studien zu CGM-Systemen sollten immer das Wohlbefinden der Anwender*innen sowie die Wahrscheinlichkeit für das Auftreten von (nächtlichen) Hypoglykämien als mögliches Outcome berücksichtigen, da dies entscheidend für die Wahl eines CGM-Systems ist.
-
Derzeit sind CGM-Systeme für die Nutzung im Krankenhaus nicht zugelassen. Weitere klinische Studien sind notwendig, um Vorteile der Verwendung bei hospitalisierten Patient*innen zu zeigen.
CGM ermöglicht nicht nur eine ständige Verfügbarkeit des Glukosesignals für Menschen mit Diabetes mellitus und das Gesundheitspersonal, sondern erlaubt auch die Nutzung der CGM-basierten Daten zur Bewertung der glykämischen Kontrolle durch Verwendung standardisierter Zielwerte und Metriken.2 Im Gegensatz zur alleinigen Bestimmung der Nüchternglukose brachte die Einführung des HbA1c nicht nur die Möglichkeit, eine Momentaufnahme der aktuellen Blutglukose zu haben, sondern auch eine Bewertung der Diabeteseinstellung der vorangegangenen drei Monate vorzunehmen. Der HbA1c ist jedoch nicht nur ein Parameter zur Beurteilung der glykämischen Kontrolle, sondern wird auch herangezogen, um das Risiko für das Auftreten von mikro- und makrovaskulären Komplikationen abzuschätzen.3
Die Bestimmung des HbA1c ist unkompliziert, mit geringen Kosten assoziiert und nicht direkt von den aktuellen Blutzuckerwerten am Tag der Messung abhängig. Der Zeitraum der durchschnittlichen Blutglukose, über den dieser Parameter Auskunft gibt, ist abhängig von der Erythrozytenlebensdauer und beträgt somit rund 120 Tage.4
Einschränkungen des HbA1c in der Bewertung der glykämischen Kontrolle
Der HbA1c gibt keinen Aufschluss über die Glukosevariabilität oder Muster von Glukoseveränderungen. Zudem führen beispielsweise rezidivierende Hypoglykämien zu falsch-niedrigen Messwerten.
Abgesehen davon können Zustände, die die Erythrozytenlebensdauer verlängern oder verkürzen, die Aussagekraft des Parameters beeinflussen:
-
Falsch-hoher HbA1c: Eisenmangel5
-
Falsch-niedriger HbA1c: Dialyse, Lebererkrankungen, Blutverlust, Bluttransfusion, behandelte renale Anämie, chronische hämolytische Anämie,6,7 Supplementation der Vitamine C und E8,9
Aber auch ethnische Unterschiede des HbA1c sind beschrieben.10 Manche Hämoglobinvarianten können zudem die Genauigkeit von bestimmten Labor-Assays verfälschen.11 Im Gegensatz dazu zeigen sich die kontinuierliche Glukosemessung und die daraus gewonnenen Berichte der glykämischen Kontrolle unbeeinflusst von diesen Faktoren.
Formen der kontinuierlichen Glukosemessung
Bei der CGM kann man grundsätzlich zwischen verblindeter CGM (retrospektive CGM; Daten werden erst zu einem späteren Zeitpunkt ausgelesen), rtCGM („real time CGM“; Daten werden kontinuierlich übertragen und direkt zur Therapieentscheidung genutzt) sowie isCGM („intermittently scanned CGM“; Daten werden kontinuierlich gemessen, jedoch nur beim Scannen des Sensors dargestellt) unterschieden. Während isCGM-Systeme gerade in den Anfängen mobiler Sensortechnologie stärker verbreitet waren, ist insbesondere durch die steigende Verwendung von AID(„automated insulin delivery“)-Systemen der Anteil an rtCGM-Sensoren immer größer geworden. Verblindete CGM-Sensoren hingegen sind, mit Ausnahme von bestimmten Fragestellungen bei klinischen Studien oder zur kurzfristigen Überprüfung der glykämischen Kontrolle in Situationen mit vermuteten glykämischen Schwankungen, von untergeordneter Bedeutung, da Menschen mit Diabetes keine akuten Therapieentscheidungen basierend auf diesen Daten treffen können.12 Insbesondere Menschen mit Typ-1-Diabetes und verminderter Hypoglykämiewahrnehmung profitieren von der Verwendung von rtCGM-Systemen, wobei dies in erster Linie mit dem Vorhandensein von Warn- und Alarmfunktionen bei den neueren Generationen dieser Geräte zusammenhängen dürfte.13
CGM-basierte Metriken
Die Glukosevariabilität beschreibt die Abweichung der mittleren Glukose und wird meistens in SD („standard deviation“) oder MAGE („mean amplitude of glucose excursions“) angegeben.14 Im Gegensatz dazu wird die Genauigkeit von CGM-Systemen, insbesondere bei Gruppenvergleichen in klinischen Studien, mit MARD („mean absolute relative difference“) beschrieben.15
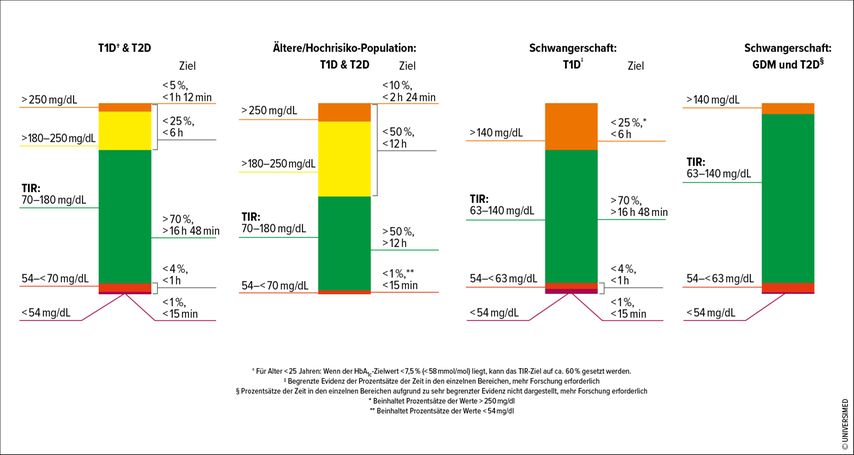
Bei Nutzung und Interpretation der CGM wird grob zwischen drei glykämischen Zielbereichen unterschieden, welche normalerweise gemeinsam mit dem AGP („ambulatory glucose profile“), den täglichen Glukoseprofilen und weiteren Glukosemetriken im AGP-Report abgebildet werden:16,17
-
TAR („time above range“ – Zeit über dem Zielbereich): >180mg/dl; diese sollte <25% betragen.
-
TIR („time in range“ – Zeit im Zielbereich): 70–180mg/dl; diese sollte >70% betragen.
-
TBR („time below range“ – Zeit unter dem Zielbereich): <70mg/dl; diese sollte <4% betragen.
Eine weitere Unterteilung der TAR und TBR in jeweils Stufe 1 und 2 kann sinnvoll sein, um das Auftreten von schweren hyper- oder hypoglykämischen Ereignissen abzuschätzen (Details siehe Abb. 1).18
Abb. 1: CGM-basierte Ziele für unterschiedliche Populationen mit Diabetes mellitus (adaptiert nach Battelino T et al.: Diabetes Care 2019)17
Zielwerte in der Schwangerschaft
Aufgrund des erhöhten Risikos für Makrosomie, Abort, Fehlbildungen, neonatale Hypoglykämie und Präeklampsie gelten in der Schwangerschaft von Frauen mit Typ-1-Diabetes, neben eigenen (Nüchtern-)Blutzucker- und HbA1c-Zielwerten, individuelle Zielbereiche basierend auf CGM-Daten:19
-
TAR: >140mg/dl; diese sollte <25% betragen.
-
TIR: 63–140mg/dl; diese sollte >70% betragen.
-
TBR: <63mg/dl; diese sollte <4% betragen.
Die Ziele der glykämischen Kontrolle für Frauen mit vorbestehendem Typ-2-Diabetes und GDM (Gestationsdiabetes) basierend auf TIR, TAR und TBR sind in Abbildung 1 zusammengefasst.17,18,20
Vorteile der CGM
Eine Metaanalyse von 271 Studien zeigte, dass sich der Ausgangswert des HbA1c nach 2–4 Monaten Sensornutzung bei Erwachsenen um –0,56% und bei Kindern und Jugendlichen um –0,54% verbesserte. Erwachsene zeigten in diesem Zusammenhang auch nach 12 Monaten Sensornutzung einen nachhaltigen Effekt. Des Weiteren zeigte die Analyse keine signifikanten Unterschiede zwischen Menschen mit Typ-1- und Typ-2-Diabetes.21
Eine Studie bei Menschen mit Typ-1-Diabetes und rtCGM, bei dessen Anwendung die Daten mit mindestens einer anderen Person geteilt wurden, zeigte, dass sich die Angst vor Hypoglykämien (–90%) und der krankheitsassoziierte Stress (–36%) bei insgesamt gebessertem Allgemeinbefinden (+54%) deutlich reduzierten.22
Eine weitere Studie, die die Lebensqualität von Eltern mit Kindern mit Typ-1-Diabetes und geteilten CGM-Daten untersuchte, zeigte ähnliche Ergebnisse: Über 60% der Befragten gaben eine Verbesserung des allgemeinen Wohlbefindens und der Schlafqualität sowie 98% weniger Sorgen wegen Hypoglykämien an.23
Auch während sportlicher Betätigung kann die Beurteilung der CGM, inklusive Trendanzeigen, hilfreich zur Vermeidung von Hypoglykämien sein. Es ist allerdings zu bedenken, dass bei Sport bzw. körperlicher Aktivität die Sensorgenauigkeit geringer ist, was durch eine höhere MARD in diesen Phasen zu erkennen ist.24
Die Verfügbarkeit von CGM-Systemen hat das Diabetesmanagement erleichtert und verbessert, aber auch das Auswerten von CGM-Daten zur Evaluierung der Diabeteseinstellung anhand von standardisierten Metriken ermöglicht.
Basierend auf CGM-Daten fanden nun auch erste Korrelationsanalysen statt, die die TIR sowie die Glukosevariabilität als zukünftige Marker für makro- und mikrovaskuläre Komplikationen plausibel erscheinen lassen. Anders als beim HbA1c können mithilfe dieser Daten auch Aussagen über das Auftreten von (schweren) Hypoglykämien bei Menschen mit Typ-1- und Typ-2-Diabetes getroffen werden.25
Aktuell werden HbA1c, Nüchternglukose und Glukosetagesprofile in klinischen Studien zur Beurteilung der glykämischen Kontrolle herangezogen. Allerdings werden in Zukunft auch CGM-Systeme, als mittlerweile etablierte Glukosemessmethode im Alltag, immer mehr Eingang in klinische Studien finden. Dabei wird es bei ihrer Auswertung nicht nur wichtig sein, darauf zu achten, dass die entsprechenden Guidelines eingehalten werden, sowie eine ausreichende Datenmenge zu sammeln, sondern auch ein geeignetes CGM-System zu wählen. Primär sollten Systeme mit adäquater Genauigkeit verwendet und in allen Studienarmen dieselben Systeme zur Beurteilung der glykämischen Kontrolle herangezogen werden.26,27
Limitationen bei der Verwendung von CGM-Systemen
Das Tragen von CGM-Sensoren führt trotz Weiterentwicklung der verwendeten Materialien immer wieder zu Hautreaktionen oder seltener zu Schmerzen an der Einstichstelle bei manchen Patient*innen, was für diese auch ein entscheidendes Hindernis für die Weiterverwendung werden kann. Für das betreuende medizinische Personal ist es wichtig, im Vorfeld nicht nur darauf hinzuweisen, sondern auch auf eine eingeschränkte Sensorgenauigkeit bei niedrigen oder sehr hohen Glukosekonzentrationen, um bei Anwender*innen Fehleinschätzungen zu minimieren. Auch die Notwendigkeit regelmäßiger Kalibrationen bei manchen Geräten sowie das Auftreten von Verbindungsproblemen zwischen Sensor und Empfänger führen bei vielen Anwender*innen zu Frust, da sie tendenziell mehr Zeit mit ihren Messsystemen verbringen müssen. Das Stigma, das für manche Nutzer*innen entsteht, sowie ein mögliches Fremdkörpergefühl beim Tragen eines Sensors können für Anwender*innen zu zusätzlichen Belastungen führen.24,28,29 Ein Aspekt, der bei breiter Verwendung von CGM in Zukunft sicherlich genauer untersucht werden muss, ist die Beeinflussung von Messergebnissen durch Arzneimittel. So kommt es beispielsweise bei der gleichzeitigen Verwendung von Acetaminophen fälschlicherweise zu erhöhten Messwerten in der CGM, verglichen mit der herkömmlichen Blutzuckermessung.30
Auch wenn sich die Verwendung von CGM in den letzten 10 Jahren mehr als verdreifacht hat, sind Effekte auf Glukosekontrolle und Auftreten von Diabeteskomplikationen meist abhängig von Lebensalter, Häufigkeit der Verwendung, sozioökonomischem Hintergrund sowie Ethnizität.31 Vermutlich dürften jedoch die letzten beiden Punkte in öffentlich finanzierten Gesundheitssystemen wie in Österreich eine untergeordnete Rolle spielen.
CGM in der Schwangerschaft
In Österreich, wie in vielen anderen europäischen Ländern, sind CGM-Systeme bei Schwangeren mit Typ-1-Diabetes, aber auch jenen mit insulintherapiertem GDM und Typ-2-Diabetes, bereits weit verbreitet, um die engeren Glukosezielwerte (Abb. 1) besser erreichen zu können — und das, ohne gefährliche Hypoglykämien zu erleben. Ähnlich wie in der Anwendung ohne Schwangerschaft sind CGM-Systeme nützlich zur Detektion von (nächtlichen) Hypoglykämien und postprandialen Hyperglykämien, welche mit konservativeren Messmethoden unentdeckt geblieben wären.32 Eine Studie hat gezeigt, dass die Glukosevariabilität bei Patientinnen mit vorbestehendem Diabetes mellitus tendenziell größer als bei jenen mit GDM ist. Somit ist es naheliegend, dass in dieser Gruppe strengere Zielwerte in der CGM-Metrik gewählt werden (Abb. 1).33
Die American Diabetes Association (ADA) empfiehlt in den neuesten Guidelines für Schwangere mit Diabetes mellitus die Verwendung der CGM zur Überwachung der Glukosekontrolle.20 Was die glykämische Kontrolle intra und post partum anbelangt, gibt es jedoch keine konkreten Zielwertempfehlungen. Beispielsweise konnte in einer prospektiven Beobachtungsstudie kein eindeutiger Zusammenhang zwischen neonataler Hypoglykämie und intra-partum-glykämischer Kontrolle der Mutter mit Typ-1-Diabetes hergestellt werden, was genauere Angaben für eigene CGM-Zielwerte bei der Entbindung schwierig macht.34
CGM im Krankenhaus
Die Bestimmung der kapillären Glukose am Patient*innenbett mit eigens dafür zugelassenen Point-of-Care-Geräten, die ins Krankenhausinformationssystem eingebunden sind, ist aktuell noch Standard bei hospitalisierten Patient*innen.35 Auch wenn die Forschung zur CGM-Technologie in diesem Bereich schon vielversprechende Ergebnisse geliefert hat, gibt es immer noch Hürden für den Einzug in den klinischen Alltag. Außerdem sind CGM-Systeme für die Nutzung unter stationären Bedingungen noch nicht zugelassen.
Praxistipp
Der HbA1c verbessert sich durch die Nutzung von CGM schon nach 2–4 Monaten bei Erwachsenen um –0,56 % sowie bei Kindern und Jugendlichen um –0,54 %.In einer Studie zeigte sich beispielsweise, dass ein für 3–10 Tage getragenes CGM-System (Freestyle Libre Pro) im stationären Bereich bei Patient*innen mit Typ-2-Diabetes mit oder ohne Insulintherapie, wie bereits aus dem nichtstationären Bereich bekannt, niedrigere durchschnittliche Glukosewerte anzeigt. Bei Nichtberücksichtigung würden auch im stationären Bereich Hypoglykämien falsch-positiv erkannt und entsprechende Gegenmaßnahmen gesetzt werden. Auch die Genauigkeit der Messwerte im hypoglykämischen Bereich war gleichsam reduziert.36 Da besonders hohe oder niedrige Glukosespiegel mit eingeschränkter CGM-Genauigkeit einhergehen, wird in aktuellen Konsensusrichtlinien empfohlen, dass CGM-Systeme im stationären Bereich nicht bei Patient*innen mit schwerer Hypo- oder Hyperglykämie (d.h. bei Glukosewerten <40mg/dl, >500mg/dl oder diabetischer Ketoazidose) verwendet werden sollten. Die Autor*innen empfehlen in diesem Zusammenhang unter anderem die dringende Aktivierung einer frühzeitigen Alarmfunktion bei CGM-Systemen ab Schwellenwerten von <80–85mg/dl sowie die Beachtung der Trendpfeile.
Analog dazu sollte zum aktuellen Zeitpunkt CGM nur ergänzend zur Glukosemessung im Krankenhaus verwendet werden. Grundvoraussetzung sollte zudem eine sorgfältig ausgewählte Sensorplatzierung sein, da Ödeme oder Ekzeme, wie sie häufig im stationären Bereich zu finden sind, die Messwerte verfälschen könnten.37
In Zukunft ist sicherlich eine immer breitere Anwendung von CGM sowohl im klinischen Alltag als auch im Rahmen von klinischen Studien zu erwarten. Es ist anzunehmen, dass neuere Sensorgenerationen noch kleiner, genauer und letztlich auch kostengünstiger werden.
Literatur:
1 Gebel E: The start of something good: the discovery of HbA1c and the American Diabetes Association Samuel Rahbar Outstanding Discovery Award. Diabetes Care 2012; 35(12): 2429-31 2 Danne T et al.: International Consensus on Use of Continuous Glucose Monitoring. Diabetes Care 2017; 40(12): 1631-40 3 Buse JB et al.: 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2020; 63(2): 221-8 4 Tahara Y, Shima K: The response of GHb to stepwise plasma glucose change over time in diabetic patients. Diabetes Care 1993; 16(9): 1313-4 5 Tarim O et al.: Effects of iron deficiency anemia on hemoglobin A1c in type 1 diabetes mellitus. Pediatr Int 1999; 41(4): 357-62 6 Panzer S et al.: Glycosylated hemoglobins (GHb): an index of red cell survival. Blood 1982; 59(6): 1348-50 7 Little RR, Rohlfing CL: The long and winding road to optimal HbA1c measurement. Clin Chim Acta 2013; 418: 63-71 8 Ceriello A et al.: Vitamin E reduction of protein glycosylation in diabetes. New prospect for prevention of diabetic complications? Diabetes Care 1991; 14(1): 68-72 9 Davie SJ et al.: Effect of vitamin C on glycosylation of proteins. Diabetes 1992; 41(2): 167-73 10 Bergenstal RM et al.: Racial differences in the relationship of glucose concentrations and hemoglobin A1c levels. Ann Intern Med 2017; 167(2): 95-102 11 Little RR, Roberts WL: A review of variant hemoglobins interfering with hemoglobin A1c measurement. J Diabetes Sci Technol 2009; 3(3): 446-51 12 Ahn D et al.: Unblinded CGM should replace blinded CGM in the clinical management of diabetes. J Diabetes Sci Technol 2016; 10(3): 793-8 13 Reddy M et al.: A randomized controlled pilot study of continuous glucose monitoring and flash glucose monitoring in people with type 1 diabetes and impaired awareness of hypoglycaemia. Diabet Med 2018; 35(4): 483-490 14 Service FJ: Glucose variability. Diabetes 2013; 62(5): 1398-1404 15 Reiterer F et al.: Significance and reliability of MARD for the accuracy of CGM systems. J Diabetes Sci Technol 2017; 11(1): 59-67 16 Agiostratidou G et al.: Standardizing Clinically Meaningful Outcome Measures Beyond HbA1c for Type 1 Diabetes: a Consensus Report of the American Association of Clinical Endocrinologists, the American Association of Diabetes Educators, the American Diabetes Association, the Endocrine Society, JDRF International, The Leona M. and Harry B. Helmsley Charitable Trust, the Pediatric Endocrine Society, and the T1D Exchange. Diabetes Care 2017; 40(12): 1622-30 17 Battelino T et al.: Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care 2019; 42(8): 1593-1603 18 Advani A: Positioning time in range in diabetes management. Diabetologia 2020; 63(2): 242-52 19 American Diabetes Association: 12. Management of Diabetes in Pregnancy. Diabetes Care 2016; 39(Suppl 1): S94-8 20 American Diabetes Association: 14. Management of Diabetes in Pregnancy: Standards of Medical Care in Diabetes-2019. Diabetes Care 2019; 42(Suppl 1): S165-S172 21 Evans M et al.: The impact of flash glucose monitoring on glycaemic control as measured by HbA1c: a meta-analysis of clinical trials and real-world observational studies. Diabetes Ther 2020; 11(1): 83-95 22 Polonsky WH, Fortmann AL: Impact of real-time continuous glucose monitoring data sharing on quality of life and health outcomes in adults with type 1 diabetes. Diabetes Technol Ther 2021; 23(3): 195-202 23 Polonsky WH, Fortmann AL: Impact of real-time CGM data sharing on quality of life in the caregivers of adults and children with type 1 diabetes. J Diabetes Sci Technol 2022; 16(1): 97-105 24 Moser O et al.: Glucose management for exercise using continuous glucose monitoring (CGM) and intermittently scanned CGM (isCGM) systems in type 1 diabetes: position statement of the European Association for the Study of Diabetes (EASD) and of the International Society for Pediatric and Adolescent Diabetes (ISPAD) endorsed by JDRF and supported by the American Diabetes Association (ADA). Pediatr Diabetes 2020; 21(8): 1375-93 25 DeVries JH: Glucose variability: where it is important and how to measure it. Diabetes 2013; 62(5): 1405-8 26 Beyond A1C Writing Group: Need for regulatory change to incorporate Beyond A1C glycemic metrics. Diabetes Care 2018; 41(6): e92-e94 27 Battelino T et al.: Continuous glucose monitoring and metrics for clinical trials: an international consensus statement. Lancet Diabetes Endocrinol 2023; 11(1): 42-57 28 Messer LH et al.: Best friend or spy: a qualitative meta-synthesis on the impact of continuous glucose monitoring on life with type 1 diabetes. Diabet Med 2018; 35(4): 409-18 29 Messer LH et al.: Preserving skin integrity with chronic device use in diabetes. Diabetes Technol Ther 2018; 20(S2): S254-S264 30 Maahs DM et al.: Effect of acetaminophen on CGM glucose in an outpatient setting. Diabetes Care 2015; 38(10): e158-9 31 Foster NC et al.: State of type 1 diabetes management and outcomes from the T1D Exchange in 2016-2018. Diabetes Technol Ther 2019; 21(2): 66-72 32 Chen R et al.: Continuous glucose monitoring for the evaluation and improved control of gestational diabetes mellitus. J Matern Fetal Neonatal Med 2003; 14(4): 256-60 33 Mazze R, Yogev Y et al.: Measuring glucose exposure and variability using continuous glucose monitoring in normal and abnormal glucose metabolism in pregnancy. J Matern Fetal Neonatal Med 2012; 25(7): 1171-5 34 Stewart ZA et al.: A feasibility study of paired continuous glucose monitoring intrapartum and in the newborn in pregnancies complicated by type 1 diabetes. Diabetes Technol Ther 2019; 21(1): 20-7 35 Moghissi ES et al.: American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control. Diabetes Care 2009; 32(6): 1119-31 36 Galindo RJ et al.: Comparison of the FreeStyle Libre Pro flash continuous glucose monitoring (CGM) system and point-of-care capillary glucose testing in hospitalized patients with type 2 diabetes treated with basal-bolus insulin regimen. Diabetes Care 2020; 43(11): 2730-5 37 Galindo RJ et al.: Continuous glucose monitors and automated insulin dosing systems in the Hospital Consensus Guideline. J Diabetes Sci Technol 2020; 14(6): 1035-64
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...