Neue und zukünftige T2D-Therapieoptionen im Kindes- und Jugendalter
Autor:
OA Dr. Thomas Hörtenhuber
Universitätsklinik für Kinder- & Jugendheilkunde, Johannes Kepler Universität, Linz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lange Zeit galt der juvenile Diabetes mellitus Typ-2 (jT2DM) als eine benigne Variante des Diabetes mellitus im Kindes- und Jugendalter. Neuere Auswertungen großer Studien zeigen jedoch bereits nach kurzer Erkrankungsdauer desaströse Zahlen betreffend Mortalität und Morbidität, wenn diese jungen Patient*innen zurückhaltend medikamentös behandelt werden. Die medikamentöse Therapie rückt damit definitiv in den Vordergrund und es gibt im Jugendbereich endlich neue Therapieoptionen, die bisher erst ab dem 18. Lebensjahr zugelassen waren.
Keypoints
-
Der juvenile Typ-2-Diabetes stellt eine kardiovaskuläre Hochrisikoerkrankung dar.
-
Eine medikamentöse Therapie mittels Metformin gilt als Basistherapie und sollte bei Diagnosestellung zeitgleich mit Lebensstilmodifikationen begonnen werden.
-
Ergänzend sollte bei Diagnose immer auch ein Typ-1- Diabetes ausgeschlossen werden.
-
Der GLP-1-Agonist Liraglutid ist eine neue, offiziell zugelassene Therapiemöglichkeit bei Jugendlichen über 12 Jahre und sollte als Therapieeskalation nach Metformin eingesetzt werden.
jT2DM: kardiovaskuläre Hochrisikoerkrankung
In den letzten Jahren zeigten die Ergebnisse mehrerer Beobachtungsstudien, dass Patient*innen mit juvenilem Beginn eines T2D im Vergleich zu jenen mit Typ-1-Diabetes (T1D) eine deutlich erhöhte Mortalität und Morbidität aufweisen. So konnte eine 6-fach erhöhte Mortalitätsrate („standardized mortality rate“) bei Menschen festgestellt werden, die im Alter zwischen 15 und 30 Jahren an T2D erkranken.1 Das Risiko für das Auftreten schwerer mikrovaskulärer Komplikationen ist bei dem Kollektiv der Jugendlichen mit T2D am stärksten ausgeprägt. In der TODAY-Studie betrifft dies knapp 60% der Patient*innen mit einer durchschnittlichen Erkrankungsdauer von 13 Jahren.2
Vergleicht man diese Patient*innen mit Jugendlichen mit T1D, zeigt sich für mikrovaskuläre Komplikationen im Sinne einer Mikroalbuminurie eine vergleichsweise niedrigere Inzidenz von rund 25% nach 10 Jahren Erkrankungsdauer. Bei Erwachsenen mit T2D sind es in der UKPDS-Studie nach 10 Jahren ebenfalls rund 25%, welche von einer Form der diabetischen Nephropathie betroffen sind.3
Deutlich erhöht zeigt sich auch das Auftreten von schweren Komplikation (Dialysepflichtigkeit, Amputation, Erblindung) bei Menschen mit jT2DM. Es betrifft rund ein Drittel der Patienten nach 15 Jahren Erkrankungsdauer und etwa die Hälfte nach 20 Jahren.
Therapie des jT2DM
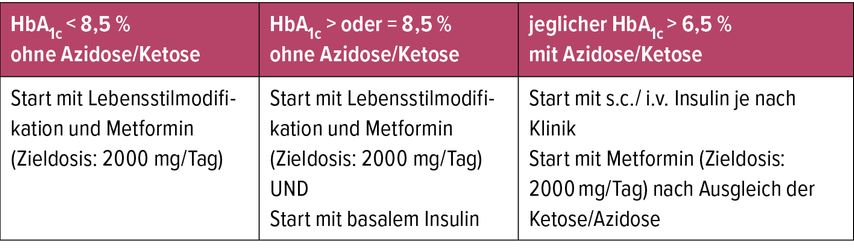
Aufgrund der im Vergleich zu älteren Erwachsenen deutlich schnelleren Progredienz der Erkrankung und des schnelleren Verlusts der Insulinsekretion bzw. der stärkeren Insulinresistenz ist ein rascher bzw. unmittelbarer Beginn einer Therapie notwendig. Die initiale Behandlung sollte von der klinischen Symptomatik, dem Schweregrad der Hyperglykämie bzw. dem Bestehen einer Ketose/Ketoazidose abhängig gemacht werden. Als Ziel für die metabolische Einstellung werden auch beim T2D HbA1c-Werte ≤7,0% (IFCC ≤53mmol/mol), wenn möglich um die 6,5% (IFCC ≤48mmol/mol), angestrebt. Für die Therapie gelten aktuell die Leitlinien der International Society of for Pediatric and Adolescent Diabetes (ISPAD) 20224 und der American Diabetes Association (ADA) 2020.5
Nichtmedikamentöse Therapie
Lebensstilmodifikation im Sinne einer Reduktion der Kalorienzufuhr sowie einer Erhöhung der körperlichen Aktivität sind auch beim jT2DM die Basistherapie.4 Allerdings konnte bereits gezeigt werden, dass bei Jugendlichen mit T2D ein 3-monatiges körperliches Training keinen Einfluss auf die Betazellfunktion oder Insulinresistenz hat,6 daraus resultiert wohl die schon erwähnte rasche Progredienz des jT2DM.
Medikamentöse Therapie
Metformin
Analog zu den Empfehlungen für Erwachsene ist Metformin auch die Basistherapie des jT2DM und soll unmittelbar bei Diagnosestellung – zeitgleich mit jeder Lebensstilmodifikation – gestartet und bei guter Toleranz auf die maximale Tagesdosis (MTD) von 2000mg aufdosiert werden.7 Zusätzlich zur Verbesserung der glykämischen Kontrolle kann bei Jugendlichen mit gestörter Glukosetoleranz sogar eine Reduktion des Körpergewichts erreicht werden.7
Insulin
Insulin stellt auch beim jT2DM sowohl bei Therapieversagen als auch bei initial schlechter metabolischer Kontrolle (HbA1c >8,5%) bzw. symptomatischer Hyperglykämie bzw. Ketose/Ketoazidose die Therapie der Wahl dar.4 Meist wird in Form einer basal unterstützenden Therapie mit einem lang wirksamen Analogon begonnen und bei Bedarf bis zu einem vollen funktionellen Schema eskaliert. Die TODAY-Studie zeigt allerdings, dass die therapeutischen Effekte von Insulin im jT2DM begrenzt sind: Ein Jahr nach Therapiestart zeigt rund ein Drittel der Patient*innen eine Verbesserung (=HbA1c -0,5%), bei 45% gibt es keine Veränderung und bei 20% sogar eine Verschlechterung der metabolischen Situation.8
Liraglutid
Als neueste Option ist Liraglutid seit 2019 für Kinder und Jugendliche ab dem 10. Lebensjahr für die Therapie des T2D zugelassen. Es wird analog zur Anwendung bei Erwachsenen initial einmal täglich mit 0,6mg/Tag s.c. gestartet und wöchentlich bis zur MTD von 1,8mg/Tag s.c. gesteigert.4 In den bisher publizierten Daten ergeben sich sowohl Effekte auf die glykämische Kontrolle als auch auf die Gewichtsreduktion. In der ersten Publikation zu Liraglutid bei Kindern und Jugendlichen konnte eine signifikante HbA1c-Senkung von durchschnittlich 1,3% nach 52 Wochen Therapie beschrieben werden.9 Im Gegensatz zu den Ergebnissen in der adulten Population war der erwartete zusätzliche Gewichtsverlust erst nach Woche 26 signifikant. Für Liraglutid konnte dann eine durchschnittliche Reduktion des BMI-Z-Score von 0,34 nach 52 Wochen gezeigt werden.
Zukünftige Therapieoptionen
Neben den genannten Optionen liegen rezente Studiendaten bei Jugendlichen vor, allerdings aktuell noch ohne Zulassung durch EMA (European Medical Agency) oder FDA (Food and Drug Administration).
Dulaglutid
Das einmal wöchentlich applizierte Dulaglutid ergab eine signifikante HbA1c- Senkung um durchschnittlich rund 15% im Vergleich zu Placebo (–1,4 vs. +0,6%).10 Auffällig war auch in dieser Studie das Ergebnis betreffend die BMI-Reduktion, so konnte in dieser Kohorte keinerlei signifikante Veränderung gegenüber Placebo erreicht werden, erneut deutlich im Kontrast zu den Studiendaten bei erwachsenen Patient*innen. Die Ursachen hierfür sind aktuell unklar.
Semaglutid
Für das lang wirksame Semaglutid wurden 2022 von Weghuber et al. die ersten Daten publiziert. Hier muss allerdings einschränkend gesagt werden, dass eine gemischte Kohorte von generell adipösen Patienten untersucht wurde, in der nur 8 der gesamt 201 Patienten die Diagnose eines T2D hatten.11 Es zeigte sich hier allerdings im Gegensatz zu den zwei zuvor diskutierten Studien bzw. Wirkstoffen ein deutlich signifikanter Effekt betreffend den Gewichtsverlust. Durchschnittlich konnten die Patienten ihren BMI um mehr als 16% reduzieren (Veränderung: −16,1 vs. +0,6%) und 73% der Patienten hatten zumindest eine Reduktion von 5%. Entsprechend dem Studiendesign in einer hauptsächlich adipösen, nicht diabetischen Kohorte erreichten die HbA1c-Veränderungen keinerlei Signifikanz (−0,4 vs. −0,1%).
Weitere neue Substanzklassen
Neben den GLP-1-Rezeptoragonisten (GLP-1-RA) liegen nun auch Daten für andere moderne Substanzklassen (SGLT2/Empagliflozin und DPP-4-Hemmer/Sitagliptin) vor. Beide Substanzen wurden in einer relativ komplex gestalteten einseitigen Cross-over-Studie untersucht. Das aufwendige Design ist laut den Autoren der Problematik der bekannt schwierigen Rekrutierung bei pharmazeutischen Studien in diesem speziellen Krankheitskollektiv geschuldet.
SGLT2-Inhibitoren: Empagliflozin
Daten der DINAMO-Studie zeigen nun auch erstmalig den Effekt von Empagliflozin vs. Placebo bei Jugendlichen mit T2D:12Es lässt sich eine signifikante Reduktion des HbA1c um 0,17% unter Empagliflozin vs. eine Erhöhung um 0,68% unter Placebo nach 26 Wochen Therapie gegenüber dem Ausgangswert nachweisen. Dieser Effekt scheint sich auch über 52 Wochen fortzusetzen. Hinsichtlich der bekannten protektiven Effekte einer Therapie mit SGLT2-Inhibitoren liegen naturgemäß noch keine Daten aus dem jugendlichen Kollektiv vor.
DPP-4-Inhibitoren: Sitagliptin
In der gleichen Publikation der DINAMO-Studie wurde in der zweiten Interventionsgruppe der DPP-4-Hemmer Sitagliptin eingesetzt, allerdings ohne nennenswerte Effekte auf die glykämische Kontrolle der Patienten. Der HbA1c zeigte keine signifikante Reduktion gegenüber der Placebogruppe nach 26 Wochen Intervention (0,33% vs. 0,68%).
Aktuelle Therapieempfehlungen der ISPAD für die Praxis
Die klinisch praktischen Konsensusleitlinien der ISPAD zu Typ-2-Diabetes bei Kinder geben eine Übersicht über Therapieempfehlungen bei Diagnosestellung und nach erfolgter Diabetesdiagnose (Tab.1 u. 2).4 Bei jedem Kind/Jugendlichen mit T2D sollten auch die Diabetes-spezifischen Antikörper bestimmt werdenund eine Reevaluation der Diagnose sollte nach 8–12 Wochen erfolgen. Sollten die Diabetes-spezifischen Antikörper positiv ausfallen, sind ein sofortiger Wechsel auf eine funktionelle Insulintherapie, eine Evaluierung und das Ausschleichen der Metformintherapie zu veranlassen.
Zusammenfassung
Praxistipp
Bei Diagnose eines juvenilen T2D sollten ergänzend immer auch die Typ-1-Diabestes-spezifischen Antikörper gemessen werden.Aktuell existieren mit Metformin, Insulin und Liraglutid drei zugelassene medikamentöse Therapieoptionen beim jT2DM.
Mit der pädiatrischen Zulassung lang wirksamer GLP-1-RA ist in der nächsten Zeit zu rechnen. Analog ist auch eine Zulassung von SGLT2-Hemmern absehbar, welche vor allem hinsichtlich ihrer potenziellen kardiorenalen und vaskulären Protektion in der Hochrisikogruppe des jT2DM sehr interessant scheinen. Ohne Zulassung kann allerdings im Moment der Einsatz nicht empfohlen werden.
Zudem konnten mehrere Studien deutliche Unterschiede im Therapieansprechen von Jugendlichen im Vergleich zu Erwachsenen mit T2D zeigen. Damit wird neuerlich unterstrichen, dass eine Extrapolation von Studienergebnissen bzw. Erfahrungswerten in adulten Kollektiven auf Patient*innen mit jT2DM nicht zulässig ist.
Literatur:
1 Al-Saeed AH et al.: An inverse relationship between age of type 2 diabetes onset and complication risk and mortality: The impact of youth-onset type 2 diabetes. Diabetes Care 2016; 39(5): 823-9 2 Pambianco G et al.: The 30-year natural history of type 1 diabetes complications: The Pittsburgh epidemiology of diabetes complications study experience. Diabetes 2006; 55(5): 1463-9 3 Adler AI et al.: Development and progression of nephropathy in type 2 diabetes: The United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int 2003; 63(1): 225-32 4 Shah AS et al.: ISPAD clinical practice consensus guidelines 2022: Type 2 diabetes in children and adolescents. Pediatr Diabetes 2022; 23(7): 872-902 5 American Diabetes Association: 13. Children and adolescents: Standards of medical care in diabetes-2020. Diabetes Care 2020; 43(1): 163-82 6 Burn N et. al.: Early-onset type 2 diabetes in obese white subjects is characterised by a marked defect in beta cell insulin secretion, severe insulin resistance and a lack of response to aerobic exercise training. Diabetologia 2007; 50(7): 1500-8 7 Kendall D et al.: Metformin in obese children and adolescents: The MOCA trial. J Clin Endocrinol Metab 2013; 98(1): 322-9 8 Bacha F et al.: Progressive deterioration of β-cell function in obese youth with type 2 diabetes. Pediatr Diabetes 2013; 14(2): 106-11 9 Tamborlane WV et al.: Liraglutide in children and adolescents with type 2 diabetes. N Engl J Med 2019; 381(7): 637-46 10 Arslanian SA, Cox D: Once-weekly Dulaglutide for treatment of youths with type 2 diabetes. Reply. N Engl J Med 2022; 387(16): 1530-1 11 Weghuber D.: Once-weekly Semaglutide in adolescents with obesity. N Engl J Med 2022; 387(24): 2245-57 12 Laffel LM et al.: Efficacy and safety of the SGLT2 inhibitor Empagliflozin versus Placebo and the DPP-4 inhibitor Linagliptin versus placebo in young people with type 2 diabetes (DINAMO): A multicentre, randomised, double-blind, parallel group, phase 3 trial. Lancet Diabetes Endocrinol 2023; 11(3): 169-81
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...