Rückblicke: Meilensteine in der Diabetestechnologie
Autorin:
OÄ Dr. Ingrid Schütz-Fuhrmann
3. Medizinische Abteilung für Endokrinologie, Stoffwechselerkrankungen & Nephrologie
Karl Landsteiner Institut für Endokrinologie & Stoffwechselerkrankungen,
Klinik Hietzing, Wien
Lag der Effekt der Diabetestechnologie lange Jahre in der Hand der jeweiligen betroffenen Menschen, so haben Digitalisierung und Automatisierung nun dazu geführt, die Verantwortung für Kontrolle und Therapie mit Maschinen zu teilen.
Betrachtungen aus dem Blickwinkel der Post-Pionierära
Die erste Gruppe von Kindern mit Typ-1-Diabetes wurde in Wien erfolgreich durch tägliche mehrfache Injektionen mit kurzwirksamem Insulin behandelt. Diese Kinder wurdenin den frühen 1920er-Jahren 8 bis 12 Monate stationär aufgenommen und erhielten umfangreiche Schulungenzu Diät, Insulinapplikation, Glukosemessung im Harn und Lebensstilmodifikation. Es zeigte sich, dass diese Kinder eine bessere Prognose für mikrovaskuläre Komplikationen als die Vergleichsgruppe haben.1,2 Insulin gilt seither als Meilenstein, der das Leben für Menschen mit Typ-1-Diabetes ermöglicht hat.Zweiter Meilenstein ist derStandard der funktionellen Insulintherapie, der die physiologische Insulinsubstitution gewährleisten soll und damit Spätschäden besser verhindern kann(Abb.1).
Wo kann hier die Diabetestechnologie eingeordnet werden? Bis vor Kurzem lag die Stoffwechselwirkung der Insulintherapie in der Hand des jeweiligen betroffenen Menschen. Erst jetzt gelang es, durch die zunehmende Digitalisierung und Automatisierung dieTherapieverantwortung der Betroffenen deutlich zu verringern. Dies ist wohl der bedeutendste Meilenstein in der Geschichte der Diabetestechnologie.
Über Glasspritzen und dicke Nadeln zur Pen-Entwicklung
Anfang bis Mitte der 1980er-Jahre kehrten engagierte Ärzte und Menschen mit Diabetes zu den Ursprüngen der Diabetestherapie zurück. Kurzwirksames Insulin wurde wieder zum Essen eingesetzt und somit konnte die Therapie flexibler erfolgen. Zu diesem Zeitpunkt kamen Insulinpens, mechanische Spritzhilfen auf den Markt und ersetzten die in den 1960er- Jahren verwendeten Einwegplastikspritzen, die wiederum die Glasspritze, welche mindestens zweimal die Woche komplett zerlegt und ausgekocht werden musste, ersetzten. Der MADI-Pen („models of new insulin pen“), entwickelt von Prof. Chlup in der ehemaligen CSSR (Tschechoslowakische Republik), wurde 1983, kurz vor dem NovoPen®, zum Patent angemeldet.3 Pens dienten als Erleichterung und als Gewährleistung, dass komplexe Insulinstrategien umgesetzt werden konnten. Die Entwicklungen gingen so weit, dass heute „smart-pens“ eine Memoryfunktion beinhalten und die Insulindosis direkt in Apps am Smartphone übertragen werden kann, sodass kein Papiertagebuch mehr geführt werden muss.
Abb. 1: Diabetesmanagement in den 20er-Jahren: erste Gruppe an Kindern in Wien, behandelt mit Insulin durch Priesel und Wagner 1922. (bearbeitet von Peterson CM)
Insulin überbringen – wie und auf welchem Weg?
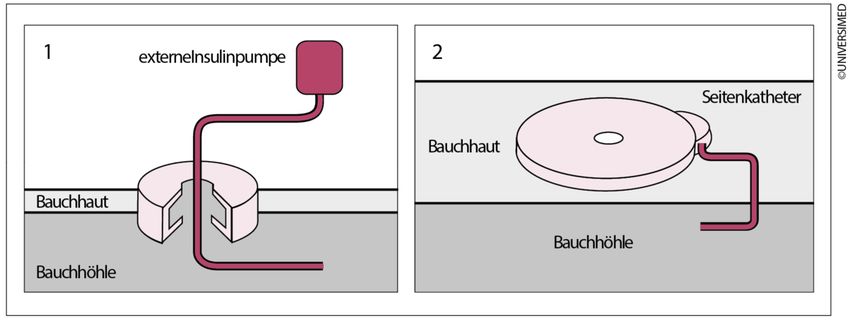
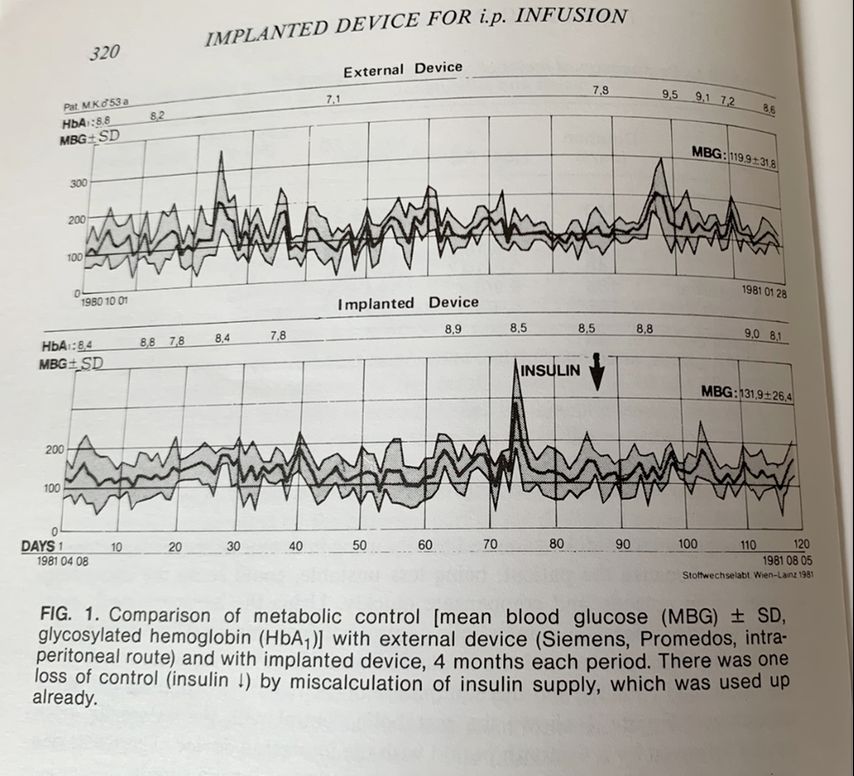
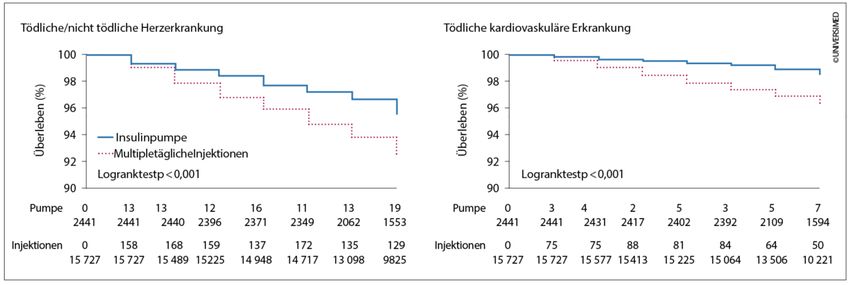
Trotz funktioneller Insulintherapie, gekennzeichnet durch Mehrfachinjektionen, war der Stoffwechsel für manche Menschen mit Diabetes nur schwer kontrollierbar. Für sie wurden Anstrengungen unternommen, Geräte zur kontinuierlichen Insulininfusion zu entwickeln. Grundlage dafür waren die aus den Krankenhäusern bekannten Spritzenautomaten, welche verkleinert und elektronisch verfeinert wurden. 1985 lag die Akkulaufzeit eines solchen Gerätes bei maximal 4 Stunden und die Basalrate lediglich in der Hand der Ärzte. Parallel dazu wurde der optimale Weg für das Insulin gesucht. Intraperitoneale als auch intravenöse Applikationsformen wurden erforscht, konnten sich aber aufgrund der Komplikationen nicht durchsetzen. So standen für die kontinuierliche intraperitonealeInsulininfusion zwei Systeme zur Verfügung – implantierbare Pumpen oder ein Port-System mit Anschluss an eine extern verbliebene Insulinpumpe (Abb.2).Der Hintergrund war die Überlegung, dass Insulin über das viszerale Peritoneum rasch resorbiert wird, direkt in den Portalkreislauf gelangt und zu einer direkten Insulinisierung der Leber führt. Dort wird etwa 50% des Insulins während der ersten Passage extrahiert, sodass nur das verbleibende Insulin in die periphere Blutzirkulation gelangt und somit der physiologischen Insulinwirkung am nächsten kommt(Abb.3).4 Die chirurgische Implantation einer Pumpe war grundsätzlich nicht schwierig, war aber gekennzeichnet durch Nachoperationen und Katheterobstruktionen, welche nur aufwendig zu beheben waren. Das Portsystem dagegen, welches noch bis vor Kurzem erhältlich war, zeichnete sich trotz Materialverbesserungen vor allem durch Infektionen und nicht beherrschbare, abdominelle Schmerzen aus. Letztendlich laufen Insulinpumpen heute weiter subkutan. Als Meilenstein in der Evidenz zur Insulinpumpe ist eine Arbeit von Steineck et al. von 2015 zu sehen, die mithilfe der schwedischen Registerdaten zeigte, dass die Insulinpumpentherapie im Vergleich zur funktionellen Insulintherapie mit Pen mit einer 45%igen Reduktion des Risikosfür Herzinfarkteassoziiert ist. Tödliche kardiovaskuläre Erkrankungen waren um 42% und die Gesamtmortalität um 27% reduziert (Abb.4).5
Der Weg ist das Ziel – von der Blutzuckermessung zur kontinuierlichen Glukosemessung
Letztendlich kann eine physiologische Insulinsubstitution nur auf Basis von gemessenen Glukosewerten umgesetzt werden.Blutzuckermessen mit einem Teststreifen etabliert sich ab Mitte der 1980er-Jahre. Die Geräte benötigten anfangs oftmals noch 220 Volt und die Auswertung dauerte zwei Minuten. Die erforderliche Menge an Blut pro Messunghat sich bis heute auf etwa 0,0005ml verringert und die Messergebnisse liegen in wenigen Sekunden vor. Dennoch sind die Fingerstiche, die zur Blutgewinnung notwendig sind, schmerzhaft und daher wurde seit den 1990er-Jahren nach Alternativen gesucht. Als man herausfand, dass der Zuckerwert im Unterhautfettgewebe gut mit dem Blutzucker übereinstimmt, kam als Alternative zum Fingerstich das erste praktikable CGM-(k[c]ontinuierliche Glukose-Messung)-Gerät 1999 mit dem Minimed Guardian RTauf den Markt.6,7Eine nächste Möglichkeit bestand im Jahre 2001 in der US-amerikanischen GlucoWatch 2. Der aufgeklebte Sensor (sein Vorteil liegt im unblutigen Gebrauch) wurde allerdings von heftigen Hautausschlägen begleitet. Leider ebenfalls nur unzuverlässig hat die Pendra, ähnlich einer Armbanduhr, 2004 die Erwartungen erfüllt. Durchgesetzt hat sich die minimalinvasive, interstitielle Glukosemessung, die über die Jahre die Performance soweit verbessert hat, dass der Traum von Closed-Loop-Systemen realisiert werden konnte. Als Meilenstein in der Evidenz gilt hierfür die 2010 publizierte JDRF-CGM-Studie, die nachwies, dassHbA1c und Hypoglykämien signifikant reduziert werden können, wenn CGM-Geräte ordnungsgemäß getragen werden.8
Closed-Loop-Systeme auf dem Weg zur Alltagstauglichkeit
Bei komplexeren, automatisierten Insulinpumpen/CGM-Systemen, auch als „künstliche Bauchspeicheldrüse“, Hybrid-Closed-Loop-Systeme (HCL) oder „Automated insulin delivery“(AID)-Systeme bezeichnet, reguliert ein Algorithmus alle paar Minuten automatisch die Insulinzufuhr über die Pumpe unter Berücksichtigung der aktuellen und vergangenen sensorgenerierten Glukoseverläufe. 2017 wurde das erste kommerzielle HCL-Produkt, das Medtronic 670G System von der FDA (Food and Drug Administration) für den amerikanischen Markt zugelassen. Mittlerweile sind neben der Weiterentwicklung des 670-Systems drei weitere kommerzielle Systeme am Markt. Ausdruck der Emanzipation von Menschen mit Diabetes ist dabei auch, dass sie als Teil der Open-Source-Bewegung diese Systeme und Algorithmen noch vor der kommerziellen Verfügbarkeit nutzten.
Abb. 4: Kaplan-Meier-Überlebenskurve von 18168 Menschen mit Typ-1-Diabetes nach Therapie mit Insulinpumpen oder multiplen täglichen Injektionen (adaptiert nach Steineck I et al. 2015)5
Therapieziele werden auf Technologie ausgerichtet
Eine wichtige Untersuchungsmethode der Labordiagnostik sollte nicht unerwähnt bleiben: die Bestimmung des Langzeitzuckers (HbA1c), der seit den 1980er- Jahren ermittelt wird. Der etablierten Messgröße HbA1c liegt ein Glukose-Mittelwert über zwei bis drei Monate zugrunde und sie gilt als gutes Maß für die Hyperglykämie, nicht jedoch für Hypoglykämien und Glukoseschwankungen. Letztere werden in Analogie zur Hyperglykämie ursächlich für mikrovaskuläre Spätkomplikationen gesehen. Durch die immer weitere Verbreitung von CGM-Systemen sowohl bei Benutzern von Pumpen als auch bei Benutzern von Pens, stehen deutlich mehr Daten zur Verfügung als bei der herkömmlichen, kapillären Blutzuckermessung. Der Begriff „time in range“ (TIR = Zeit im Zielbereich), d.h. der Prozentsatz an Zeit mit Sensorglukosewerten im Bereich zwischen 70 und 180mg/dl, hat in den letzten Jahren zunehmend an Bedeutung gewonnen und ist zu einer neuen Messgröße zusätzlich zum HbA1c geworden. Als Meilenstein in der Evidenz für die TIR gilt der ATTD Consensus Bericht von 2019.9
Literatur:
1 Korp W et al.: 50 years of insulin treatment at Vienna’s children clinic-fate of diabetic children from the first insulin era. Wien Klin Wschr 1973; 85(21): 385-902Irsigler K, Kritz H: Improvement of insulin therapy for diabetics through pump treatment. In: Diabetes management in the 80‘s. The role of home blood glucose monitoring an new insulin delivery systems. (Hrsg. Peterson CM) California: Praeger Verlag 1982 3 Diabetesmuseum Deutschland: Spritzenhilfe. https://diabetesmuseum.de/spritzhilfe; zuletzt aufgerufen am 2.8.2022 4 Brunetti P et al.: Artificial systems for insulin delivery. New York: Raven Press. 1983, 320 5 Steineck I et al.: Insulin pump therapy, multiple daily injections, and cardiovascular mortality in 18.168 people with type 1 diabetes: observational study. BMJ 2015; 350:h3234, 2015 6 Olczuk D et al.: A history of continuous glucose monitors (CGMs) in self-monitoring of diabetes mellitus. Diabetes Metab Syndr 2018; 12(2): 181-7 7 Pickup J et al.: Banting memorial lecture 2014 technology and diabetes care: appropriate and personalized. Diabet Med 2014; 32(1); 3-13 8 Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group: Effectiveness of continuous glucose monitoring in a clinical care environment: evidence from the Juvenile Diabetes Research Foundation continuous glucose monitoring (JDRF-CGM) trial.Diabetes Care 2010; 33(1): 17-22 9 Battelino T et al.: Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on Time in Range.Diabetes Care 2019; 42(8): 1593-1603
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...