Pankreatitis, Pankreaskarzinom und Inkretine – was ist dran?
Bericht:
Reno Barth
Geprüft und kommentiert von:
Prim. Univ.-Prof. Dr. Peter Fasching
5. Medizinische Abteilung mit Endokrinologie, Rheumatologie und Akutgeriatrie
Klinik Ottakring, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bald nach der Entwicklung der Inkretintherapie trat die Frage auf, ob diese unerwünschte Auswirkungen auf das Pankreas hat. Ein wichtiger Punkt für den Einsatz der Therapie im Alltag. Hier eine Antwort.
Keypoints
-
Unter einer DPP-4-Inhibitortherapie erhöht sich das Risiko für das Auftreten einer akuten Pankreatitis vs. Placebo nur im Promillebereich.
-
Für GLP-1-Rezeptoragonisten zeigt sich kein Effekt auf das Pankreatitisrisiko.
-
Weder für DPP-4-Inhibitoren noch für GLP-1-Rezeptoragonisten wurde eine Erhöhung des Risikos für Pankreaskarzinom gefunden.
-
Aus heutiger Sicht kann im Hinblick auf pankreatische Komplikationen einer Inkretintherapie Entwarnung gegeben werden.
-
Gallensteine dürften etwa für die Hälfte der akuten Pankreaserkrankungen unter GLP-1-Rezeptoragonisten verantwortlich sein.
-
Eine Gallensteinerkrankung stellt aber keine relative oder sogar absolute Kontraindikation für diese Therapie dar.
Diabetestherapie auf Inkretinbasis
Das Glucagon-like Peptid 1 (GLP-1) wird in den neuroendokrinen L-Zellen von Ileum und Kolon produziert und spielt eine wichtige Rolle in der Steuerung des Glukosestoffwechsels. Es stimuliert unter anderem die glukoseabhängige Insulinsekretion, senkt den Glukagonspiegel, verzögert die Magenentleerung und reduziert den Appetit. Damit bietet sich der Einsatz von GLP-1 in der Therapie des Typ-2-Diabetes an. Mit humanem GLP-1 kann dies jedoch nicht realisiert werden, da dieses innerhalb weniger Minuten durch die Dipeptidylpeptidase 4 (DPP-4) abgebaut wird. Das Problem wurde durch die Entwicklung von nicht durch DPP-4 spaltbaren GLP-1-Rezeptoragonisten (GLP-1-RA) bzw. durch die medikamentöse Inhibition von DPP-4 (Gliptin-Präparate) umgangen. Letzteres führt zu einer verlängerten Verfügbarkeit des physiologischen GLP-1.
Als GLP-1-RA kamen zunächst tierische Moleküle wie das aus dem Speichel der Wüstenechse Gila-Monster isolierte Exendin-4 (Handelsname Byetta®) zum Einsatz. Später kamen auf humanem GLP-1 basierende synthetische Moleküle hinzu, die durch Verknüpfung mit einer langkettigen Fettsäure vor dem raschen Abbau durch DPP-4 geschützt waren (z.B. Liraglutid; Victoza®). Als DPP-4-Inhibitoren (DP-4-I) wurden Sitagliptin, Vildagliptin, Saxagliptin, Alogliptin und Linagliptin in Österreich zugelassen.
Neben den antidiabetischen Effekten ist auch die Wirksamkeit der GLP-1-RA zur Gewichtsreduktion interessant. Die subkutan verabreichten GLP-1-RA zeichnen sich im Vergleich zu den oralen DPP-4-I durch einen deutlich stärkeren Effekt aus. Während DPP-4-I die Plasmakonzentrationen des zirkulierenden humanen GLP-1-Hormons auf das 2- bis 4-Fache erhöhen, entspricht die Wirkung der GLP-1-RA etwa dem 5- bis 10-Fachen des physiologischen Nüchternspiegels des humanen GLP-1. Dies korrespondiert mit einem vergleichsweise stärkeren Effekt der GLP-1-RA auf die glykämische Kontrolle.
Diskussion um Pankreatitisrisiko
Während sowohl GLP-1-RA als auch DPP-4-I in der Regel gut vertragen werden, wurden bereits früh nach der Markteinführung der ersten Medikamente dieser Substanzgruppen Sicherheitsbedenken betreffend mögliche unerwünschte Wirkungen auf das Pankreas laut. Im Mausmodell hatte die Arbeitsgruppe des renommierten Pankreasforschers Peter C. Butler Hinweise auf eine Steigerung der Zahl exokriner Pankreasdysplasien und auch Glukagon produzierender endokriner Tumoren gefunden.1 Dies konnte in humanen Pankreaspräparaten bestätigt werden.2 In einem Kommentar in Diabetologia aus dem Jahr 2009 hielt Butler jedoch fest, dass es zur Frage der Pankreatitis unter Inkretin-basierten Therapien zum damals aktuellen Zeitpunkt mehr Fragen als Antworten gebe.3
In den vergangenen Jahren konnte der Evidenzstand zur Verträglichkeit der Inkretin-Therapien erheblich erhöht werden. Wesentlich dazu beigetragen haben die großen kardiovaskulären Outcome-Studien (CVOT), die von den Zulassungsbehörden für neue Diabetesmedikamente verlangt werden und die eine Beobachtung großer Patientenkollektive über einen langen Zeitraum vorsehen.
Dabei gaben die ersten kardiovaskulären Outcome-Studien SAVOR-TIMI 53 mit Saxagliptin, EXAMINE mit Alogliptin und TECOS mit Sitagliptin keine Entwarnung hinsichtlich der Pankreasfrage. Eine kombinierte Analyse dieser drei großen interventionellen Studien mit insgesamt 18238 mit Gliptin behandelten Patienten und 18157 Patienten unter Placebo zeigte unter Gliptinen im Vergleich zu Placebo ein signifikant gehäuftes Auftreten von akuter Pankreatitis mit einer Erhöhung des relativen Risikos (RR) um fast 80% und einer Odds-Ratio (OR) von 1,79 (95% CI: 1,13–2,82; p=0,013). Allerdings war akute Pankreatitis in diesen Studien selten, woraus sich ein Anstieg des absoluten Risikos um lediglich 0,13% bzw. eine „number needed to harm“ von etwa 770 Personen ergibt.4
Keine verbindliche Definition der akuten Pankreatitis
Eine Schwäche dieser Daten liegt in der unscharfen bzw. fehlenden Definition der „akuten Pankreatitis“. Unter GLP-1-basierter Therapie kann es zu einem Anstieg der zirkulierenden Lipase und Amylase ohne klinische Zeichen einer Pankreatitis kommen. Es ist daher fraglich, ob eine isolierte, nach Absetzen der Inkretintherapie zumeist reversible Erhöhung der zirkulierenden Pankreasenzyme im Serum tatsächlich die Diagnose einer akuten Pankreatitis rechtfertigt.
Interessant sind die gepoolten Daten aus dem klinischen Entwicklungsprogramm „Scale“ mit Liraglutid. Diese haben bei Teilnehmern mit Übergewicht, Adipositas und Normoglykämie, Prädiabetes oder Typ-2-Diabetes unter Liraglutid einen dosisunabhängigen reversiblen Anstieg der Amylase- bzw. Lipaseaktivität im Serum gezeigt. Dieser war jedoch kein Prädiktor einer akuten Pankreatitis und stand auch in keinem Bezug zu den Basischarakteristika der Patienten. In diesem Kollektiv trugen Gallensteinerkrankungen erheblich zum Auftreten einer akuten Pankreatitis bei. Die Studienautoren gelangen zu dem Schluss, dass ein Monitoring von Amylase und Lipase unter GLP-1-RA-Therapie routinemäßig nicht erforderlich ist, solange keine klinischen Symptome einer akuten Pankreaserkrankung vorliegen oder vermutet werden.5 Andererseits spekuliert Butler in seinem Kommentar von 2010,2 dass eine asymptomatische, chronische Low-Grade-Pankreatitis langfristig das Risiko erhöhen könnte, an einem Adenokarzinom des Pankreas zu erkranken. Glücklicherweise liefern die klinischen Daten keine Hinweise auf eine erhöhte Karzinominzidenz.
Unterschiedliche Studien, unterschiedliche Ergebnisse
Hinsichtlich der Pankreatitis zeigen die Daten bis heute kein vollständig klares Bild. In einer Metaanalyse, die randomisierte Studien mit DPP-4-I auswertete, die bis 30. 9. 2019 publiziert worden waren, zeigte sich kein erhöhtes Risiko für Pankreatitis OR: 1,13 (95% CI: 0,86–1,47), oder Pankreaskarzinom OR: 0,86 (95% CI: 0,60–1,24). In den 165 analysierten Studien wurden zusätzlich zu den oben genannten weitere 7 Moleküle, darunter Linagliptin, untersucht. Die Arbeit zeigte im Hinblick auf die pankreatische Sicherheit keine relevanten Unterschiede zwischen den einzelnen Molekülen dieser Substanzklasse.6
Eine weitere Metaanalyse von Daten bis zum Sommer 2019 aus elf CVOT mit einer Dauer von über 12 Monaten und über 100000 eingeschlossenen Patienten fand hingegen ein signifikant gehäuftes Auftreten von Pankreatitis mit einer OR von 1,81 (p=0,04) bzw. einer OR von 1,54 (p=0,02) für Patienten unter einer Gliptintherapie versus Placebo oder einen aktiven Komparator.7
Eine weitere Arbeit zeigt ebenfalls ein signifikant erhöhtes Risiko für Pankreatitis unter Gliptintherapie, wobei die Signifikanz nur in der Metaanalyse auftrat, aber in keiner der Einzelstudien.Auch zu dieser Metaanalyse war trotz einer Erhöhung des RR von 75% die absolute Erhöhung des Risikos mit deutlich unter 1% gering. In dieser Analyse wurden auch Studien zu GLP-1-RA ausgewertet. Für diese wurde jedoch im Gegensatz zu DPP-4-Inhibitoren weder in den einzelnen Arbeiten noch in einer Metaanalyse eine Erhöhung des Pankreatitisrisikos gefunden (RR: 1,05 [0,78–1,41]). Das Risiko für das Auftreten eines Pankreaskarzinoms oder anderer maligner Neoplasien war weder unter GLP-1-RA noch unter DPP4-I erhöht.8 Auch in einer Metaanalyse von 7 CVOT mit GLP-1-RA versus Placebo6 wurde kein erhöhtes Risiko für eine akute Pankreatitis gefunden, OR: 1,05 (95% CI: 0,77–1,42; p =0,77).
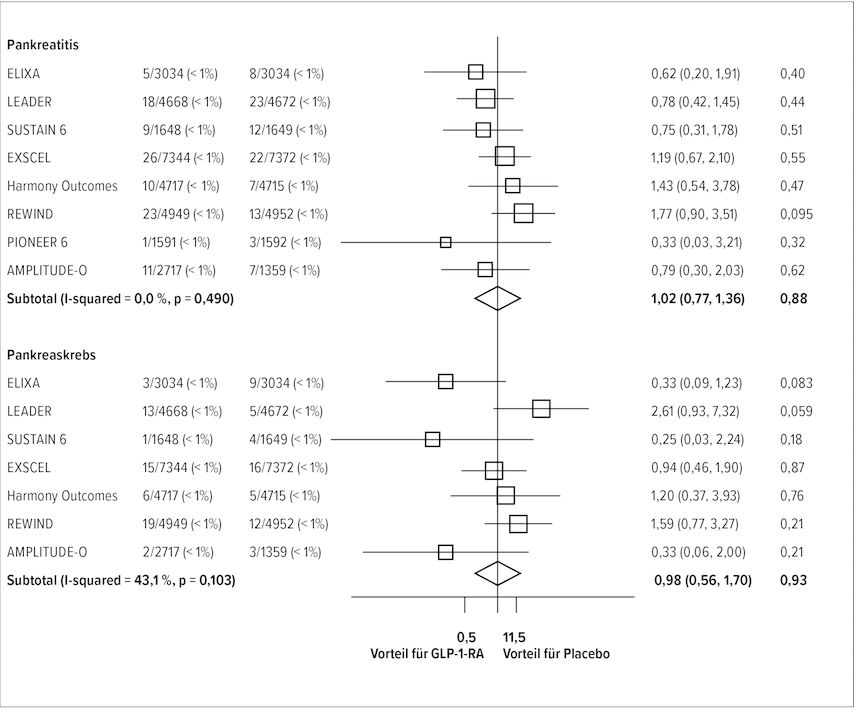
Die neueste Metaanalyse zu dieser Fragestellung wurde am 20. 8. 2021 publiziert und zeigt für die prospektiven randomisierten Studien mit GLP-1-RA im Vergleich zu Placebo ein kumuliertes Pankreatitisrisiko von 1,02 (95% CI: 0,77–1,36; p=0,88) sowie ein Risiko für Pankreaskarzinom von 0,98 (95% CI: 0,56–1,70; p=0,93) (Abb. 1).9
Abb. 1: Metaanalyse zu Pankreatitis und Pankreaskrebs bezüglich GLP-1-Inhibitoren (nach Sattar N et al.)9
Resümee
Insgesamt zeigen die Daten eine signifikante Erhöhung des Risikos für das Auftreten einer akuten Pankreatitis unter DPP-4-I versus Placebo im Promillebereich. Für die GLP-1-RA zeigt sich kein Effekt auf das Pankreatitisrisiko. Weder für DPP-4-I noch für GLP-1-RA wurden in den publizierten Studien mit einer Studiendauer von längstens fünf Jahren Hinweise auf eine Erhöhung des Risikos für Pankreaskarzinom gefunden. Aus heutiger Sicht kann also im Hinblick auf pankreatische Komplikationen einer Inkretintherapie Entwarnung gegeben werden. Auch eine Gallensteinerkrankung stellt keine relative oder absolute Kontraindikation für diese Therapie dar, obwohl Gallensteine zu etwa der Hälfte für akute Pankreaserkrankungen unter GLP-1-RA verantwortlich sein dürften.
Tipps für den Alltag
Aus heutiger Sicht kann im Hinblick auf pankreatische Komplikationen einer Inkretintherapie Entwarnung gegeben werden. Beim Einsatz von DPP-4-Inhibitoren und GPL-1-Rezeptoragonisten ist aber klinisches Augenmerk geboten. Auf eine Neuverschreibung eines GLP-1-RA würde ich persönlich bei rezidivierenden Gallensteinproblemen mit Koliken oder Verschluss bis zu einer definitiven Sanierung verzichten. Auch bei anamnestisch vorbekannter rezidivierender Pankreatitis oder bei chronischer Pankreatitis sollte aus Gründen der klinischen Sicherheit von dem Neuansetzen einer DPP-4-I-Therapie Abstand genommen werden. Treten unter einer neu etablierten DPP-4-I-Therapie Erhöhungen von Amylase bzw. Lipase auf über das Doppelte des oberen Normwertes auf, würde ich die DPP-4-I-Therapie beenden und auf ein anderes antidiabetisches Therapieprinzip umsteigen. Diese Therapieempfehlungen basieren nicht auf Studiendaten, die es zu diesen Fragestellungen nicht gibt, sondern auf meinen langjährigen klinischen Erfahrungen.
Literatur:
1 Nachnani JS et al.: Biochemical and histological effects of exendin-4 (exenatide) on the rat pancreas. Diabetologia 2010; 53(1): 153-9 2 Butler AE et al.: Marked expansion of exocrine and endocrine pancreas with incretin therapy in humans with increased exocrine pancreas dysplasia and the potential for glucagon-producing neuroendocrine tumors. Diabetes 2013; 62(7): 2595-604 3 Butler PC et al.: Glucagon-like peptide-1 therapy and the exocrine pancreas: innocent bystander or friendly fire? Diabetologia 2010; 53: 1-6 4 Tkác I, Raz I: Combined analysis of three large interventional trials with gliptins indicates increased incidence of acute pancreatitis in patients with type 2 diabetes. Diabetes Care 2017; 40(2): 284-86 5 Steinberg WM et al.: Impact of liraglutide on amylase, lipase, and acute pancreatitis in participants with overweight/obesity and normoglycemia, prediabetes, or type 2 diabetes: secondary analyses of pooled data from the SCALE clinical development program. Diabetes Care 2017; 40(7): 839-48 6 Dicembrini I et al.: Pancreatitis and pancreatic cancer in patients treated with dipeptidyl peptidase-4 inhibitors: An extensive and updated meta-analysis of randomized controlled trials. Diabetes Res Clin Pract 2020; 159: 107981 7 Singh AK et al.: Risk of acute pancreatitis with incretin-based therapie: a systematic review and updated meta-analysis of cardiovascular outcomes trials. Expert Rev Clin Pharmacol 2020; 13(4): 461-68 8 Abd El Aziz M et al.: Incretin-based glucose-lowering medications and the risk of acute pancreatitis and malignancies: a meta-analysis based on cardiovascular outcomes trials Diabetes Obes Metab 2020; 22: 699-704 9 Sattar N et al.: Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol 2021; 9(10): 653-62
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...