Aus Sicht einer Kinderärztin: Wie Diabetestechnologie unseren Blickwinkel verändert
Autorin:
Univ.-Prof. Dr. Birgit Rami-Merhar, MBA
Medizinische Universität Wien
Universitätsklinik für Kinder-und Jugendheilkunde
Diabetestechnologien haben einen sehr positiven Einfluss auf Therapie, Lebensqualität und Outcome von Kindern und Jugendlichen mit Typ-1-Diabetes(T1D). Sowohl die Insulinpumpe (CSII) als auch die kontinuierliche Glukosemessung (CGM) gelten im Kindes- und Jugendalter als Therapie der Wahl. Seit Kurzem sind Closed-Loop-Systeme (automatische Insulin-Dosierung; AID) auch für Kinder unter 7 Jahren verfügbar, diese sindaufgrund signifikanter Studienergebnisse in puncto Therapieerfolg zunehmend Therapie der Wahl für Kinder und Jugendliche mit T1D.
Keypoints
-
Neue Entwicklungen im Bereich der Diabetestechnologien haben die Therapie und das Krankheitsmanagement für Kinder und Jugendliche mit T1D und ihre Familien verbessert und erleichtert.
-
AID-Systeme sind in ihrer Verwendung auch in der pädiatrischen Altersgruppe sicher, bringen eine Verbesserung der „time in range“ und reduzieren die psychosozialen Belastungen des Alltags.
Diabetes mellitus Typ 1 (T1D) ist eine der häufigsten chronischen Stoffwechselerkrankungen im Kindes- und Jugendalter, mit steigenden Inzidenzzahlen sowohl weltweit als auch in Österreich.1,2 Das Ziel der Diabetestherapie besteht darin, eine möglichst normoglykämische Blutzuckerkontrolle zu erreichen, um akuten und chronischen Komplikationen vorzubeugen. Weitere Therapieziele sind eine normale Entwicklung, Inklusion, Flexibilität im Alltag sowie eine hohe Lebensqualität.
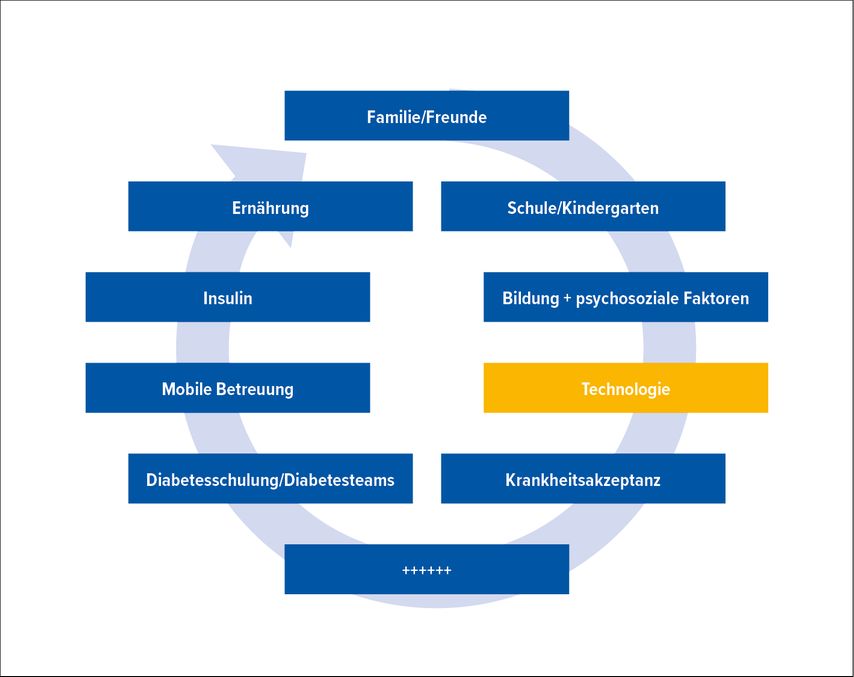
Neben der Entwicklung von synthetisch hergestellten Insulinanaloga mit vorteilhafteren Wirkprofilen wurden die Therapie und das Management des T1D in den letzten beiden Jahrzehnten vor allem durch Innovationen und neuartige Behandlungsmodalitäten im Bereich der Diabetestechnologien geprägt, sowohl was die Insulinabgabe via Insulinpumpen als auch das Glukosemonitoring mithilfe von Systemen zur kontinuierlichen Glukosemessung (CGM-Systeme) betrifft (Abb.1). Es gibt auch noch weitere Technologien wie z.B. mobile Gesundheitsapps, soziale Plattformen und Patientenportale, spielbasierte Anwendungen und „Telehealth“-Lösungen, diese werden hier aus Platzgründen aber nicht berücksichtigt.
Abb. 1: Einflussfaktoren für eine gute metabolische Einstellung bei Kindern und Jugendlichen mit Typ-1-Diabetes: Wichtigen Anteil daran hat die Diabetestechnologie
Besondere Anforderungen und Bedürfnisse
Das Management von T1D bei Kindern und Jugendlichen stellt eine besondere Herausforderung für Menschen mit Diabetes (MmD), Familien und betreuende Diabetesteams dar. Bei Kleinkindern kommt es durch die Unvorhersehbarkeit des Essverhaltens und der körperlichen Aktivität bei gleichzeitig deutlichen zirkadianen Veränderungen der Insulinsensitivität zu raschen Schwankungen der Glukosespiegel. Zusätzlich sind in dieser Altersgruppe oft sehr kleine Dosierungsschritte notwendig, möglichst wenige Injektionen sind erstrebenswert. Am anderen Ende des pädiatrischen Altersspektrums,bei Jugendlichen,gibt es, abgesehen von der psychosozial oft ohnehin sehr turbulenten Lebensperiode, wachstums- bzw. pubertätsassoziierte endokrine Veränderungen, die unter anderem zu einem ausgeprägten Blutzuckeranstieg in den frühen Morgenstunden führen können (Dawn-Phänomen).
Status quo bei Kindern und Jugendlichen mit T1D
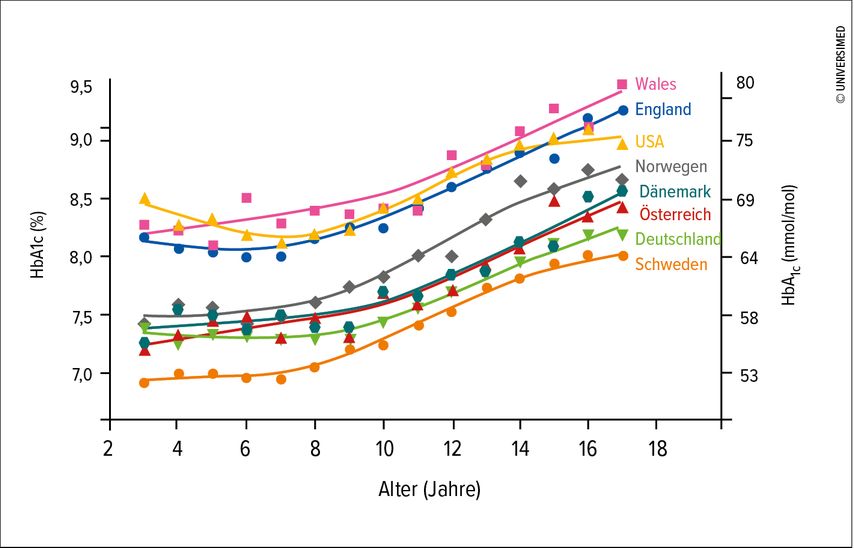
Große internationale Registervergleiche zeigen große regionale Unterschiede in der metabolischen Einstellung. Allen pädiatrischen T1D-Patienten gemeinsam ist, dass sie so gut wie nie das therapeutische Ziel eines HbA1c <7,0 rel% (53,1mmol/mol) erreichen und in allen Registern in der Pubertät eine Verschlechterung beobachtet wird (Abb. 2).3,4 Die Raten schwerer Hypoglykämien und Ketoazidosen sind weiterhin zu hoch.5,6 Alarmierend sind auch wissenschaftliche Daten, die zeigen, dass eine frühe Diabetesmanifestation mit einer signifikant höheren Mortalität und Morbidität (v.a. durch kardiovaskuläre Ereignisse) assoziiert ist und Mädchen/Frauen im Vergleich zu Knaben/Männern ein noch höheres Risiko haben.7 Es ist daher notwendig, die metabolische Einstellung und das therapeutische Outcome dieser Kinder und Jugendlichen zu verbessern.
Abb. 2: HbA1c nach Alter in Jahren einschließlich nichtparametrischer lokaler Regression = LOESS (nach Anderzén J et al. 2020)4
Diabetestechnologie
Insulinpumpen (CSII)
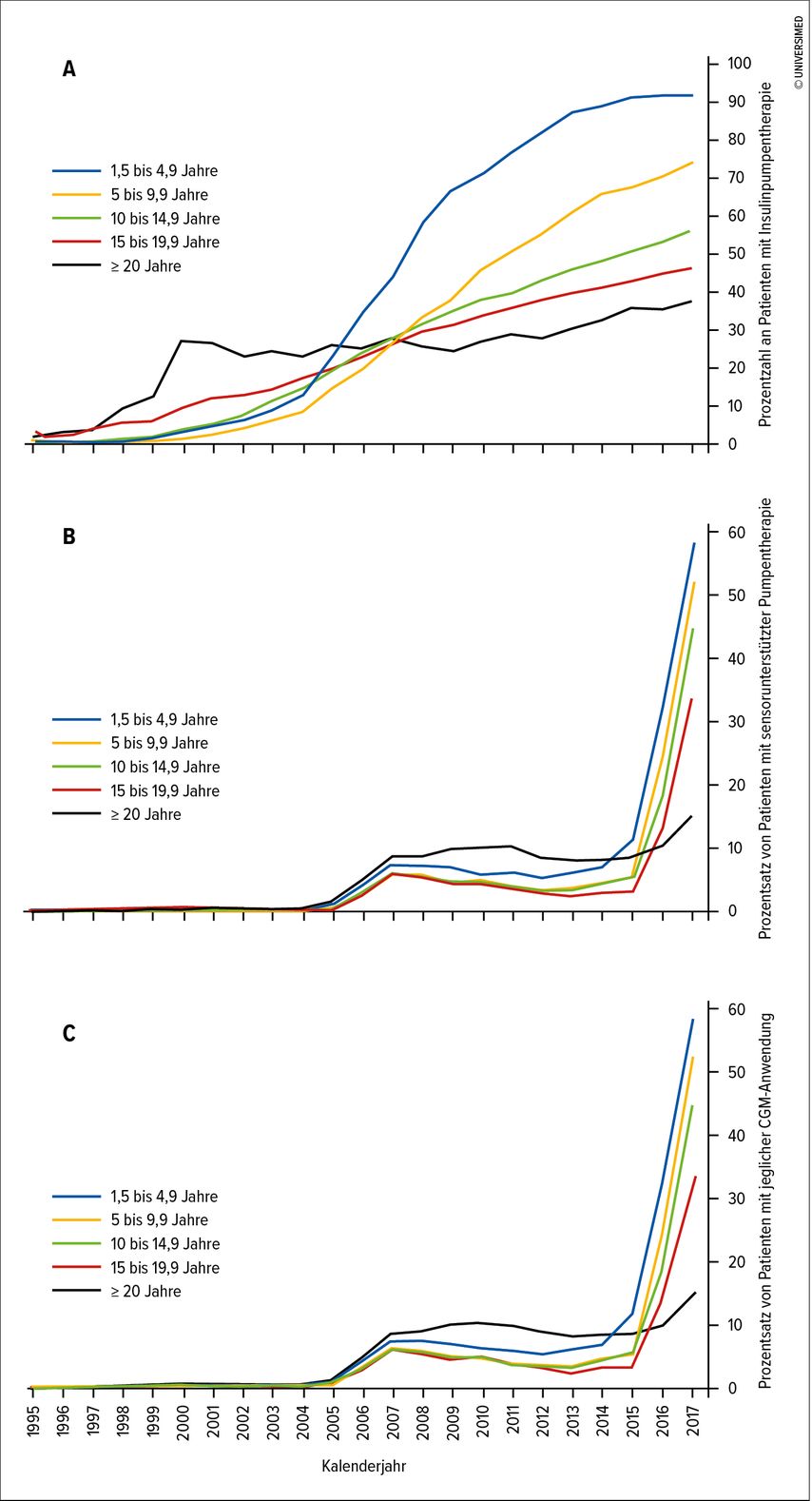
Die Insulinpumpentherapie erfüllt diese komplexen Anforderungen an das Diabetesmanagement im Kindes- und Jugendalter aktuell am besten durch sehr variable und subtile Möglichkeiten der Insulindosisadaptierung. Das zeigt sich sowohl in Metaanalysen prospektiver randomisierter Studien8,9 als auch in Beobachtungsstudien,10,11 in denen bei Kindern und Jugendlichen mit T1D Vorteile der Pumpentherapie im Vergleich zu Basis-Bolus-Therapie mit Insulinpens im Hinblick auf verbesserte Stoffwechseleinstellung, Reduktion der Häufigkeit diabetischer Ketoazidosen und Reduktion schwerer Hypoglykämien beschrieben werden. Die Insulinpumpentherapie gilt daher in vielen Ländern als Therapie der Wahl für Kinder und Jugendliche mit T1D und erfreut sich zunehmender Beliebtheit. In Deutschland und Österreich stieg der Anteil aller Menschen mit Diabetes mit Insulinpumpentherapie von 1% im Jahr 1995 auf 53% im Jahr 2017, wobei die höchsten Raten bei den jüngsten Menschen mit Diabetes zu verzeichnen sind (Abb. 3).12
Abb. 3: Verwendung von Insulinpumpentherapie, sensorunterstützter Pumpentherapie und CGM in unterschiedlichen Altersgruppen in Deutschland und Österreich (1995–2017; DPV-Daten): Gezeigt wird der Prozentsatz an Personen mit Typ-1-Diabetes pro Kalenderjahr, die Insulinpumpentherapie (A), sensorunterstützte Pumpentherapie (B) oder irgendeine Art von CGM-System ≥ 1 Tag/Jahr (C) verwendet haben, je aufgeteilt entsprechend 5 Alterskategorien (nach Van Den Boom L et al. 2019)12
Es gibt bereits Studien, die belegen, dass der frühe Einsatz von Insulinpumpen einige Verbesserungen und Vorteile bringt.13
Kontinuierliches Glukose-Monitoring – CGM-Systeme
Neben der Insulinabgabe über Pens oder Pumpen ist die regelmäßige Überprüfung des Glukosespiegels essenzieller Bestandteil des Diabetesmanagements. Bis vor Kurzem war die kapilläre Messung die am weitesten verbreitete Methode des Glukosemonitorings. Idealerweise soll die Messfrequenz bei Kindern und Jugendlichen mit T1D bei zwischen 6 und 10 Messungen am Tag liegen.14 Die Entwicklung und ständige Verbesserung von Systemen zum kontinuierlichen Glukose-Monitoring (CGM) haben hier wohl in den letzten Jahren einen Paradigmenwechsel eingeleitet. Die Messwerte werden bei sogenannten Real-time-CGM-(rt-CGM)-Systemen entweder in Echtzeit (z.B. Dexcom G6/G7, Medtronic Guardian) oder nur „on demand“ beim aktiven Scannen (Systeme zum intermittierenden Scannen eines CGM-Sensors, iscCGM oder Flash-CGM: Freestyle Libre Systeme der Firma Abbott) auf entsprechenden Lesegeräten angezeigt (eigenständige oder integrierte Geräte in Insulinpumpen oder Mobiltelefonen). CGM-Sensoren haben üblicherweise eine Lebensdauer von 7–14 Tagen und werden vom Benutzer selbst ins subkutane Fettgewebe gesetzt. Die Messgenauigkeit der Systeme hat sich laufend verbessert, aber im hypo- und hyperglykämischen Bereich gibt es zumeist noch größere Abweichungen zu kapillaren Messungen. Der Medtronic Guardian 3 muss noch 2–4x täglich kalibriert werden, beim Guardian 4 sind keine Kalibrierungen mehr notwendig. Der Guardian 4 ist ebenso wie Dexcom G6/G7 sowie Freestyle Libre für Therapieentscheidungen zugelassen. D.h., bei solchen Systemen ist die Notwendigkeit regelmäßiger kapillärer Messungen nicht mehr gegeben, was v.a. bei Kindern zur Entlastung führt und auch bei Teenagern mit mangelnder Therapieadhärenz Vorteile bietet. Bestätigende Kapillarglukosemessungen sind dennoch bei Werten im hypoglykämischen bzw. im stark hyperglykämischen Bereich empfohlen oder für den Fall, dass die klinischen Symptome nicht mit den Sensorwerten übereinstimmen.Initiale Studien und Metaanalysen zum Nutzen von CGM-Systemen waren eher zurückhaltend bzw. widersprüchlich, was den Vorteil v.a. für Kinder und Jugendliche mit T1D betrifft.15,16 Daten von in den letzten 10 Jahren veröffentlichten Studien unter Verwendung ständig verbesserter Sensortechnologien konnten jedoch konsistenter berichten, dass die Verwendung von CGM mit einer Verbesserung der HbA1c-Spiegel, einer Reduktion leichter bis mittelschwerer Hypoglykämien und einer Reduktion der Glukosevariabilität verbunden ist.17,18 Sprachen erste Analysen und Richtlinien v.a. für die kombinierte Verwendung von CGM mit Pumpentherapie, unterstützten letzte Studienergebnisse die Verwendung von CGM auch als Teil der Basis-Bolus-Therapie mit Insulinpens.19,20 Rt-CGM-Systeme verfügen über eine Reihe von individuell einstellbaren Alarmfunktionen wie Hoch- und Tiefalarmen bei Verlassen des Zielbereichs oder Alarmen bei Glukosetrendänderungen. Die CGM-Daten mancher Sensoren können auch kontinuierlich in eine Cloud gesendet werden, auf die – wenn sie aktiviert wird– Dritte wie Eltern oder Partner über mobile Apps (z.B. Dexcom G6 Follow-App, LibreLink-App)oder spezielle Software (Nightscout) zugreifen und auch Alarme erhalten können. Diese Möglichkeit des „Remote-Monitorings“ wird vor allem bei Eltern von Kindern im Kleinkind- bis Volksschulalter sehr geschätzt,sie erleichtert die Kontrolle der Glukoseverläufe und Unterstützung der Kinder und der betreuenden Personen beim Diabetesmanagement in Kindergarten und Schule. Aufgrund dieser rasanten technischen Entwicklung der letzten Jahre bei gleichzeitig weitestgehender Kostenübernahme durch die Krankenkassen, v.a. im pädiatrischen Bereich, hat sich der Anteil an CGM-Usern in Deutschland und Österreich in den letzten 10 Jahren mehr als verzehnfacht.12 Lag der Prozentsatz der Menschen mit Diabetes, die CGM verwenden, im Jahr 2006 noch bei 3%, so waren es im Jahr 2017 bereits 38%, die höchsten Raten findet man bei den jüngsten Diabetespatienten (Abb.3).12 Bei immer weiter verbreiteter Anwendung von CGM-Systemen ergeben sich auch Möglichkeiten, den Erfolg der Diabetestherapie nicht nur mittels regelmäßiger Bestimmung des HbA1c zu überwachen, sondern auch CGM-basierte Parameter heranzuziehen. Vielfach wird gemäß rezenten internationalen Konsensusleitlinien (siehe Battelino T et al. 2019)bereits ergänzend die Zeit im Zielbereich, „Time in Range“ (TIR), als integraler Stoffwechselparameter herangezogen.21 TIR ist definiert als der Prozentsatz an Zeit, in der sich der Glukosespiegel zwischen 70mg/dl und 180mg/dl bewegt,sie sollte für alle Personen mit T1D über 70% liegen. Seit dem Erscheinen dieser internationalen Konsensusleitlinien konnten diese Empfehlungen sehr rasch in die tägliche Praxis übernommen werden. Die Zeit im Zielbereich („grüner Bereich“) ist für Menschen mit Diabetes und deren Familien auch viel anschaulicher als der HbA1c-Wert. Die Empfehlung ist auch, dass die Familien regelmäßig die Daten selber auslesen und gemeinsam anschauen, das vereinfacht dann auch die Besprechung in der Diabetesambulanz.
Sensorunterstützte Pumpentherapie, „low-glucosesuspension“ und „predictivelow-glucosesuspension“
Bei Kindern und Jugendlichen mit T1D werden Insulinpumpen häufig mit CGM-Systemen im Sinne einer sensorunterstützten Insulinpumpentherapie genutzt. Manche Hersteller liefern integrierte Systeme, bei denen die CGM-Werte nicht nur kontinuierlich auf dem Pumpendisplay angezeigt werden, sondern die Insulinabgabe automatisch basierend auf aktuellen CGM-Werten verändert wird. Als einfachste Variante gilt hier die automatisierte Unterbrechung der Insulinabgabe beim Erreichen von niedrigen Glukosewerten („low-glucoseinsulinsuspension“, LGS) bzw. wenn niedrige Glukosespiegel vorhergesagt werden („predictivelow-glucoseinsulinsuspension“, PLGS). Derartige Systeme der Firma Medtronic sind in Österreich bereits seit 2009 (LGS: Medtronic Paradigm Veo) bzw. 2015 (PLGS oder „Smartguard“: MiniMed 640G System) auf dem Markt. Gemäß den Ergebnissen großer RCTs zeigte sich ein Vorteil im Vergleich zur reinen sensorunterstützen Pumpentherapie in puncto Reduktion der Häufigkeit und Dauer von Hypoglykämien, v.a. nächtlichen Hypoglykämien.22–25 Aufgrund der höheren Glukosevariabilität und weil Eltern oft in Sorge wegenHypoglykämien sind, werden diese Systeme vor allem bei Kleinkindern und Kindern mit T1D sehr gerne eingesetzt.
„Remote-Monitoring“
Unterschiedliche CGM- oder AID-(„Automatische Insulin-Dosierung“)-Systeme haben die zusätzliche Option eines „Remote-Monitorings“. Die Daten dieser Systeme werdenauf ein Handy und über Cloud-zu-Cloud-Lösungen an sogenannte Followerübertragen. Im pädiatrischen Bereich sind das meist die Eltern, aber auch öfters Großeltern oder Betreuungseinrichtungen. Die Erwachsen können damit die Glukosewerte ihrer Kinder monitieren, auch wenn diese in Bereuungseinrichtungen sind, und bei Bedarf bei Therapieentscheidungen unterstützen.
Automatische Insulin-Dosierung (AID)
Komplexere Ansätze, wie sie in sogenannten AID-Systemen (auch „Closed-loop“[CL]-Systeme oder künstliche Bauchspeicheldrüse genannt) verfolgt werden, führen nicht nur zu einer Unterbrechung der vorprogrammierten Basalraten bei drohender Hypoglykämie, sondern auch zu einer kontinuierlichen Modulation der Insulinabgabe abhängig von aktuellen und vergangenen CGM-Werten über einen Algorithmus, der automatisch die optimale Menge an Insulin zur Vermeidung von Hypo- und Hyperglykämien berechnet. Die meisten aktuell in Verwendung und Testung befindlichen Systeme sind sogenannte Hybridsysteme, bei denen man zum Abdecken von Mahlzeiten weiterhin Blutzuckerwerte bzw. die Menge an Kohlenhydraten in einer Mahlzeit in die Pumpe eingeben muss.
Resultate aus klinischen Studien von AID-Systemen sind vielversprechend in Hinblick auf eine Verbesserung der Stoffwechsellage bei gleichzeitiger Reduktion der Hypoglykämiehäufigkeit.26,27 Das erste dieser Systeme, das Medtronic-670G- System, ist seit Juni 2019 auch in Österreich verfügbarund ab einem Alter von 7 Jahren zugelassen.Seit Dezember 2021 ist auch das Medtronic-780G-System zugelassen, eine Mindesttagesinsulindosis von 8IU/d ist dafür erforderlich. Für die sehr junge Altersgruppe ab 1 Jahr ist das CamAPS-System zugelassen und seit Juli 2022 in Kombination mit der YpsoPumpund dem Dexcom G6 auch in Österreich verfügbar. Die multizentrische, randomisierte Cross-over-Studie KidsAP (Horizon-2020-EU-Projekt, mit österreichischer Beteiligung) konnte mit CamAPS im Vergleich zu einer sensorunterstützen Pumpentherapie bei sehr jungen Kindern (1–7 Jahre) eine signifikante Verbesserung der TIR sowieeine Reduktion der Hyperglykämierate ohne Erhöhung der Hypoglykämierate beobachten.28 In weiteren Publikationen zu dieser KidsAP-Studie konnte auch über eine Verbesserung der Lebensqualität der Familien, weniger Stress und besseren Schlaf berichtet werden.29,30
Praxistipp
Die Herausforderung in der Betreuung ist es, aus der immer größer werdenden Auswahl an technischen Lösungen das für die Kinder und Jugendlichen und deren Familien im entsprechenden Lebensabschnitt bestgeeignete System zu auszuwählen. Eine Betreuung in einem Zentrum mit einem multidisziplinären Team mit ausreichender Erfahrung ist absolut empfohlen.Weitere AID-Systeme (u.a. Tandem Control-IQ, Omnipod 5 FX, Diabeloop), die bereits eine CE-Zertifizierung haben, sind in weiten Teilen Europas – so auch in Österreich – noch nicht auf dem Markt. Im September 2022 wurde zu AID-Systemen eine internationale Konsensus-Empfehlung publiziert.31 Bihormonale Systeme, die u.a. zusätzlich zu Insulin auch Glucagon zur Vermeidung von Hypoglykämien abgeben, befinden sich in klinischer Testung.
Getriggert durch die immer noch begrenzte Verfügbarkeit von AID-Systemen, deren Entwicklung und Zulassung als Medizinprodukt streng behördlich geregelt ist und gewisse Zeit in Anspruch nimmt, hat sich in den letzten Jahren eine immer größer werdende Community gebildet, die gemäß ihrem „Mantra“ (#wearenotwaiting) die Entwicklung und Verbreitung von Do-it-yourself(DIY)-Open-Source-AID-Systemen (z.B. OpenAPS, AndroidAPS oder LOOP) vorantreiben.32 Immer mehr Menschen mit T1D bauen sich so ihre AID-Systeme selbst über online frei verfügbare Anleitungen und Algorithmen, die von der Community auch ständig modifiziert werden können und sich im eigenverantwortlichen Selbstexperiment durch den/die User*in der behördlichen Zulassung entziehen. Im Jahr 2022 wurde zu diesen Open-Source-AID-Systemen erstmalig eine Konsensus-Empfehlung veröffentlicht, die als Hilfe für medizinisches Fachpersonal dienen soll.33
Technologie als Grundlage für telemedizinische Betreuung
Alle Insulinpumpen, CGM-Systeme und AID-Systeme können über Cloud-basierte Software ausgelesen werden bzw. werden automatisch in die entsprechende Cloud hochgeladen. Damit besteht die ideale technische Grundlage für eine telemedizinische Betreuung, die vor allem während der SARS-CoV-2-Pandemie in vielen Diabeteszentren zu einer neuen Realität geworden ist.34,35 Auch über die Pandemie hinaus birgt die Telemedizin großes Potenzial in der Langzeitbetreuung von Menschen mit Diabetes mellitus. Um Telemedizin in die Versorgungsstruktur implementieren zu können, bedarf es allerdings einer soliden Planung und Umsetzung unter Berücksichtigung rechtlicher und datenschutzrechtlicher Grundlagen.
Vermittlung von Theorie und Praxis der Diabetestechnologie
Die Implementierung und Verwendung von Diabetestechnologien müssen fundiert und altersgerecht vermittelt und trainiert werden.35 Strukturierte formale Schulungsprogramme haben sich als effektiv im Sinne von verbesserter glykämischer Kontrolle, Akzeptanz und Zufriedenheit der Anwender*innen erwiesen.36–38 Gerade bei jungen Kindern ist es essenziell, auch alle Betreuungspersonen des Kindes zu schulen. Das multidisziplinäre Schulungsteam sollte (pädiatrische) Diabetolog*innen, Diabetesberater*innen, Diätolog*innen, Psycholog*innen sowie Sozialarbeiter*innen umfassen.
Das multidisziplinäre Team muss die Datenanalyse beherrschen, um entsprechende Therapieanpassungen vornehmen zu können. Um eine qualitativ hochwertige Versorgung zu gewährleisten, sind kontinuierliche Fortbildungen für die Diabetesteams unverzichtbarer Teil eines erfolgreichen Qualitätsmanagements.
Eine Limitation der Diabetestechnologie soll nicht unerwähnt bleiben: Die Haut von Kindern und Jugendlichen ist manchmal sehr empfindlich und es gibt häufig Probleme mit Kontaktallergien, Hautirritationen, eher seltener mit Infektionen und Abszessen.
Literatur:
1 Patterson CC et al.: Worldwide estimates of incidence, prevalence and mortality of type 1 diabetes in children and adolescents: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res Clin Pract 2019; 157: 107842 2 Rami-Merhar B et al.: Time trends in incidence of diabetes mellitus in Austrian children and adolescents <15 years (1989-2017). Pediatr Diabetes 2020; 21(5): 720-6 3 Foster NC et al.: State of type 1 diabetes management and outcomes from the T1D exchange in 2016-2018. Diabetes Technol Ther 2019; 21(2): 66-72 4 Anderzén J et al.: International benchmarking in type 1 diabetes: Large difference in childhood HbA1c between eight high-income countries but similar rise during adolescence—A quality registry study. Pediatr Diabetes 2020; 21(4): 621-7 5 Cengiz E et al.: Severe hypoglycemia and diabetic ketoacidosis among youth with type 1 diabetes in the T1D Exchange clinic registry. Pediatr Diabetes 2013; 14(6): 447-54 6 Fritsch M et al.: Predictors of diabetic ketoacidosis in children and adolescents with type 1 diabetes. Experience from a large multicentre database. Pediatr Diabetes 2011; 12(4 Pt 1): 307-12 7 Rawshani A et al.: Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: A nationwide, register-based cohort study. Lancet 2018; 392(10146): 477-86 8 Pickup JC, Sutton AJ: Severe hypoglycaemia and glycaemic control in type 1 diabetes: Meta-analysis of multiple daily insulin injections compared with continuous subcutaneous insulin infusion. Diabet Med 2008; 25(7): 765-74 9 Yeh HC et al.: Comparative effectiveness and safety of methods of insulin delivery and glucose monitoring for diabetes mellitus: A systematic review and meta-analysis. Ann Intern Med 2012; 157(3): 336-47 10 Johnson SR et al.: Long-term outcome of insulin pump therapy in children with type 1 diabetes assessed in a large population-based case-control study. Diabetologia 2013; 56(11): 2392-2400 11 Karges B et al.: Association of insulin pump therapy vs. insulin injection therapy with severe hypoglycemia, ketoacidosis, and glycemic control among children, adolescents, and young adults with type 1 diabetes. JAMA 2017; 318(14): 1358-66 12 Van Den Boom L et al.: Temporal trends and contemporary use of insulin pump therapy and glucose monitoring among children, adolescents, and adults with type 1 diabetes between 1995 and 2017. Diabetes Care 2019; 42(11): 2050-6 13 Kamrath C et al.: Early versus delayed insulin pump therapy in children with newly diagnosed type 1 diabetes: results from the multicentre, prospective diabetes follow-up DPV registry. Lancet Child Adolesc Heal 2021; 5(1): 17-25 14 DiMeglio LA et al.: ISPAD clinical practice consensus guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes. Pediatr Diabetes 2018; 19: 105-14 15 Pickup JC et al.: Glycaemic control in type 1 diabetes during real time continuous glucose monitoring compared with self monitoring of blood glucose: Meta-analysis of randomised controlled trials using individual patient data. BMJ 2011; 343: 1-14 16 Langendam M et al.: Continuous glucose monitoring systems for type 1 diabetes mellitus. Cochrane Database Syst Rev 2012; 1(1):CD008101 17 Bergenstal RM et al.: Effectiveness of sensor-augmented insulin-pump therapy in type 1 diabetes. N Engl J Med 2010; 363(4): 311-20 18 Battelino T et al.: Effect of continuous glucose monitoring on hypoglycemia in type 1 diabetes. Diabetes Care 2011; 34(4): 795-800 19 Beck RW et al.: Effect of continuous glucose monitoring on glycemic control in adults with type 1 diabetes using insulin injections the diamond randomized clinical trial. JAMA 2017; 317(4): 371-8 20 Lind M et al.: Continuous glucose monitoring vs. conventional therapy for glycemic control in adults with type 1 diabetes treated with multiple daily insulin injections the gold randomized clinical trial. JAMA 2017; 317(4): 379-87 21 Battelino T et al.: Clinical targets for continuous glucose monitoring data interpretation: Recommendations from the international consensus on time in range. Diabetes Care 2019; 42(8): 1593-1603 22 Ly TT et al.: Effect of sensor-augmented insulin pump therapy and automated insulin suspension vs. standard insulin pump therapy on hypoglycemia in patients with type 1 diabetes: A randomized clinical trial. JAMA 2013; 310(12): 1240-7 23 Bergenstal RM et al.: Threshold-based insulin-pump interruption for reduction of hypoglycemia. N Engl J. Med 2013; 369(3): 224-32 24 Maahs DM et al.: A randomized trial of a home system to reduce nocturnal hypoglycemia in type 1 diabetes. Diabetes Care 2014; 37(7): 1885-91 25 Battelino T et al.: Prevention of hypoglycemia with predictive low glucose insulin suspension in children with type 1 diabetes: A randomized controlled trial. Diabetes Care 2017; 40(6): 764-70 26 Boughton CK et al.: Closed-loop therapy and preservation of C-peptide secretion in type 1 diabetes. N Engl J Med 2022; 387(10): 882-93 27 Boughton CK, Hovorka R: New closed-loop insulin systems. Diabetologia 2021; 64(5): 1007-15 28 Ware J et al.: Randomized trial of closed-loop control in very young children with type 1 diabetes. N Engl J Med 2022; 386(3): 209-19 29 Kimbell B et al.: Parents’ experiences of using a hybrid closed-loop system (CamAPS FX) to care for a very young child with type 1 diabetes: Qualitative study. Diabetes Res Clin Pract 2022; 187: 109877 30 Hart RI et al.: Parents’ experiences of using remote monitoring technology to manage type 1 diabetes in very young children during a clinical trial: Qualitative study. Diabet Med 2022; 39(7): 1-12 31 Phillip M et al.: Consensus recommendations for the use of automated insulin delivery technologies in clinical practice. Endocr Rev 2022; 1-27 32 Lee JM et al.: Real-world use and self-reported health outcomes of a patient-designed do-it-yourself mobile technology system for diabetes: Lessons for mobile health. Diabetes Technol Ther 2017; 19(4): 209-19 33 Braune K et al.: Open-source automated insulin delivery: International consensus statement and practical guidance for health-care professionals. Lancet Diabetes Endocrinol 2022; 10(1): 58-74 34 Sarteau AC et al.: Changes to care delivery at nine international pediatric diabetes clinics in response to the Covid-19 global pandemic. Pediatr Diabetes 2021; 22(3): 463-8 35 Wilmot EG et al.: Time in range: A best practice guide for UK diabetes healthcare professionals in the context of the Covid-19 global pandemic. Diabet Med 2021; 38(1): 1-16 36 Bergis D et al.: Comparison of the efficacy of an education program for people with diabetes and insulin pump treatment (INPUT) in a randomized controlled trial setting and the effectiveness in a routine care setting: Results of a comparative effectiveness study. Patient Educ Couns 2019; 102(10): 1868-74 37 Schlüter S et al.: Evaluation of the SPECTRUM training programme for real-time continuous glucose monitoring: A real-world multicentre prospective study in 120 adults with type 1 diabetes. Diabet Med 2021; 38(2): 1-10 38 DiMeglio LA et al.: Type 1 diabetes. HHS public access. Lancet 2019; 176: 139-48
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...