Ketosis-prone Diabetes: Können neue Klassifikationen in der Therapie helfen?
Autor:
Prim. Priv.-Doz. Dr. Karl Horvath
Facharzt für Innere Medizin, Endokrinologie und Diabetologie
Klinikum Bad Gleichenberg
Wissenschaftlicher Mitarbeiter
Institut für Allgemeinmedizin und evidenzbasierte Versorgungsforschung
Medizinische Universität Graz
E-Mail:
Ketosis-prone Diabetes mellitus (KPD) ist ein heterogenes Syndrom, das durch das Auftreten einer diabetischen Ketoazidose bei Patienten, die nicht notwendigerweise den typischen Phänotyp eines Typ-1-Diabetes aufweisen, gekennzeichnet ist. Mithilfe neuer Klassifikationen wird versucht, unterschiedliche Subgruppen von Personen mit KDP zu definieren, um eine differenzierte, an den klinischen Notwendigkeiten orientierte Therapie zu ermöglichen.
Keypoints
-
Nicht alle Personen, die mit einer diabetischen Ketoazidose (DKA) manifestieren, haben einen Diabetes mellitus Typ 1.
-
Ein Teil der Personen mit DKA benötigt in weiterer Folge keine prolongierte Insulintherapie.
-
Die Beurteilung der Betazellreserve (C-Peptid) und der Betazellautoimmunität (Auto-AK) nach Abklingen der DKA hilft bei der Vorhersage des klinischen Verlaufs und der Langzeitbehandlung. Diese Bewertung wird in der Regel ein bis drei Wochen nach der DKA durchgeführt.
Die diabetische Ketoazidose (DKA) stellt einen potenziell lebensbedrohenden Notfall bei Personen mit Diabetes mellitus dar (Abb. 1). Sie ist gekennzeichnet durch eine metabolische Azidose, Dehydration und Elektrolytstörungen.
Abb. 1: Im schlimmsten Fall landen Patienten mit diabetischer Ketoazidose auf der Intensivstation. Mithilfe neuer Klassifikationen wird versucht, Subgruppen von Personen mit ketosis-prone Diabetes mellitus zu definieren. Ziel ist eine differenzierte, an den klinischen Notwendigkeiten orientierte Therapie zu ermöglichen.
Ursache ist ein absoluter Insulinmangel. Im Rahmen der gesteigerten Lipolyse entsteht vermehrt Acetyl-CoA. Die Menge des entstandenen Acetyl-CoA übersteigt die oxidative Kapazität des Krebszyklus und es entstehen Ketonkörper, die zur metabolischen Azidose führen.1 Infolge des akuten DKA-Ereignisses kann es zu unterschiedlichen klinischen Verläufen kommen: Der absolute Insulinmangel bleibt bestehen und eine andauernde Insulintherapie ist notwendig. Es gibt aber auch Personen, bei denen sich die endogene Insulinsekretion erholt, d.h. der absolute Insulinmangel nur temporär aufgetreten ist. Bei diesen Personen ist nach der DKA eine antihyperglykämische Therapie über lange Zeit mit Nichtinsulinen möglich. Während ersterer Verlauf die Charakteristika eines Typ-1-Diabetes (T1D) aufweist, entspricht zweiterer dem eines Typ-2-Diabetes.
Typischer und atypischer Verlauf nach DKA
Berichte zu Personen mit atypischem Verlauf eines Diabetes mit Erholung der Betazellfunktion nach DKA, Insulinunabhängigkeit im weiteren Verlauf und fehlendem Nachweis von Autoantikörpern (Auto-AK) gegen Betazellen bestehen seit den 1960er-Jahren. Atypische Verläufe wurden vor allem in Personen afrikanischer Abstammung und Angehörigen nichtkaukasischer Ethnien beschrieben. Während der letzten Dekaden gibt es aber zunehmend Berichte, dass Personen unterschiedlicher Herkunft und Abstammung betroffen sind und dass die Prävalenz weltweit zunimmt.2
Aus klinischer Sicht ist eine Unterscheidung zwischen Personen mit typischem oder atypischem Verlauf anzustreben. Bei Personen mit ausreichender endogener Insulinsekretion kann eine nicht notwendige Insulintherapie mit der Gefahr von hypoglykämischen Ereignissen und ungünstigen Effekten auf das Körpergewicht, die Lebensqualität und gegebenenfalls die berufliche Situation vermieden werden. Auch eine Unterscheidung zum T2D ist wesentlich, da sich die Schulungsinhalte zwischen KDP und T2D unterscheiden. Da bei Personen mit KPD Ereignisse einer DKA rezidivierend auftreten können, ist eine Schulung hinsichtlich des Erkennens und Vermeidens einer DKA mit Selbstkontrollen der Blutglukosekonzentration und der Konzentration von Ketonkörpern im Blut oder Harn notwendig. Auch aus wissenschaftlicher Sicht ist eine Unterscheidung z.B. für die Untersuchung unterschiedlicher Mechanismen der Betazellfunktionsstörung interessant.
Klassifikation – Autoantikörper als Marker
Im Rahmen der aktuellen Klassifikation der American Diabetes Association (ADA) wird bei allen Personen mit DKA dieser als T1D klassifiziert. T1D ist charakterisiert durch eine autoimmune Zerstörung der pankreatischen Betazellen mit der Folge eines absoluten Insulinmangels.
Autoantikörper als Marker der autoimmunen Betazellzerstörung umfassen z.B. Antikörper gegen Zinktransporter 8 (ZnT8), Tyrosin-Phosphatase 2 (IA2) und Glutamat-Decarboxylase (GAD). Bei fehlendem Nachweis von Autoantikörpern erfolgt die Klassifikation als Typ-1b-Diabetes oder idiopathischer T1D.3 Eine andauernde Insulinabhängigkeit bzw. -unabhängigkeit wird nicht als eigenes Kriterium berücksichtigt.
Subgruppenklassifikationen bei DKA
Bisher wurden mehrere Vorschläge zur Unterscheidung von Subgruppen von Personen mit Manifestation einer DKA gemacht. Als KDP wurden dabei jene Formen des Diabetes bezeichnet, bei denen es zum Auftreten einer DKA kommt, keine Auto-AK nachgewiesen werden und für einen prologierten Zeitraum keine Insulinabhängigkeit besteht.
Ein anderes, auf dem Body-Mass-Index (BMI) beruhendes Schema unterteilt Personen mit KPD in Personen mit „lean KPD“ (BMI <28kg/m2) und „obese KPD“ (BMI ≥28kg/m2). Lean KPD entspricht dabei dem T1D mit niedriger Betazellfunktionsreserve und obese KPD dem T2D mit erhaltener Insulinproduktion.4
In einer modifizierten Variante der ADA-Klassifikation werden KPD-Patienten in drei Gruppen eingeteilt.5 Patienten mit Betazell-Autoantikörpern werden als Patienten mit Diabetes mellitus Typ 1a klassifiziert. Personen, bei denen keine Autoantikörper nachgewiesen werden, werden retrospektiv anhand der prolongierten Insulinabhängigkeit in solche mit „KPD insulinabhängig“ und solche mit „KPD nicht insulinabhängig“ unterschieden. Typ-1a-Patienten wie auch Patienten mit KPD insulinabhängig weisen die klinischen Merkmale eines T1D auf, während Personen mit KPD nicht insulinabhängig die klinischen Merkmale eines T2D aufweisen.
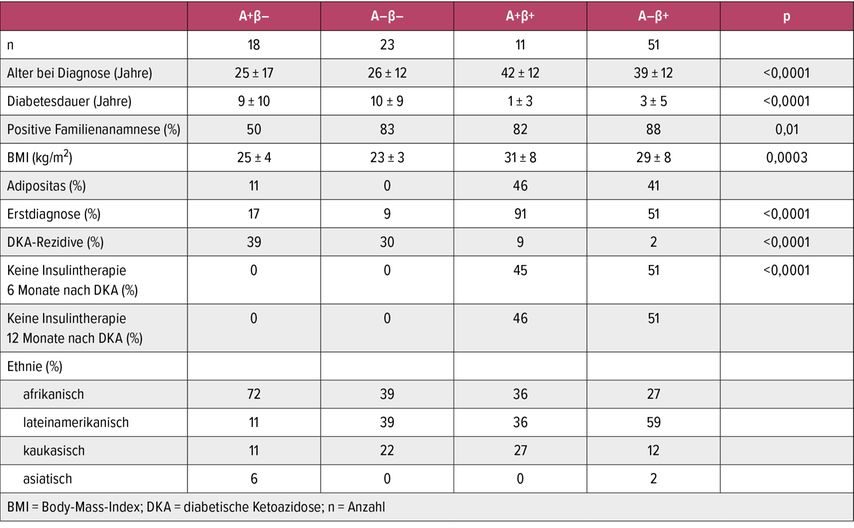
Von den Arbeitsgruppen am Baylor College of Medicine und der University of Washington wurde ein Klassifizierungssystem (Aβ-Klassifikation) entwickelt, das KPD-Untergruppen auf der Grundlage des Vorhandenseins oder Fehlens von Autoantikörpern und einer Betazell-Funktionsreserve unterscheidet. Die Betazell-Funktionsreserve wird dabei durch Messung der C-Peptid-Konzentration bestimmt.2 In dieser Klassifizierung werden alle Personen mit Manifestation einer DKA unter dem Begriff des Syndroms des Ketosis-prone Diabetes zusammengefasst. In einer Longitudinalstudie erwies sich das Aβ-System mit einer Sensitivität von 99% und einer Spezifität von 96% als das genaueste Schema zur Vorhersage der Insulinabhängigkeit 12 Monate nach der DKA.6 Die vier Untergruppen des Aβ Schemas werden wie folgt definiert:2 A+β–-Autoantikörper vorhanden, Betazellfunktion nicht vorhanden; A+β+-Autoantikörper vorhanden, Betazellfunktion vorhanden; A–β–-Autoantikörper vorhanden, Betazellfunktion nicht vorhanden; A-β+-Autoantikörper nicht vorhanden, Betazellfunktion vorhanden.
Wie groß ist die Betazellreseve?
Der Verlauf nach der ersten Episode einer DKA hängt vom Vorhandensein von Autoantikörpern und der Betazellreserve ab. Die Betazellreserve ist dabei der entscheidende Faktor für das langfristige glykämische Management und die Insulinabhängigkeit.
In Studien zeigten Personen mit den Merkmalen A+β– und A-β– eine nach der DKA andauernde Insulinabhängigkeit. Bei Betroffenen mit den Merkmalen A+β+ verfügten rund 50% kurz nach der DKA über eine ausreichende funktionelle Reserve der Betazellen und die Insulintherapie konnte abgesetzt werden. (Tab. 1).
Tab. 1: Klinische Charakteristika Aβ-Subgruppen (modifiziert nach Balasubramanyam A et al.: Endocrine Reviews 2008)6
A–β+-Patienten bilden die größte KPD-Untergruppe (etwa 50%) in multiethnischen Kohorten von KPD-Patienten in den Vereinigten Staaten2,6 (Tab. 1). Rund 50% der A–β+-Patienten hatten einen neu aufgetretenen Diabetes und entwickelten eine DKA ohne offensichtliche auslösende Faktoren („unprovozierte“ KPD). Bei den übrigen Patienten bestand dagegen der Diabetes mellitus seit Langem und die Ketoazidose entwickelte sich im Rahmen einer akuten Erkrankung oder durch Nichteinhaltung einer antidiabetischen Behandlung („provozierte“ KPD). Das Auftreten einer unprovozierte DKA war durch eine reversible Betazelldysfunktion und einer erhöhten Häufigkeit von DQB1*0602 (Resistenzallel für Autoimmundiabetes) gekennzeichnet. Personen mit einer provozierten DKA zeigten einen fortschreitenden Verlust der Betazellreserve und eine erhöhte Häufigkeit der humanen Leukozytenantigene (HLA) für Autoimmundiabetes Typ 1, DQB1*0302 und DRB1*04.
Therapie des KPD
Die Behandlung der DKA soll nach etablierten Grundsätzen mit Insulin, Volumen- und Elektrolytsubstitution erfolgen. Zum Zeitpunkt der Entlassung aus der stationären Behandlung sollte die Insulintherapie beibehalten werden. Ein bis drei Wochen nach der Ketoazidose werden die Auto-AK bestimmt und die C-Peptidkonzentration wird nüchtern oder nach Glukagonstimulation gemessen. Eine β- Klassifikation erfolgt, wenn die C-Peptid-Werte nüchtern <1ng/ml oder nach Stimulation <1,5ng/ml betragen. Bei diesen Personen muss, unabhängig vom Vorhandensein von Auto-AK, die Insulintherapie langfristig fortgesetzt werden.
Praxistipp
Neue Klassifikationen versuchen unterschiedliche Subgruppen von Personen mit Ketosis-prone Diabetes mellitus zu definieren, um eine differenzierte Therapie zu ermöglichen.Bei Personen mit β+-Klassifikation kann eine schrittweise Reduktion der Insulindosis erfolgen. Dabei sind die engmaschige Kontrolle sowie ein Monitoring der Blutglukosekonzentration und Ketonkörpern durch die Patienten notwendig. Treten unter der Insulinreduktion keine weitere Ketosen auf, kann die Insulintherapie abgesetzt werden. Die langfristige Therapie erfolgt wie bei Personen mit T2D. Ein Quotient aus nüchtern gemessenem C-Peptid (nmol/l) zu Blutglukose (mmol/l) >11 sechs Monate nach DKA erhöhte die Wahrscheinlichkeit einer Insulinunabhängigkeit. Dies kann in der Einschätzung des Verlaufs von Personen der Klassifikation A+β+ hilfreich sein. Die meisten A+β+-Patienten können die Insulintherapie absetzen, müssen aber engmaschig überwacht werden, da die Entwicklung ihrer Betazellfunktion am wenigsten vorhersehbar ist.6
Literatur:
1 Misra S et al.: Diabetic ketoacidosis: not always due to type 1 diabetes. BMJ 2013; 346:f3501 2 Balasubramanyam A et al.: Syndromes of ketosis-prone diabetes mellitus. Endocrine Reviews 2008; 29(3): 292-302 3 American Diabetes Association. Standards of medical care in diabetes - 2022; Diabetes Care 2022; 45: Supplement 1 4 Umpierrez GE et al.: Immunogenetic analysis suggests different pathogenesis for obese and lean African-Americans with diabetic ketoacidosis. Diabetes Care 1999; 22(9): 1517-23 5 Mauvais-Jarvis F et al.: Ketosis-prone type 2 diabetes in patients of sub-Saharan African origin: clinical pathophysiology and natural history of beta-cell dysfunction and insulin resistance. Diabetes 2004; 53(3): 645-53 6 Balasubramanyam A et al.: Syndromes of ketosis-prone diabetes mellitus. Endocrine Reviews 2008; 29(3): 292-302
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...