Diabetische Neuropathie und ihre Folgen
Bericht:
Claudia Benetti
Medizinjournalistin
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bis zu 50% der Menschen mit Diabetes haben eine Neuropathie. Damit ist diese die häufigste diabetesassoziierte Folgeerkrankung. Um weitere Probleme wie das diabetische Fussulkus, den Charcot-Fuss oder eine Amputation zu vermeiden, spielt die Prävention eine grosse Rolle. Gefordert sind vor allem die Grundversorger:innen, wie Dr. med. Katrin E. Schimke, Zentrumspraxis St. Gallen, am FOMF Diabetes Update Refresher betonte.
Die Inzidenz der diabetischen Neuropathie ist bei Typ-2-Diabetes (T2D) doppelt so hoch wie bei Typ-1-Diabetes (T1D). «Die Differenz wird mit Unterschieden in der Pathogenese erklärt», sagte Schimke. Die Prävalenz beträgt je nach Studienpopulation zwischen 10% und 50% und ist bei beiden Diabetestypen etwa gleich.1 Sie nimmt mit dem Alter und der Erkrankungsdauer zu.2
Pathophysiologie der diabetischen Neuropathie
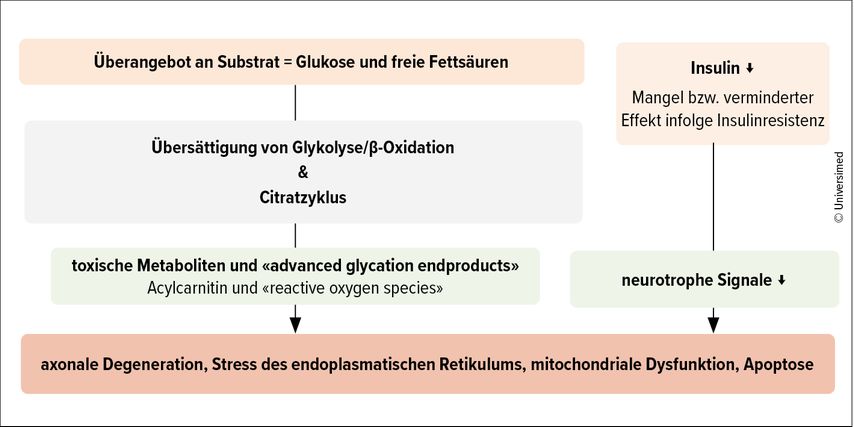
«Die Pathogenese ist komplex und wird von metabolischen und vaskulären Faktoren beeinflusst», erklärte Schimke. Aufgrund der Hyperglykämie kommt es auch in den Nervenzellen zu einem Überangebot an Glukose und freien Fettsäuren, was zu einer Übersättigung von Stoffwechselwegen wie der Beta-Oxidation, der Glykolyse und dem Citratzyklus sowie zu einer vermehrten Bildung von toxischen Metaboliten (Acylcarnitin und «reactive oxygen species» [ROS]) und sog. «advanced glycation endproducts» (AGE) führt. «Zudem besteht bei T1D ein absoluter Insulinmangel und bei T2D eine Insulinresistenz auch auf dem Niveau der Nerven. Dies führt zu einer Abnahme neurotropher Signale», so die Referentin. Zusammen mit den metabolischen Veränderungen führt dies zu einer axonalen Degeneration und auf zellulärer Ebene zu Stress, mitochondrialer Dysfunktion und schliesslich zum Zellzerfall (Abb. 1).3 Dieser Prozess verläuft von distal nach proximal.
Mit einer guten Diabeteseinstellung kann das relative Risiko für eine Neuropathie bei T1D um knapp 80% und bei T2D um 5–10% gesenkt werden.4 «Dass der Einfluss bei T2D deutlich geringer ist, liegt wohl daran, dass hier noch zusätzliche Risikofaktoren wie Übergewicht, Hyperlipidämie, Hypertonie, metabolisches Syndrom, Rauchen, Alkohol und andere neurotoxische Faktoren eine Rolle spielen», erläuterte Schimke.
Formen und Klinik der diabetischen Neuropathie
Bei der diabetischen Neuropathie unterscheidet man die periphere Mononeuropathie, die periphere Polyneuropathie und die autonome Neuropathie. Am häufigsten ist die distale sensomotorische Neuropathie (DPN, «diabetic pheripheral neuropathy»). Sie geht einher mit einer symmetrischen von distal aufsteigenden Schädigung des Nervensystems, die sich mit den typischen strumpf- oder handschuhförmigen Ausfällen manifestiert.
Bei Schädigung der kleinen unmyelisierten C-Fasern treten starke Schmerzen, Hyperalgesie und Allodynie (sog. positive Symptome) auf. Die Schmerzen werden oft als einschiessend lanzinierend oder elektrisierend beschrieben. Klinisch lässt sich ein Verlust der Pin-Prick- und der Temperaturwahrnehmung beobachten. Die üblichen Screeningtests mit der Stimmgabel und dem Monofilament fallen normal aus, ebenso die elektroneurografischen Untersuchungen. Meist treten die positiven Symptome in der frühen Phase der DPN oder im Stadium des Übergangs zur schmerzlosen Large-Fiber-Neuropathie mit negativen Symptomen auf.
Die Large-Fiber-Neuropathie ist gekennzeichnet durch Taubheitsgefühle und eventuell leichte Dysästhesien. Klinisch finden sich in der Regel ein erloschener Achillessehnenreflex sowie ein Verlust des Schmerzempfindens. Hinzu kommen gelegentlich motorische Symptome wie Schwäche, Atrophie, Gang- und Koordinationsstörungen.
Nicht selten treten gemischte Formen mit einer Schädigung beider Nervenfasertypen und folglich mit positiven und negativen Symptomen auf. Das führt zum Paradox des «painful insensate foot». «Die Patienten klagen einerseits über einen schmerzhaften Fuss, empfinden aber auf Reize, die normalerweise Schmerz verursachen, keinen Schmerz», so Schimke. «50% der Patienten mit einer DPN sind zudem asymptomatisch, was dazu führt, dass die DPN erst spät entdeckt wird, im ungünstigsten Fall erst, wenn bereits eine ‹Katastrophe› eingetreten ist».
Die klinischen Konsequenzen der DPN sind neben den Schmerzen ein erhöhtes Sturzrisiko, Fussulzerationen (Lebenszeitinzidenz von 25%), eine neuropathische Osteoarthropathie, ein 15-fach erhöhtes Risiko für Amputationen sowie psychosoziale Auswirkungen wie Depressionen und Angststörungen. Auch die Lebensqualität ist nachhaltig kompromittiert. «Nicht zu vergessen die Kostenfolgen. Die DPN im Endstadium respektive das diabetische Fusssyndrom ist eine der teuersten Diabeteskomplikationen überhaupt», so die Referentin.
Therapieoptionen bei schmerzhafter DPN
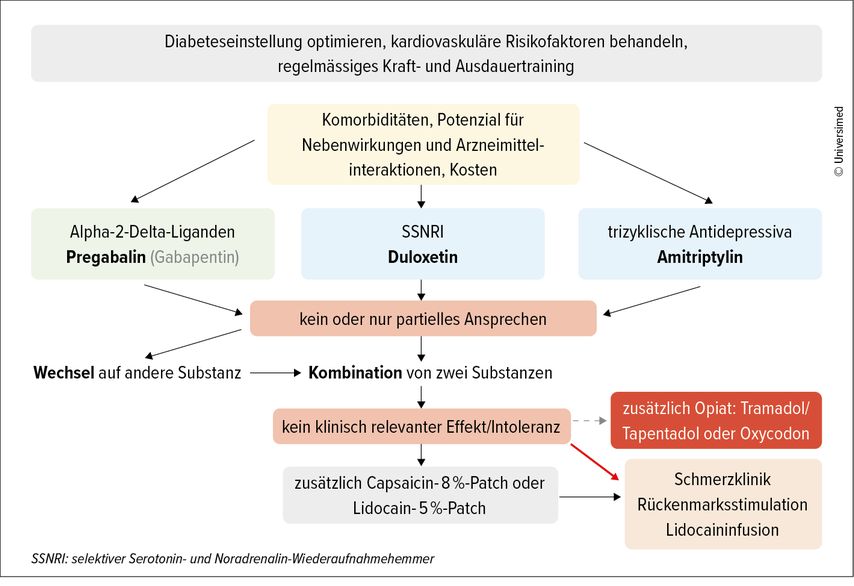
Die meisten Guidelines empfehlen für die Erstlinientherapie Amitriptylin, Duloxetin oder Pregabalin. Häufig verschrieben werden auch Gabapentin sowie Tramadol, Tapentadol und Oxycodon, wobei Opioide wegen des Suchtpotenzials nur sehr zurückhaltend eingesetzt werden sollten (Abb. 2).4–6 Schmerzfreiheit kann meist nicht erreicht werden, ein realistisches Therapieziel ist eine Schmerzreduktion um 30–50%. «Zur Basisbehandlung gehören auch immer eine optimierte Diabeteseinstellung sowie die Kontrolle von kardiovaskulären Risikofaktoren und Lebensstilmassnahmen wie regelmässiges Kraft- und Ausdauertraining», sagte Schimke.
Abb. 2: Praktisches Therapievorgehen bei schmerzhafter distaler diabetischer Neuropathie (adaptiert nach Callaghan B et al. 2012; Pop-Busui R et al. 2017; Preston FG et al. 2023) 4–6
Mit welcher Substanz die Therapie begonnen wird, hängt von den Komorbiditäten, dem Nebenwirkungspotenzial, den Medikamenteninteraktionen und allenfalls den Kosten ab. Bei fehlendem oder ungenügendem Ansprechen wird entweder auf eine andere Substanz gewechselt oder es werden zwei Wirkstoffe miteinander kombiniert. Zusätzlich kann auch ein Capsaicin- oder Lidocainpflaster gegeben werden. Ist keine der Massnahmen zielführend, sollte ein Spezialist beigezogen werden.
Diabetisches Fussulkus und Charcot-Fuss
Zu den gefürchteten diabetischen Spätfolgen gehören das diabetische Fussulkus und der Charcot-Fuss.
«Das Grundübel des diabetischen Fussulkus ist die sensomotorische Neuropathie», erklärte die Referentin. Pathophysiologisch führt die motorische Komponente der Neuropathie zu einer veränderten Biomechanik im Fuss und zu Fussdeformationen, die sensorische Komponente hat eine Einschränkung oder einen Verlust des nozizeptiven Schmerzempfindens zur Folge und die autonome Neuropathie verursacht trophische Veränderung, die Schweisssekretion nimmt ab, die Haut an den Füssen ist trocken und neigt zur Schwielenbildung.
Zur ausgeprägten Schwielenbildung trägt auch bei, dass normalerweise weniger druckexponierte Zonen des Fusses beim Gehen stärker belastet werden. Durch die Schwielen entstehen immer grössere Scherkräfte zwischen der Kutis und der Subkutis, was zur Bildung von subkutanen Blasen, Einblutungen und schliesslich zur Entstehung eines Ulkus führen kann, wenn die Schwielen nicht rechtzeitig abgetragen werden. Kommt noch eine Durchblutungsstörung hinzu, ist die Wundheilung eingeschränkt, wodurch die Gefahr eines Infektes und damit auch das Risiko für eine Amputation steigt.
«Eine weitere, oft nicht erkannte Komplikation, ist der Charcot-Fuss oder die diabetische Neuroosteoarthropathie (DNOAP). Dabei handelt es sich um eine schmerzlose, nicht infektiöse Zerstörung des Fussskeletts», so Schimke. Man nimmt an, dass der Pathogenese eine gewisse Prädisposition zugrunde liegt, die eine lokale Schwächung des Knochens und eine Osteopenie zur Folge hat. Dies führt zusammen mit einem eingeschränkten Schmerzempfinden dazu, dass durch einen Trigger, wie z.B. ein (Bagatell-)Trauma, ein Ulkus oder einen Infekt, eine Entzündungsreaktion ausgelöst wird. Es entstehen Mikrofrakturen, wodurch die Entzündungsreaktion weiter befeuert wird. Wegen des verminderten Schmerzempfindens spürt der Patient nichts und belastet den betroffenen Fuss weiter. All dies setzt einen Circulus vitiosus in Gang, der schliesslich zur Knochenzerstörung führt. «Dieser Prozess kann nur durch eine konsequente Behandlung, primär durch eine Ruhigstellung, unterbrochen werden», sagte die Referentin.
Im ersten, dem aktiven Stadium einer DNOAP findet man klinisch lediglich eine lokale Entzündungsreaktion mit Rötung, Schwellung und Überwärmung, aber noch keine Deformitäten. Das konventionelle Röntgenbild ist in der Regel ohne Befund. «In dieser Situation ist der zwingende nächste Schritt eine MRI», betonte Schimke. Mit dieser Bildgebung können die ersten Veränderungen wie Knochenmarksödem, Mikrofrakturen und Knochenhämatome dargestellt werden. «Wird dieses Stadium verpasst und nicht rechtzeitig behandelt, schreitet der Entzündungsprozess weiter und es kommt zur Destruktion des Fussskeletts und schliesslich zu schweren Deformationen.»
«Foot-Care» ist bei Diabetes zentral
Die Prävention von Fussulzera und die Behandlung von akuten Komplikationen sind zentrale Elemente in der Betreuung von Menschen mit Diabetes. Die Prävention beruht auf dem Erkennen eines Risikofusses, der Edukation der Patient:innen, ihrer Angehörigen und von Fachpersonen, dem Erkennen und Behandeln präulzerativer Läsionen sowie der Versorgung mit geeignetem Schuhwerk. Die Füsse von Diabetesbetroffenen sollten ein- bis viermal jährlich klinisch untersucht werden. «Animieren Sie Ihre Patient:innen aber auch, die Füsse einmal täglich selbst gut anzuschauen und mit einem rückfettenden Präparat zu pflegen. Raten Sie ihnen, mit Wärme und Fussbädern aufzupassen, da wegen des fehlenden Temperaturempfindens die Gefahr einer Verbrühung besteht», so Schimke. Wichtig ist auch eine professionelle Fuss- und Nagelpflege. Seit Januar 2022 werden die Kosten von der Grundversicherung übernommen, wenn die Pflege durch eine zugelassene medizinische Podologin oder einen Podologen erfolgt. Die Behandlung von präulzerativen Läsionen wie das Entleeren von Blasen, die Behandlung von eingewachsenen oder zu dicken Nägeln und von Mykosen sowie das Abtragen von Hautkeratosen kann auch in der Hausarztpraxis durchgeführt werden.
Um einen Risikofuss zu detektieren, empfiehlt sich ein systematisches Vorgehen nach der Pathophysiologie. Hat der Patient keine Fussläsion, sollte immer nach Zeichen für eine Entzündung und eine Neuropathie gesucht werden. «Sind solche Zeichen vorhanden, besteht bis zum Beweis des Gegenteils die Verdachtsdiagnose akuter Charcot-Fuss, der einen Notfall darstellt und sofort entlastet werden sollte», betonte Schimke.
Ist eine Fussläsion vorhanden, muss die Wunde beurteilt werden. Dabei werden folgende Fragen geklärt: Wie ist die Läsion zustande gekommen? Liegt eine neuropathische, eine angiopathische oder eine gemischte Form vor? Wie tief ist die Wunde? Gibt es Anzeichen einer Infektion, allenfalls sogar mit Knochenbeteiligung («probe to bone»)? Wie gut ist die Durchblutung? «Generell gilt: Je tiefer die Wunde, je schlechter durchblutet und je infizierter der Befund ist, desto schlechter ist die Prognose», so die Referentin. Die WIfI-Klassifikation, mit welcher sich das 1-Jahres-Amputationsrisiko abschätzen lässt, beruht genau auf diesen 3 Parametern: Wunde, Ischämie und Fussinfektion.7
Die Behandlung von akuten Komplikationen beinhaltet die Sicherstellung einer guten Perfusion, das Infekt- und Wundmanagement und die Entlastung. «Der letzte Punkt wird leider oft vernachlässigt, obwohl er so wichtig ist. Wenn die Wunde nicht entlastet wird, wird sie nämlich nicht heilen – egal, was Sie auf die Wunde schmieren»,8 gab Schimke zu bedenken. Der Goldstandard für die Entlastung bei neuropathischem Plantarulkus ist der Vollkontaktgips.8,9 Die Heilungsraten liegen bei 70–100% innert 6 bis 12 Wochen, und dies auch bei schon lange bestehenden Wunden.
Quelle:
FOMF Diabetes Update Refresher, 9. bis 12. November 2023, Zürich
Literatur:
1 Andersen ST et al.: Risk factors for incident diabetic polyneuropathy in a cohort with screen-detected type 2 diabetes followed for 13 years: ADDITION-Denmark. Diabetes Care 2018; 41: 1068-75 2 Pop-Busui R et al.: Impact of glycemic control strategies on the progression of diabetic peripheral neuropathy in the Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI 2D) Cohort. Diabetes Care 2013; 36: 3208-15 3 Feldman EL et al.: Diabetic neuropathy. Nat Rev Dis Primers 2019; 5: 42 4 Callaghan B et al.: Diabetic neuropathy: clinical manifestations and current treatments. Lancet Neurol 2012; 11: 521-34 5 Pop-Busui R et al.: Diabetic neuropathy: A position statement by the American Diabetes Association. Diabetes Care 2017; 40: 136-54 6 Preston FG et al.: Painful diabetic peripheral neuropathy: practical guidance and challenges for clinical management. Diabetes Metab Syndr Obes 2023; 16: 1595-612 7 Mills JL Sr et al.; Society for Vascular Surgery Lower Extremity Guidelines Committee: The Society for Vascular Surgery Lower Extremity Threatened Limb Classification System: risk stratification based on wound, ischemia, and foot infection (WIfI). J Vasc Surg 2014; 59: 220-34.e1-2 8 Armstrong DG et al.: It’s not what you put on, but what you take off: techniques for debriding and off-loading the diabetic foot wound. Clin Infect Dis 2004; 39 (Suppl 2): S92-9 9 Petrova NL, Edmonds ME: Charcot neuro-osteoarthropathy-current standards. Diabetes Metab Res Rev 2008; 24 (Suppl 1): S58-61
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...