Der diabetische Fuß – bis zu 34% sind davon betroffen
Autor:
Prim. Priv.-Doz. Dr. Gerd Köhler
Rehabilitationszentrum Aflenz für Stoffwechselerkrankungen mit Schwerpunkt Diabetes mellitus und hochgradige Adipositas
E-Mail: gerd.koehler@pv.at
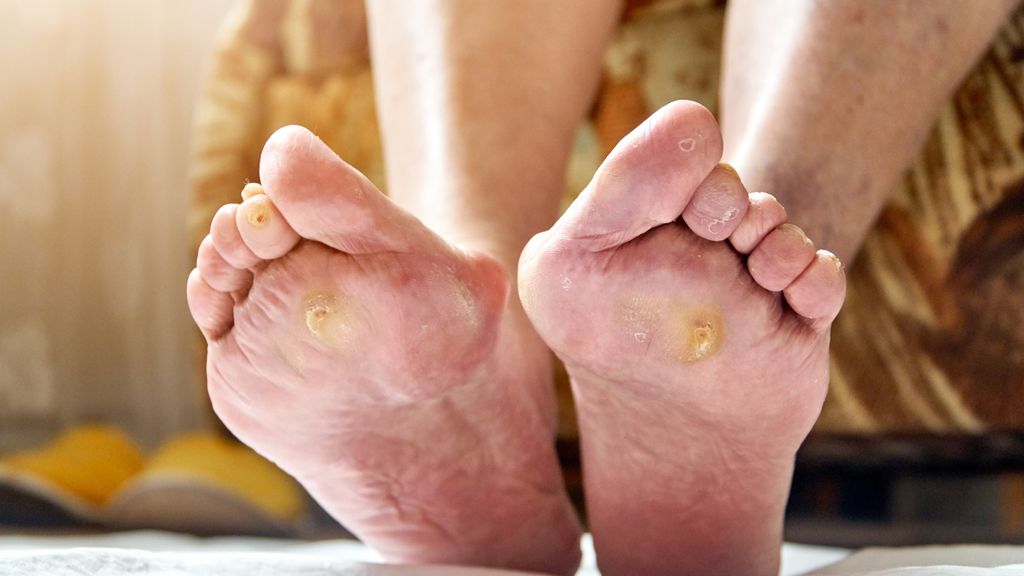
Das diabetische Fußsyndrom (DFS) gehört zu den schwerwiegendsten Folgeerkrankungen des Diabetes mellitus. Bis zu 34% aller Menschen mit Diabetes mellitus entwickeln im Laufe ihrer Erkrankung ein Ulkus am Fuß, alle 20 Sekunden erfolgt auf der Welt eine Amputation bei Menschen mit Diabetes mellitus. Auch in Österreich ist das diabetische Fußsyndrom die Hauptursache für nichttraumatische Amputationen.1
Keypoints
-
Die Prävention des diabetischen Fußes durch ein regelmäßiges Screening auf eine Neuropathie und Inspektion der Füße ist entscheidend.
-
Bei einer Ulzeration sollte ein individuelles Therapieziel abhänig von Begleiterkrankungen und Lebenserwartung definiert werden.
-
Minoramputationen sind keine Lösung, da diese häufig zu Ulzerationen an einer anderen Stelle führen (Transferulzeration).
Epidemiologie
Zahlen über die Häufigkeit des diabetischen Fußes in Österreich existieren nicht. 19–34% aller Menschen mit Diabetes entwickeln im Laufe der Erkrankung ein Ulkus und die weltweite Prävalenz liegt bei 2–10%.
Was ist ein diabetischer Fuß?
Der diabetische Fuß ist definiert als Ulzeration, Infektion oder Gewebsdestruktion an der unteren Extremität bei Menschen mit Diabetes mellitus verursacht durch eine Neuropathie und/oder periphere arterielle Verschlusskrankheit.
Pathogenese
Die Pathogenese des diabetischen Fußsyndroms ist multifaktoriell. 90% aller Menschen mit Diabetes mellitus und diabetischem Fußsyndrom haben eine sensomotorische Neuropathie. Eine periphere arterielle Verschlusskrankheit liegt bei mindestens 50% der Fälle vor. Eine durch verschiedene Faktoren verursachte abnorme biomechanische Belastung in Kombination mit einer eingeschränkten oder fehlenden Sensibilität (LOPS = „loss of protective sensation“) kann zu Ulzerationen am Fuß führen. Die zweithäufigste Ursache für Ulzerationen sind Mikroverletzungen wie zum Beispiel durch nicht passendes Schuhwerk oder eine falsche Fußpflege. Die Neuropathie spielt aufgrund ihrer zusätzlich bestehenden psychologischen Komponente eine wesentliche Rolle im weiteren Verlauf der Erkrankung.
Prävention
Primäres Ziel ist die Prävention des diabetischen Fußsyndroms. Durch eine optimale Stoffwechselkontrolle und Optimierung der kardiovaskulären Risikofaktoren sollten eine diabetische Polyneuropathie und eine periphere arterielle Verschlusskrankheit vermieden werden. Des Weiteren gibt es 5 Schlüsselelemente zur Prävention des DFS:
-
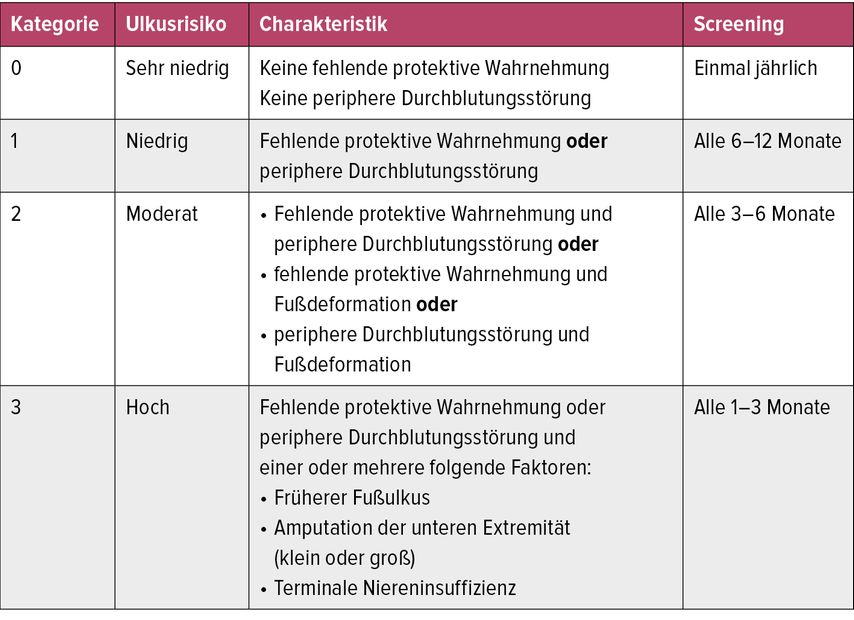
Identifikation eines Risikofußes (Tab.1)2
-
Regelmäßige Inspektion und Untersuchung des Risikofußes
-
Schulung des Patienten, dessen Angehöriger und im Gesundheitsbereich arbeitender Personen
-
Tragen von geeignetem Schuhwerk
-
Behandlung von präulzerösen Läsionen wie z.B. Hornhautschwielen
Tab. 1: Die Screening-Häufigkeit basiert auf Expertenmeinungen – International Working Group on the Diabetic Foot: www.iwgdfguidelines.org
Aufgrund des häufigen psychologisch bedingten Neglects für diese Erkrankung ist die regelmäßige Inspektion von Füßen bei Menschen mit Diabetes und Neuropathie durch Dritte wichtig. Auch auf geeignetes Schuhwerk sollte geachtet werden. Prinzipiell neigen Menschen mit Neuropathie dazu, zu enges Schuhwerk zu bevorzugen, da dann das Gefühl besteht, damit besser gehen zu können. Zur Primärprävention des DFS eignen sich je nach Fußdeformität breites weiches reguläres Schuhwerk wie Sportschuhe über Konfektionsschuhe mit Weichbettungseinlagen bis zu orthopädischen Maßschuhen.
SINBAD-Klassifikation
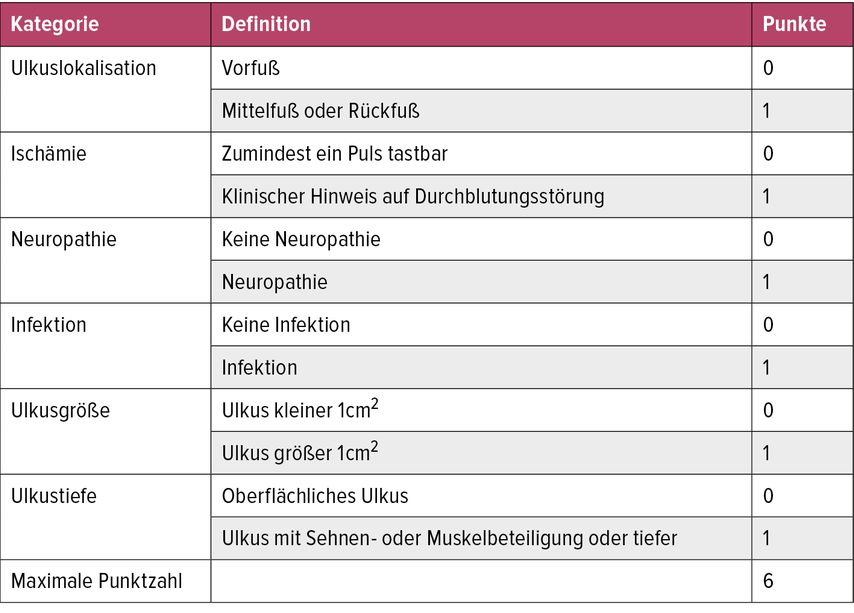
Von den verschiedenen verfügbaren Scores empfiehlt die IWGDF (International Working Group on the Diabetic Foot) aktuell den SINBAD-Score (Tab. 2),2,3 da er einfach anzuwenden ist. Der SINBAD-Score ermöglicht eine Abschätzung über die Wahrscheinlichkeit, ob ein Ulkus abheilt. In einer multizentrischen Studie zeigte sich eine deutliche Verlängerung in der Zeit bis zur Abheilung bei einem SINBAD-Score von 2–3. Bei einem Score von 3 und mehr ist eine Abheilung oft unwahrscheinlich.
Tab. 2: SINBAD-System zur Klassifikation und Bewertung von Fußulzera (modifiziert nach Ince P et al. 2008), in der Übersetzung aus den ÖDG-Leitlinien 2023 (Diabetes Care 2008; 31[5]: 964-7)
Therapie des diabetischen Fußsyndroms
Relevant ist die Klassifikation für die Festlegung des individuellen Therapieziels. Neben der Abheilung einer Ulzeration kann auch die Erhaltung der Mobilität beziehungsweise eine Amputations- und Infektionsvermeidung beim diabetischen Fußsyndrom im Vordergrund stehen. Die Therapie des diabetischen Fußes erfordert einen multiprofessionellen Zugang. Ist das Therapieziel die Abheilung einer Läsion ist die wichtigste und zugleich im täglichen Leben am schwersten umsetzbare therapeutische Maßnahme die Druckentlastung einer Ulzeration. Es gilt der Leitsatz: „Hit hard and early.“ Bei jedem Menschen mit einer Ulzeration am Fuß muss die Durchblutungssituation evaluiert und gegebenenfalls revaskularisiert werden.
Der Goldstandard bei der Entlastung ist ein Vollkontaktgips. Wird dieser vom Patienten mit einem DFS nicht akzeptiert oder toleriert, kann eine abnehmbare Vakuum-Schiene (z.B. VACO® Cast) in Betracht gezogen werden. In der Step-down-Therapie folgen als Empfehlung anpassbare Verbandsschuhe (z.B.: WCS® Verbandschuh).
Praxistipp
Bei diabetischem Fuß gilt der Leitsatz: „Hit hard and early“, denn Ulzerationen an der unteren Extremität sind immer mit einem hohen Amputationsrisiko verbunden.Ulzerationen an der unteren Extremität sind immer mit einem hohen Infektionsrisiko verbunden. Durch die Lage der Knochen am Fuß ist auch eine Osteomyelitis (OM) durch Fortleitung der Infektion häufig. Bei jeder Infektion sollte ein Keimnachweis durch einen tiefen Wundabstrich oder besser durch eine Gewebsprobe angestrebt werden. Bei fehlenden systemischen Infektionszeichen beträgt die Therapiedauer der Antibiose 2 Wochen und bei schweren Infektionen 3 Wochen. Die Therapiedauer einer Knocheninfektion liegt in der Regel bei 6 Wochen. Führt eine antibiotische Therapie bei einer OM nicht zum Erfolg, muss eine chirurgische Sanierung der Osteomyelitis je nach Therapieziel des Patienten in Betracht gezogen werden. Bei Amputation muss immer bedacht werden, dass selbst Minoramputationen durch eine veränderte Biomechanik am Fuß wieder zu neuen Ulzerationen führen können. Man spricht hierbei auch von Transfer-Ulzerationen.
Bei der Lokaltherapie ist die feuchte Wundbehandlung der Standard. Die Evidenz zu Vorteilen einzelner Verbandsstoffe ist rar. Primär gilt, dass die Verbandsauswahl je nach Wundstadium und Exsudation erfolgt. Wundauflagen mit Wirkstoffen inklusive Silber zeigten keinen eindeutigen vorteilhaften Nutzen. Einzig eine Wundauflage mit einer Sucrose-Octasulfat-Imprägnierung zeigte bei nicht infizierten neuroischämischen Fußulzerationen einen signifikanten Vorteil. Trockene Nekrosen sollten trocken gehalten werden. Die hyperbare Sauerstofftherapie (HBO) wird ebenfalls kontroversiell diskutiert und kann daher in Speziallfälen zur Anwendung kommen. Eine Vac-Therapie ist bei postoperativen Wunden ebenfalls erwägbar. Hyperkeratosen behindern die Wundheilung essenziell und sollten ebenso wie Beläge und nekrotisches Gewebe mechanisch entfernt werden.
Charcot-Fuß
Die diabetische Charcot-Osteoarthropathie (DNOAP: diabetische Neuroosteoarthropathie) ist die komplexeste und schwerwiegendste Fußkomplikation. Die Pathophysiologie ist nicht geklärt. Ein Charcot-Fuß präsentiert sich in der akuten Phase als rot, geschwollen und überwärmt. Es besteht eine mehr oder weniger ausgeprägte Fußdeformität durch das Auftreten von Spontanfrakturen. Es besteht die Gefahr, dass die Fußdeformität zu chronischen Ulzerationen und damit zu einer hohen Amputationsgefahr führt. Die Diagnose erfolgt primär klinisch. Ziel einer Behandlung ist es, den akuten Charcot-Fuß mit einer möglichst geringen Fußdeformität in eine chronisch inaktive Form zu überführen. Bei der chronisch inaktiven Form kann damit gerechnet werden, dass die Fußdeformität nicht weiter voranschreitet. Die einzige derzeit anerkannte Behandlungsoption ist eine Druckentlastung für 6–12 Monate, welche im Regelfall mit einem Vollkontaktgips durchgeführt wird. Das Vorliegen eines chronisch inaktiven Charcot-Fußes kann angenommen werden, wenn die Rötung und das Ödem sich zurückgebildet haben und der Temperaturunterschied zum nicht betroffenen Fuß unter 2°C liegt. Der Fuß kann dann mit einem orthopädischen Maßschuh zur Verhinderung von Ulzerationen versorgt werden. Rezidive oder das Auftreten an der kontralateralen Extremität sind keine Seltenheit.
Literatur:
1 Köhler G et al.: Diabetische Neuropathie und diabetischer Fuß (Update 2023). Wien Klin Wochenschr 2023; 135(Suppl 1): S164-S181 2 www.iwgdfguideline.org 3 Ince P et al.: Use of the SINBAD classification system and score in comparing outcome of foot ulcer management on three continents. Diabetes Care 2008; 31(5): 964-7
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...