Diabetes mellitus und Osteoporose: zwei unabhängige Erscheinungen?
Klinische Abteilung für<br>Endokrinologie und Diabetologie<br>Medizinische Universität Graz<br>E-Mail: ha.sourij@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Diabetes mellitus hat einen negativen Einfluss auf die Knochengesundheit, welcher zu einer erhöhten Frakturrate in dieser Population führt. Einerseits hat die metabolische Erkrankung selbst, jedoch auch die medikamentöse Therapie dieser Entität einen Einfluss auf den Knochenstoffwechsel.
Keypoints
-
Forschungsarbeiten konnten ein erhöhtes Frakturrisiko bei Menschen mit Diabeteserkrankungen verifizieren.
-
Die Standardbildgebungsverfahren bilden das Risiko nicht konklusiv ab; an neuen Techniken wird geforscht.
-
Auch Laborparameter weisen Unterschiede bei Menschen mit Diabetes und Vergleichsgruppen ohne Diabetes auf.
-
Beim Zusammenhang spielen nicht nur die diabetische Stoffwechsellage, sondern auch die eingesetzten Medikamente eine entscheidende Rolle.
-
Evidenz und Empfehlungen wurden in Form einer Leitlinie zu Diabetes und Osteoporose zusammengefasst.
Lange Zeit wurde der Zusammenhang zwischen Osteoporose und Diabetes mellitus unterschätzt.1 Mittlerweile konnten jedoch zahlreiche Studien ein erhöhtes Frakturrisiko bei Menschen mit Diabeteserkrankungen verifizieren.2–7 Dabei konnte eine Erhöhung des relativen Risikos für osteoporotische Frakturen von 1,2 bis 1,8, bei männlichen Patientensogar bis 2,4, gezeigt werden. Das Frakturrisiko ist bei Patienten mit Typ-2-Diabetes in etwa doppelt so hoch wie in der Vergleichspopulation ohne Diabetes. Die pathophysiologischen Zusammenhänge zwischen Typ-2-Diabetes und Osteoporose sind derzeit nicht gänzlich geklärt. Als Ursache werden u.a. eine zellschädigende Wirkung auf Osteoblasten und die Hemmung osteoblastenstimulierender Faktoren durch vermehrten oxidativen Stress und Inflammationsprozesse, welche bei hyperglykämischer Stoffwechsellage auftreten, angenommen.8,9 Eine weitere Schlüsselrolle spielt Sklerostin, ein von den Osteozyten sezernierter Wirkstoff, der bei Patienten mit Diabetes mellitus erhöht ist und eine hemmende Wirkung auf Osteoblasten und damit die Osteogenese ausübt.10 Auch Langzeitkomplikationen wie die diabetische Polyneuropathie und Retinopathie tragen über sensomotorische Defizite und Visusverminderung zu erhöhter Sturzneigung und einem dadurch bedingt erhöhten Frakturrisiko bei.11
Bildgebung
Der übliche diagnostische Goldstandard in der Einschätzung des Frakturrisikos in der Allgemeinpopulation ist die Dual-X-ray-Absorptiometrie (DXA). Bei Menschen mit Typ-2-Diabetes zeigten Untersuchungen jedoch, dass die DXA kein adäquates Tool zur Frakturprädiktion darstellt, da paradoxerweise sogar erhöhte (bessere) Knochendichtewerte vor allem beiMenschen mit Typ-2-Diabetes in der DXA vorliegen.12
Aktuelle Studien untersuchen die Rolle und einen etwaigen Vorteil des hochauflösenden peripheren quantitativen CT (HR-pQCT) in diesem Patientenkollektiv. Bisherige HR-pQCT-Studien verifizierten – ähnlich wie die Osteodensitometrie – sogar erhöhte volumetrische Knochendichtewerte bei diabetischer Stoffwechsellage.13 Weitere Arbeiten auf diesem Gebiet laufen derzeit an unserer Abteilung in Graz.
Laborparameter
Auch die im Serum gemessenen Knochenumbauparameter weisen Unterschiede bei Menschen mit Diabetes und Vergleichsgruppen auf.14 Osteocalcin, ein Marker der Osteoblastenaktivität und damit ein Vertreter der Knochenaufbaumarker, zeigte sich bei Patienten mit Diabetes mellitus erniedrigt.15 Hingegen zeigen Knochenabbaumarker heterogene Ergebnisse (kein Unterschied der Telopeptide [CTx, β-Crosslaps], widersprüchliche Ergebnisse bei anderen Knochenabbaumarkern).11,15,16 Ferner wird ein direkter Einfluss von Osteocalcin auf den Insulinrezeptor vermutet, da im Tiermodell eine Verbesserung der Glukosetoleranz und Insulinsensitivität durch vermehrte Osteocalcinexpression nachgewiesen wurde.17,18
Einflussfaktor antidiabetische Therapie
Ein anfangs unterschätzter, inzwischen jedoch vielfach bestätigter negativer Effekt der Insulin- sowie auch der oralen antidiabetischen Therapie trägt ebenfalls zu einer erhöhten Knochenfragilität bei. Eine verminderte Knochendichte findet sich bereits bei insulintherapierten Kindern und Jugendlichen.38 Auch bei Erwachsenen mit Diabetes mellitus Typ 2 und sekundärer Insulinpflichtigkeit konnte eine erhöhte Frakturinzidenz demonstriert werden.21, 22 Auch Hypoglykämie-assoziierte Stürze dürften zu einem erhöhten Frakturrisiko beitragen. Schlüsse zur Kausalität des negativen Einflusses einer Insulintherapie auf den Knochenstoffwechsel können jedoch aus derzeitiger Sicht nicht gezogen werden.
Im Gegensatz zur Insulintherapie weist das als orale Erstlinientherapie verwendete Metformin einen neutralen und in manchen Studien sogar einen protektiven Knocheneffekt auf.19–22 Wie auch seine antidiabetische Wirkung ist der knochenprotektive Mechanismus dabei nicht vollständig geklärt. Ein Mechanismus könnte die Differenzierung und Mineralisierung der Osteoblasten durch Aktivierung der AMP-aktivierten Proteinkinase sein.23
Der am stärksten ausgeprägte negative Effekt unter den antidiabetischen Medikamentengruppen konnte bisher bei Thiazolidindionen (Glitazone) gefunden werden, welche als Liganden der nukleären Hormonrezeptorfamilie PPAR-γ eine verstärkte Differenzierung von Präadipozyten zu Adipozyten induzieren und dadurch die Differenzierung zu Osteoblasten hemmen.24 Die dadurch reduzierte Knochenmasse resultiert in einer erhöhten Frakturrate insbesondere bei postmenopausalen Frauen.25 In den Leitlinien der Österreichischen Diabetes Gesellschaft wird auf die erhöhte Frakturinzidenz hingewiesen, in den Leitlinien des Dachverbands Osteologie wird die Therapie mit Thiazolidindionen bereits als wesentlicher Risikofaktor für Osteoporose berücksichtigt.
Bei den oft verwendeten Sulfonylharnstoffen ist die Datenlage unklar. Während einige Untersuchungen einen protektiven Effekt auf den Knochen verifizierten,21,22,26, 27
zeigen andere Studien eine erhöhte Frakturinzidenz.28 Aus Sicht der Autoren ist diese Medikamentengruppe jedenfalls nicht nur aufgrund dieses möglicherweise negativen Einflusses, sondern auch aufgrund der Hypoglykämiegefahr und der damit einhergehenden Sturzgefahr vor allem für die ältere Population mit Vorsicht anzuwenden.
PraXiStiPP
Bei Menschen mit Diabetes besteht ein erhöhtes Frakturrisiko, daher ist es bei der Wahl der antidiabetischen Therapie wichtig, das individuelle Frakturrisiko des Patienten zu berücksichtigen.Zu den restlichen Medikamentengruppen lassen sich nur bedingt Rückschlüsse hinsichtlich osteologischer Auswirkungen ziehen, da die Datenlage einerseits überschaubar ist und teils heterogene Ergebnisse zeigt und sich andererseits der Großteil der Studien nicht auf diese Fragestellung fokussiert hat. Bei inkretinbasierten Therapien (DPP-4-Hemmer und GLP-1-Rezeptoragonisten) konnte bislang kein negativer Effekt gefunden werden,28–31 eine Metaanalyse postulierte sogar einen positiven Effekt hinsichtlich des Frakturrisikos.32 In der Gruppe der SGLT2-Hemmer konnte ein neutraler Effekt,33–36 vereinzelt aber eine erhöhte Frakturinzidenz vor allem für Canagliflozin37 nachgewiesen werden. Die pathophysiologischen Mechanismen hierzu sind unklar und es bedarf dazu weiterer Untersuchungen.
Fazit
Zusammenfassend lässt sich feststellen, dass Glukosestoffwechselstörungen und erhöhte Knochenfragilität keine unabhängigen Erscheinungen sind, sondern einen verzweigten Zusammenhang im Rahmen eines multifaktoriellen Krankheitsgeschehen haben. Dabei spielen nicht nur die diabetische Stoffwechsellage per se, sondern auch die eingesetzten Medikamente eine entscheidende Rolle. Auch wenn noch weitere Daten zu den einzelnen antihyperglykämischen Substanzen und deren Einfluss auf die Knochengesundheit notwendig sind, so hat die ÖDG gemeinsam mit der ÖGKM die aktuelle Evidenz und Empfehlungen in Form einer gemeinsamen Leitlinie zu Diabetes und Osteoporose zusammengefasst. Die Abbildung 1 entstammt in modifizierter Darstellung dieser Leitlinie.39
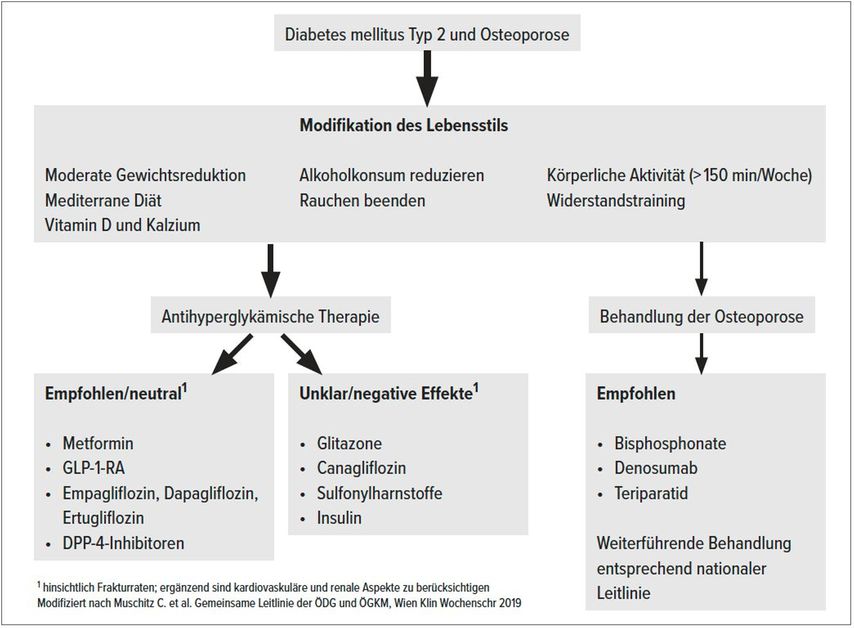
Abb. 1: Modifizierte Darstellung der gemeinsamen Leitlinie der ÖDG und der ÖGKM zu Diabetes und Osteoporose – aktuelle Evidenz und Empfehlungen39
Literatur:
1 Botushanov NP, Orbetzova MM: Bone mineral density and fracture risk in patients with type 1 and type 2 diabetes mellitus. Folia Med (Plovdiv) 2009; 51(4): 12-72 Bonds DE et al.: Risk of fracture in women with type 2 diabetes: the Women’s Health Initiative Observational Study. J Clin Endocrinol Metab 2006; 91(9): 3404-10 3 Holmberg AH et al.: Risk factors for fragility fracture in middle age. A prospective population-based study of 33,000 men and women. Osteoporos Int 2006; 17(7): 1065-77 4 Janghorbani M et al.: Prospective study of diabetes and risk of hip fracture: the Nurses’ Health Study. Diabetes Care 2006; 29(7): 1573-8 5 de Liefde II et al.: Bone mineral density and fracture risk in type-2 diabetes mellitus: the Rotterdam Study. Osteoporos Int 2005; 16(12): 1713-20 6 Vestergaard P et al.: Diabetes and ist complications and their relationship with risk of fractures in type 1 and 2 diabetes. Calcif Tissue Int 2009; 84(1): 45-55 7 Strotmeyer ES et al.: Nontraumatic fracture risk with diabetes mellitus and impaired fasting glucose in older white and black adults: the Health, Aging, and Body Composition Study. Arch Intern Med 2005; 165(14): 1612-17 8 Jiao H et al.: Diabetes and Its effect on bone and fracture healing. Curr Osteoporos Rep 2015; 13 (5): 327-35 9 Yan W, Li X: Impact of diabetes and its treatments on skeletal diseases. Front Med 2013; 7 (1): 81-90 10 Winkler DG et al.: Osteocyte control of bone formation via sclerostin, a novel BMP antagonist. EMBO J. 2003; 22(23): 6267-76 11 Gilbert MP, Pratley RE: The impact of diabetes and diabetes medications on bone health. Endocr Rev 2015; 36(2): 194-213 12 Vestergaard P.: Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes–a meta-analysis. Osteoporos Int 2007; 18(4): 427-44 13 Petit MA et al.: Bone mass and strength in older men with type 2 diabetes: the Osteoporotic Fractures in Men Study. J Bone Miner Res 2010; 25(2): 285-91 14 Rico H et al.: Suggestion of a deficient osteoblastic function in diabetes mellitus: the possible cause of osteopenia in diabetics. Calcif Tissue Int 1989; 45(2): 71-3 15 Achemlal L et al.: Bone metabolism in male patients with type 2 diabetes. Clin Rheumatol 2005; 24(5): 493-6 16 Suzuki K et al.: Osteoclastic function is accelerated in male patients with type 2 diabetes mellitus: the preventive role of osteoclastogenesis inhibitory factor/osteoprotegerin (OCIF/OPG) on the decrease of bone mineral density. Diabetes Res Clin Pract 2005; 68(2): 117-25 17 Lee NK et al.: Endocrine regulation of energy metabolism by the skeleton. Cell 2007; 130(3): 456-69 18 Ferron M et al.: Intermittent injections of osteocalcin improve glucose metabolism and prevent type 2 diabetes in mice. Bone. 2012; 50(2): 568-7519 Mai QG et al.: Metformin stimulates osteoprotegerin and reduces RANKL expression in osteoblasts and ovariectomized rats. J Cell Biochem 2011; 112(10): 2902-920 Borges JL et al.: Arandomized, parallel group, double-blind, multicentre study comparing the efficacy and safety of Avandamet (rosiglitazone/metformin) and metformin on long-term glycaemic control and bone mineral density after 80 weeks of treatment in drug-naive type 2 diabetes mellitus patients. Diabetes Obes Metab 2011; 13(11): 1036-46 21 Vestergaard P et al.: Relative fracture risk in patients with diabetes mellitus, and the impact of insulin and oral antidiabetic medication on relative fracture risk. Diabetologia 2005; 48(7): 1292-9 22 Monami M et al.: Bone fractures and hypoglycemic treatment in type 2 diabetic patients: a case-control study. Diabetes Care 2008; 31(2): 199-203 23 Kanazawa I et al.: Adiponectin and AMP kinase activator stimulate proliferation, differentiation, and mineralization of osteoblastic MC3T3–E1 cells. BMC Cell Biol 2007; 8: 51 24 Ali AA et al.: Rosiglitazone causes bone loss in mice by suppressing osteoblast differentiation and bone formation. Endocrinology 2005; 146(3): 1226-35 25 Habib ZA et al.: Thiazolidinedione use and the longitudinal risk of fractures in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab 2010; 95(2): 592-600 26 Kanazawa I et al.: Relationship between treatments with insulin and oral hypoglycemic agents versus the presence of vertebral fractures in type 2 diabetes mellitus. J Bone Miner Metab 2010;28(5):554-6027 Zinman Bet al.: Effect of rosiglitazone, metformin, and glyburide on bone biomarkers in patients with type 2 diabetes. J Clin Endocrinol Metab 2010;95(1):134-42 28 Majumdar SR et al.: Does sitagliptin affect the rate of osteoporotic fractures in type 2 diabetes? Population-based cohort study. J Clin Endocrinol Metab 2016; 101(5): 1963-9 29 Josse RG et al.: Sitagliptin and risk of fractures in type 2 diabetes: Results from the TECOS trial. Diabetes Obes Metab 2017; 19(1): 78-86 30 Bunck MC et al.: Exenatide treatment did not affect bone mineral density despite body weight reduction in patients with type 2 diabetes. Diabetes Obes Metab 2011; 13(4): 374-7 31 Mabilleau G et al.: Use of glucagon-like peptide-1 receptor agonists and bone fractures: a meta-analysis of randomized clinical trials. J Diabetes 2014; 6(3):260-6 32 Monami M et al.: Dipeptidyl peptidase-4 inhibitors and bone fractures: a metaanalysis of randomized clinical trials. Diabetes Care 2011; 34(11): 2474-6 33 Strojek K et al.: Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with glimepiride: a randomized, 24-week, double-blind, placebo-controlled trial. Diabetes Obes Metab 2011; 13(10): 928-38 34 Ricci TA et al.: Moderate energy restriction increases bone resorption in obese postmenopausal women. Am J Clin Nutr 2001;73(2):347-52 35 Ljunggren Ö et al.: Dapagliflozin has no effect on markers of bone formation and resorption or bone mineral density in patients with inadequately controlled type 2 diabetes mellitus on metformin. Diabetes Obes Metab 2012; 14(11): 990-9 36 Mahaffey KW et al.: Canagliflozin and cardiovascular and renal outcomes in type 2 diabetes mellitus and chronic kidney disease in primary and secondary cardiovascular prevention groups. Circulation 2019; 140(9): 739-50 37 Carbone S, Dixon DL: The CANVAS Program: implications of canagliflozin on reducing cardiovascular risk in patients with type 2 diabetes mellitus. Cardiovasc Diabetol 2019; 18(1): 64 38 Raisingani M et al.: Skeletal growth and bone mineral acquisition in type 1 diabetic children; abnormalities of the GH/IGF-1 axis. Growth Horm IGF Res 2017; 34: 13-21 39 Muschitz C et al.: Diagnose und Management der Osteoporose bei Diabetes mellitus (Update 2019). Gemeinsame Leitlinie der Österreichischen Gesellschaft für Knochen- und Mineralstoffwechsel und der Österreichischen Diabetes Gesellschaft. Wien Klin Wochenschr2019; 131 (Suppl. 1): S174-S185
Das könnte Sie auch interessieren:
Diabetes erhöht das Sturzrisiko deutlich
Eine dänische Studie kommt zu dem Ergebnis, dass sowohl Patienten mit Typ-1- als auch Patienten mit Typ-2-Diabetes öfter stürzen und häufiger Frakturen erleiden als Menschen aus einer ...
Notfall Diabetische Ketoazidose: Leitliniengerechtes Handeln kann Leben retten
Akute Stoffwechselentgleisungen können lebensbedrohlich sein und erfordern eine rasche und leitliniengerechte Diagnostik und Therapie. Pathogenese, Klinik, typische Befunde und die ...
Wie oft wird Diabetes nicht oder spät erkannt?
Im Allgemeinen wird von einer hohen Dunkelziffer an Personen mit undiagnostiziertem Typ-2-Diabetes ausgegangen. Ein Teil davon sind von Ärzten „übersehene“ Fälle. Eine von der University ...