Wie denkt und lenkt die künstliche Intelligenz?
Autoren:
Dr. Sebastian Sitaru1
Priv.-Doz. Dr. Dr. Alexander Zink1, 2
1 Klinik und Poliklinik für Dermatologie und Allergologie
Klinikum rechts der Isar der Technischen Universität München
2 Division of Dermatology and Venereology
Department of Medicine Solna
Karolinska Institutet, Stockholm
E-Mail: sebastian.sitaru@tum.de
Wir alle lesen und hören immer wieder von künstlicher Intelligenz. Doch was genau ist KI und was sind aktuelle und zukünftige Einsatzbereiche in der Dermatologie und darüber hinaus?
Was ist künstliche Intelligenz?
Künstliche Intelligenz (KI) beschreibt Algorithmen, die bestimmte Eigenschaften eines großen Datensatzes „lernen“ können, um sie anschließend erfolgreich auf neue, bislang noch nicht gesehene Daten anzuwenden.1 Insbesondere durch neue, komplexe KI-Modelle wie z.B. ChatGPT, die es vermögen, lesbaren, formell korrekten Text über eine erstaunliche Themenbreite zu generieren, ist KI auch in der Allgemeinbevölkerung angekommen. Doch was ist KI genau?
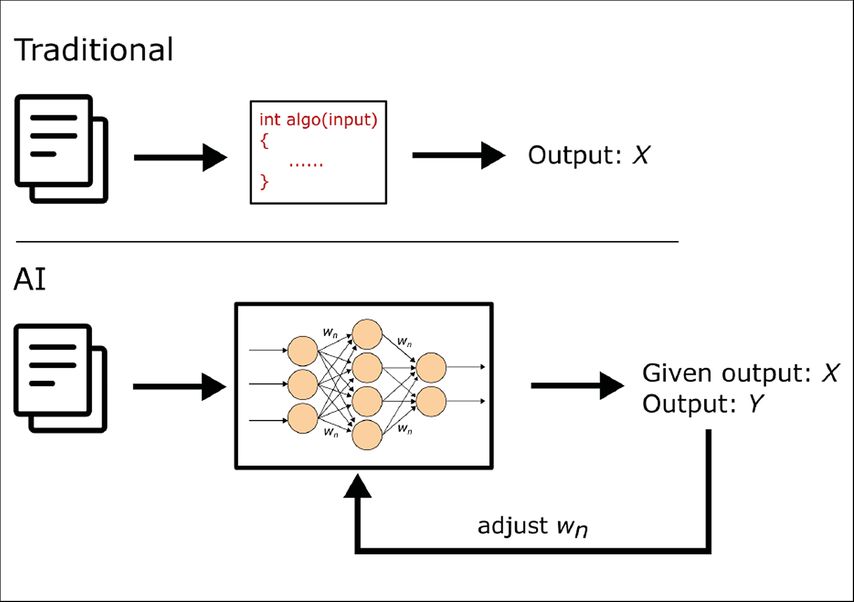
Ein KI-Algorithmus besteht grob gesagt aus einer Architektur, also einem Design, und Parametern, also veränderbaren Größen in dieser Architektur. Eines der wichtigsten, mächtigsten und in der Medizin am weitesten verbreiteten Designs sind faltende neuronale Netzwerke („convolutional neural networks“, CNN). Diese orientieren sich am biologischen Design der Neurone und bestehen aus verschiedenen Knoten, die mit mathematischen Funktionen miteinander verknüpft sind (Abb. 1). Um KI-Algorithmen zu entwickeln, muss also zunächst eine Architektur designt werden, z.B. ein neuronales Netz. Danach kann der Algorithmus „trainiert“ werden, wobei ihm Daten mit dem gewünschten Outcome zur Verfügung gestellt werden und die internen Parameter automatisch so angepasst werden, um dieses Outcome mit einem möglichst geringen Fehler zu erreichen. Im nächsten Schritt wird der Algorithmus auf neuen, bisher noch nicht gesehenen Daten getestet (Validierung). Die Datensätze zum Trainieren und Validieren von KI-Algorithmen müssen hochstrukturiert und für die jeweilige Fragestellung geeignet sein. Im Gegenzug bedeutet dies, dass KI-Algorithmen üblicherweise spezifisch für diese Fragestellung sind, für die sie trainiert wurden.1 KI-Algorithmen eignen sich vor allem zur Mustererkennung in riesigen Datenmengen und zeigen z.B. bei der Klassifizierung von hochdimensionalen Daten wie Bildern exzellente Ergebnisse.2 Dabei können sie auch Muster erkennen, die sich der menschlichen Wahrnehmung entziehen, sowie riesige Datenmengen auf einmal verarbeitet werden. Die Performance von KI-Algorithmen wird auf verschiedenen Wegen gemessen, z.B. können Sensitivität, Spezifität, Genauigkeit („accuracy“) oder eine Receiver-Operator-Characteristics-Kurve (ROC-Kurve; Sensitivität gegen Spezifität) angegeben werden.1
KI-Algorithmen sind bereits seit Langem in der medizinischen Forschung und teilweise auch in der medizinischen Praxis angekommen. Insbesondere für die Bildanalyse in der Radiologie existieren viele Systeme in Forschung und Klinik.3 Auch in der Dermatologie wird KI breit erforscht, und besonders in der Dermatoonkologie gibt es erste marktreife Produkte.4
KI in der Dermatologie
In der Dermatologie gibt es insbesondere für die Malignitätseinschätzung von Bildern, Unterstützung bei der histopathologischen Auswertung und der Therapieauswahl und Prognose von Hautkrebs bereits spannende KI-Ansätze. 2017 konnte gezeigt werden, dass ein mit knapp 130000 klinischen Bildern und den dazugehörigen histologischen Diagnosen trainierter KI-Algorithmus eine ähnliche diagnostische Performance wie 21 Fachärzte bei der Differenzierung von nicht melanozytärem Hautkrebs und benigner seborrhoischer Keratose bzw. malignem Melanom und benignem Nävus erreichte.5 Mittlerweile wurden diese KI-Algorithmen noch weiter verfeinert und sind bereits teilweise als Medizinprodukte in Europa zugelassen (z.B. FotoFinder Moleanalyzer Pro).6,7 Durch Kombination von Bilddaten mit Patientendaten kann die Performance dieser Algorithmen noch weiter gesteigert werden.8 In der Dermatohistopathologie wurden KI-Algorithmen beschrieben, die z.B. die Resektionsränder bei Basalzellkarzinomexzisionen automatisiert beurteilen können.9 Auch Ansätze, den BRAF-Status von Melanomen alleine aus klinischen Daten und histopathologischen Standardschnitten mittels KI vorauszusagen, wurden bereits untersucht.10 Als klinische Entscheidungshilfen („clinical decision support system“) sind KI-Algorithmen beschrieben worden, die z.B. bei der Entscheidung Exzision/Nichtexzision von melanozytären Läsionen helfen, eine 5-Jahres-Überlebensprognose beim Melanom geben oder das Therapieansprechen auf Immuntherapie beim Melanom voraussagen können.11–13 Noch wenig erforscht ist die KI-gestützte Analyse der Daten neuer diagnostischer Verfahren wie LC-OCT („line-field confocal optical coherence tomography“).14 Dieses Verfahren erlaubt eine standardisierte 3D-Aufnahme der Haut auf zellulärer Ebene in Echtzeit und kann so bei der Diagnose von entzündlichen und malignen Hauterkrankungen helfen.15 Erste KI-Ansätze haben die dermoepidermale Junktionszone automatisch aus LC-OCT-Daten identifiziert oder Zellkerne hinsichtlich Atypien beurteilt.16,17
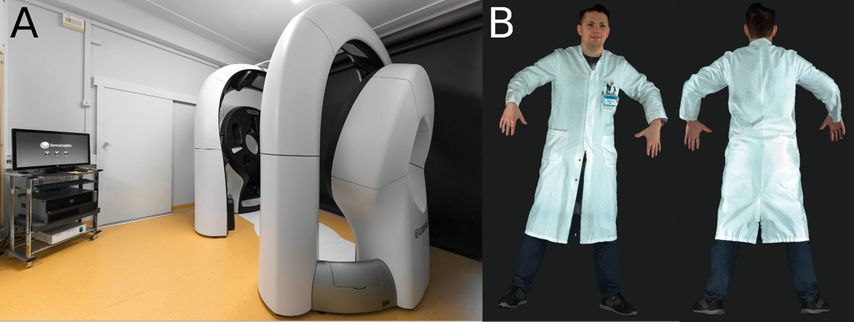
Jedoch weisen aktuelle KI-Algorithmen auch Limitationen auf. So können z.B. Markierungen mit Hautstiften oder Maßstabsbalken die Performance von KI-Algorithmen zur Bildanalyse signifikant verschlechtern.18,19 Auch ein aktuell großes Problem beim Einsatz von KI ist die Standardisierung von Bildern. Im klinischen Alltag ist es oft schwierig, qualitativ gleichbleibend gute und standardisierte Bilder zu produzieren. Hier können neue Tools wie z.B. LC-OCT oder der 3D-Ganzkörperscanner in der Zukunft helfen.20
Perspektiven der KI in der Dermatologie
Die Dermatologie bietet mit ihrem Datenreichtum, wie z.B. klinischen und dermatologischen Bildern, histopathologischen Schnitten und neuerdings auch 3D-Ganzkörperscans, eigentlich gute Voraussetzungen für den Einsatz von KI-Algorithmen. Insbesondere die 3D-Ganzkörperscanner erlauben eine schnelle und hochstandardisierte Aufnahme fast der gesamten Hautoberfläche und bieten so eine optimale Grundlage für KI-Analyse20 (Abb. 2).Eine andere Quelle für Daten könnten in Zukunft tragbare Sensoren („wearables“) sein, die wiederum eine komplett neue Dimension in der Dermatologie eröffnen und sich durch die standardisierten, digitalen Daten gut für die KI-Analyse eignen.21
Auch der große Bereich der entzündlichen Hauterkrankungen wurde bislang in der dermatologischen KI-Forschung nur zögerlich angegangen, wobei aber erste Arbeiten den Einsatz von KI bei der automatischen Beurteilung der Lokalisation von entzündlichen Hauterkrankungen zeigen.22
Die Anwendung von KI in der Medizin und Dermatologie muss jedoch gezielt und mit einem Grundverständnis der technischen Hintergründe erfolgen. KI-Algorithmen dürfen nicht als Ersatz einer ärztlichen Diagnose oder Meinung verstanden werden, sondern eher als zusätzlicher Befund wie z.B. ein Laborparameter, der einer Einordnung in den medizinischen Gesamtkontext bedarf.
Insgesamt lässt sich aber sicherlich eine spannende Zukunft für künstliche Intelligenz in der Dermatologie identifizieren, wobei insbesondere in der Dermatohistopathologie, bei der Auswertung der Daten neuer Tools wie LC-OCT, 3D-Ganzkörperscanner, Wearables sowie bei der Beurteilung entzündlicher Hauterkrankungen wahrscheinlich das größte Potenzial besteht.
Literatur:
1 MintzY, Brodie R: Introduction to artificial intelligence in medicine. Minim Invasive Ther Allied Technol 2019; 28(2): 73-81 2 Dai Z et al.: CoAtNet: Marrying Convolution and Attention for All Data Sizes. ArXiv:2106.04803 Cs (2021); https://doi.org/10.48550/arXiv.2106.04803 3 Hosny A et al.: Artificial intelligence in radiology. Nat Rev Cancer 2018; 18(8): 500-10 4 Sitaru S, Zink A: Digitalisierung in der Dermatoonkologie: künstliche Intelligenz zur Diagnostik. Best Pract Onkol 2023; 18: 20-26 5 Esteva A et al.: Dermatologist-level classification of skin cancer with deep neural networks. Nature 2017; 542(7639): 115-8 6 Haenssle H A et al.: Man against machine: diagnostic performance of a deep learning convolutional neural network for dermoscopic melanoma recognition in comparison to 58 dermatologists. Ann Oncol 2018; 29(8): 1836-42 7 Haenssle HA et al.: Skin lesions of face and scalp – Classification by a market-approved convolutional neural network in comparison with 64 dermatologists. Eur J Cancer 2021; 144: 192-9 8 Liu Y et al.: A deep learning system for differential diagnosis of skin diseases. Nat Med 2020; 26(6): 900-8 9 Le’Clerc Arrastia J et al.: Deeply Supervised UNet for Semantic Segmentation to Assist Dermatopathological Assessment of Basal Cell Carcinoma. J Imaging 2021; 7(4): 71 10 Figueroa-Silva O et al.: Machine Learning Techniques in Predicting BRAF Mutation Status in Cutaneous Melanoma From Clinical and Histopathologic Features. Appl. Immunohistochem Mol Morphol 2022; 30(10): 674-80 11 Gilmore SJ et al.: Automated decision support in melanocytic lesion management. PloS 2018; 13(9): e0203459 12 Liu M, Xu Y: Gene Identification and Potential Drug Therapy for Drug-Resistant Melanoma with Bioinformatics and Deep Learning Technology. Dis Markers 2022; 2461055: 13 Johannet P et al.: Using Machine Learning Algorithms to Predict Immunotherapy Response in Patients with Advanced Melanoma. Clin Cancer Res 2021; 27(1): 131-140 14 Schuh S et al.: Konfokale Line-Field-OCT. Hautarzt 2021; 72(12): 1039-47 15 Perez-Anker J et al.: Morphological evaluation of melanocytic lesions with three-dimensional line-field confocal optical coherence tomography: correlation with histopathology and reflectance confocal microscopy. A pilot study. Clin Exp Dermatol 2022; 47(12): 2222-33 16 Chou HY et al.: Dermal epidermal junction detection for full-field optical coherence tomography data of human skin by deep learning. Comput Med Imaging Graph 2021; 87: 101833 17 Fischman S et al.: Non-invasive scoring of cellular atypia in keratinocyte cancers in 3D LC-OCT images using Deep Learning. sci Rep 2022; 12(1): 481 18 Winkler JK et al.: Association Between Surgical Skin Markings in Dermoscopic Images and Diagnostic Performance of a Deep Learning Convolutional Neural Network for Melanoma Recognition. JAMA Dermatol 2019; 155(10): 1135-41 19 Winkler J K et al.: Association between different scale bars in dermoscopic images and diagnostic performance of a market-approved deep learning convolutional neural network for melanoma recognition. Eur J Cancer 2021; 145: 146-54 20 Sitaru S et al.: [3D whole body scans in dermatology-a new era in clinical practice and research?]. Dermatol Heidelb Ger 2022; 73: 575-79 21 Kiani C et al.: Wearables and smart skin as new tools for clinical practice and research in dermatology. JEADV Clin Pract 2022; 22 Sitaru S et al.: Automatic body part identification in real-world clinical dermatological images using machine learning. J. Dtsch Dermatol Ges. 2023;
Das könnte Sie auch interessieren:
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...
Zentrale Aspekte bei atopischer Dermatitis
Über die medikamentöse Therapie hinaus bleiben die Berücksichtigung von Umweltfaktoren, die Sicherstellung der Adhärenz und die Anpassung der Therapie an Begleiterkrankungen oder ...
Neuer Wirkstoff bei Acne vulgaris
Acne vulgaris führt vor allem während der Pubertät zu Leidensdruck bei Betroffenen. Zur Behandlung stehen je nach Ausprägung verschiedene Therapeutika zur Verfügung, kürzlich wurde der ...