Relugolix im Vergleich zu Degarelix bei Patienten mit Prostatakrebs
Autor:
Dr. Reza Sari Motlagh
Universitätsklinik für Urologie
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Vor Kurzem hat die US-amerikanische Gesundheitsbehörde (FDA) Relugolix, einen oralen Antagonisten des Gonadotropin-Releasing-Hormons (GnRH), für die Behandlung von Patienten mit fortgeschrittenem Prostatakrebs (PCa) zugelassen. Ziel einer Netzwerk-Metaanalyse, über die im Folgenden berichtet wird, war die indirekte Bewertung der 12-Monats-Wirksamkeit und Sicherheit von Degarelix im Vergleich zu Relugolix.
Keypoints
-
Die 12-Monats-Kastrationsrate und die Nebenwirkungsrate der oralen GnRH-Antagonisten sind mit denen der parenteralen GnRH-Antagonisten vergleichbar, und beide sind denen der GnRH-Agonisten überlegen, mit Ausnahme der Dreimonatsformulierung von Degarelix (480 mg).
-
Relugolix ist vielversprechend, um die Reaktion an der Injektionsstelle zu überwinden, die das Haupthindernis für die Anwendung von Degarelix ist.
-
Bis zu einer längeren Nachbeobachtung müssen wir jedoch hinsichtlich des breiten klinischen Einsatzes von Relugolix und seiner schwerwiegenden Nebenwirkungen Vorsicht walten lassen.
Die vorteilhaften Eigenschaften von GnRH-Antagonisten (z.B. Degarelix) gegenüber GnRH-Agonisten wurden als Androgendeprivationstherapie (ADT) bei PCa-Patienten nachgewiesen. Die hohe Ansprechrate an der Injektionsstelle (circa 40%) und die Notwendigkeit einer monatlichen Injektion können jedoch zu einem suboptimalen Einsatz von Degarelix in der klinischen Praxis führen. Bislang wurde Relugolix nicht direkt mit Degarelix verglichen, und es muss geklärt werden, ob diese neue Formulierung von Antagonisten unterschiedliche Wirksamkeits- und Sicherheitsprofile aufweist.
Was waren die wichtigsten Ergebnisse?
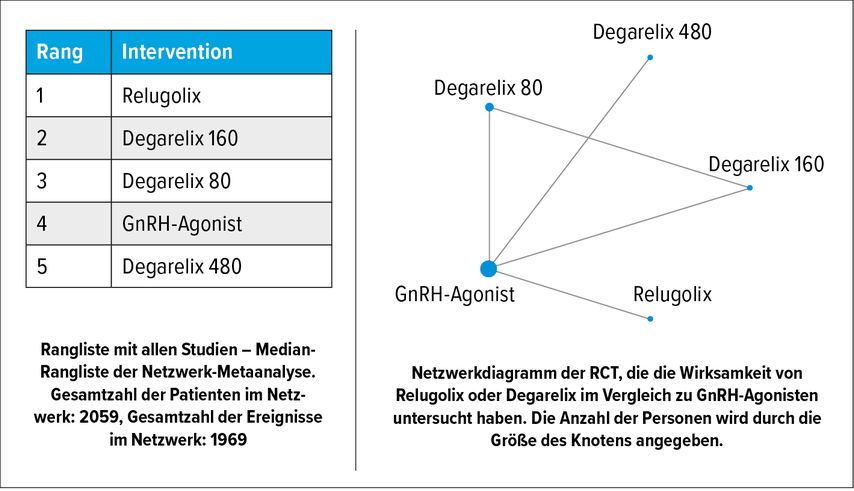
Hinsichtlich der 12-Monats-Kastrationsrate wurden eine Haupt- und zwei Untergruppenanalysen durchgeführt. Eine Netzwerk-Metaanalyse von zwei verschiedenen Interventionen einschließlich Relugolix und Degarelix (d.h. alle Degarelix-Dosen: 80, 160 und 480mg) wurde für die Kastrationsrate innerhalb von 12 Monaten durchgeführt. Im Vergleich zu GnRH-Agonisten waren Relugolix (RR: 1,09; 95% CI: 0,95–1,23) und Degarelix (RR: 0,98; 95% CI: 0,91–1,06) nicht mit einer signifikant höheren 12-Monats-Kastrationsrateverbunden. Auch in der ersten Untergruppenanalyse wurden nur Studienarme berücksichtigt, die Degarelix 80mg verwendeten. Relugolix und Degarlix 80mg wurden mit GnRH-Agonisten verglichen. Es zeigte sich, dass Relugolix (RR: 1,09; 95% CI: 0,98–1,2) und Degarelix 80mg (RR: 1,02; 95% CI: 0,95–1,1) nicht mit einer signifikant höheren 12-Monats-Kastrationsrate verbunden waren. Auf der Grundlage von Bayesian Analysen und der Analyse der Behandlungsrangliste nach SUCRA war es sehr wahrscheinlich, dass Relugolix die beste Behandlung zur Herbeiführung einer anhaltenden Kastration war.
In der zweiten Untergruppenanalyse wurden vier verschiedene Interventionen einschließlich Relugolix und Degarelix (d.h., Degarelix 80, 160 und 480mg) wurden mit GnRH-Agonisten verglichen: Relugolix (RR: 1,09; 95% CI: 0,98–1,2), Degarelix 160mg (RR: 1,03, 95% CI: 0,93–1,13) und Degarelix 80mg (RR: 1,02; 95% CI: 0,95–1,1) waren nicht mit einer signifikant höheren 12–Monats-Kastrationsrate verbunden. Degarelix 480mg (RR: 0,46; 95% CI: 0,07–0,92) war jedoch mit einer signifikant niedrigeren 12–Monats–Kastrationsrate verbunden. Auf der Grundlage der Bayesian Analyse und der Analyse der Rangfolge der Behandlungen nach SUCRA war es sehr wahrscheinlich, dass Relugolix die beste Behandlung zur Herbeiführung einer anhaltenden Kastration war und Degarelix 480mg den niedrigsten Rang einnahm (Abb. 1).
Abb. 1: Zusammenfassung der Metaanalyse des Bayesian Netzwerks für Untergruppen zur Wirksamkeit der Behandlung. GnRH: Gonadotropin-Releasing-Hormon
Hinsichtlich der unerwünschten Wirkungen haben wir eine Haupt- und zwei Untergruppenanalysen durchgeführt. Eine Netzwerk-Metaanalyse von zwei verschiedenen Interventionen, einschließlich Relugolix und Degarelix (d.h. alle Degarelix-Dosen: 80, 160 und 480mg), wurde für alle unerwünschten Ereignisse durchgeführt. Im Vergleich zu GnRH-Agonisten waren Relugolix (RR: 0,99; 95% CI: 0,6–1,6) und Degarelix (RR: 1,1; 95% CI: 0,75–1,35) nicht mit einer geringeren Wahrscheinlichkeit von 12 Monaten für alle unerwünschten Ereignisse verbunden. Auf der Grundlage der Bayesian Analyse und der Analyse der Behandlungsrangliste nach SUCRA war es sehr wahrscheinlich, dass sowohl Relugolix als auch die GnRH-Agonisten die beste Behandlung in Bezug auf die geringere Wahrscheinlichkeit aller unerwünschten Ereignisse waren.
In der ersten Untergruppenanalyse wurden für die schwerwiegenden unerwünschten Ereignisse (SUE) zwei verschiedene Interventionen mit Relugolix und Degarelix durchgeführt. Im Vergleich zu den GnRH-Agonisten wurde festgestellt, dass Degarelix (RR: 0,72; 95% CI: 0,4–1,3) und Relugolix (RR: 1,05; 95% CI: 0,42–2,6) nicht mit einer geringeren Wahrscheinlichkeit von SUE nach 12 Monaten assoziiert waren. Auf der Grundlage der SUCRA-Wahrscheinlichkeitsranganalyse war es sehr wahrscheinlich, dass Degarelix im Hinblick auf eine geringere Wahrscheinlichkeit von SUE innerhalb von 12 Monaten besser war als GnRH-Agonisten und Relugolix.
In der zweiten Untergruppenanalyse wurden zwei verschiedene Interventionen, darunter Relugolix und Degarelix, hinsichtlich der kardiovaskulären Ereignisse (KVE) untersucht. Im Vergleich zu den GnRH-Agonisten stellten wir fest, dass Relugolix (RR: 0,44; 95% CI: 0,16–1,2) und Degarelix (RR: 0,74; 95% CI: 0,37–1,52) nicht mit einer geringeren Wahrscheinlichkeit von KVEinnerhalb von 12 Monaten assoziiert waren. Auf der Grundlage der SUCRA-Wahrscheinlichkeitsanalyse war es jedoch sehr wahrscheinlich, dass Relugolix im Hinblick auf eine geringere Wahrscheinlichkeit einer KVE innerhalb von 12 Monaten besser war als Degarelix und GnRH-Agonisten.
Was können wir aus den wichtigsten Ergebnissen erkennen?
Wir haben festgestellt, dass die von der FDA zugelassenen GnRH-Antagonisten (Relugolix und Degarelix) hinsichtlich der anhaltenden 12–Monats–Kastrationsrate bei Testosteronspiegeln unter 50ng/dl mit GnRH-Agonisten vergleichbar sind. Darüber hinaus gab es keinen statistisch signifikanten Unterschied zwischen oralen und parenteralen GnRH-Antagonisten, außer bei der Dreimonatsformulierung von Degarelix (480mg).
Was die Sicherheitsanalysen anbelangt, so gab es sowohl bei Relugolix als auch bei Degarelix (unabhängig von der Dosierung) keinen signifikanten Unterschied bei der Häufigkeit von Nebenwirkungen und unerwünschten Ereignissen. Die Rankinganalysen zeigten jedoch, dass Degarelix höhere Raten für „alle UE“ aber die geringsten Raten für SUE aufwies. Diese widersprüchlichen Ergebnisse könnten auf die hohe Rate an Reaktionen an der Injektionsstelle in der Degarelix-Gruppe zurückzuführen sein, die jedoch nicht so schwerwiegend waren, dass sie als SUE eingestuft werden könnten. Bei der Betrachtung der KVE als Untergruppe der Sicherheitsanalyse deuteten die RR beider GnRH-Antagonisten auf eine geringere KVE-Rate im Vergleich zu den GnRH-Agonisten hin; eine statistische Signifikanz wurde jedoch nicht erreicht. Dennoch zeigte die Ranglistenanalyse, dass Relugolix und Degarelix (unabhängig von der Dosierung) den ersten bzw. zweiten Rang einnahmen.
Wir bestätigten, dass die Wirksamkeit der oralen und der monatlichen parenteralen Formulierung von GnRH-Antagonisten bei der Herbeiführung einer anhaltenden Kastration vergleichbar war. Dennoch kann Relugolix nicht bei einer intensivierten Krebstherapie eingesetzt werden, da es in Kombination mit potenten Androgenrezeptor-Inhibitoren wie Enzalutamid, Apalutamid, Darolutamid und Abirateron sowie in Kombination mit Chemotherapeutika wie Docetaxel oder Cabazitaxel noch nicht ausreichend untersucht wurde. Relugolix ist nicht nur ebenso wirksam wie GnRH-Agonisten, sondern überwindet auch das Haupthindernis für den Einsatz von Degarelix in der klinischen Praxis (d.h. die Reaktion an der Injektionsstelle und die Notwendigkeit häufiger Injektionen). Das Ergebnis der Metaanalyse der Rangfolge aller unerwünschten Wirkungen zeigte, dass sowohl Relugolix als auch die GnRH-Agonisten besser waren als Degarelix, was möglicherweise nur auf die mit Degarelix verbundenen häufigeren Reaktionen an der Injektionsstelle zurückzuführen ist. In der Untergruppenanalyse der SUE erreichten Degarelix und Relugolix jedoch den ersten und den letzten Platz; tatsächlich hatte Degarelix die geringste Anzahl von SUE.
Es scheint, dass wir eine längere Nachbeobachtung der HERO-Studie und mehr Daten über die klinische Anwendung von Relugolix abwarten müssen, um zuverlässige Schlussfolgerungen ziehen zu können. Zwar ist der letzte molekulare Wirkstoff von Relugolix, 16b (TAK–385), ein hochpotenter und oral aktiver GnRH-Antagonist als klinischer Kandidat ohne (P450-)CYP3A4-Hemmung und mit verbesserter In-vivo-Wirksamkeit. Dennoch besteht eine potenzielle Wechselwirkung zwischen Relugolix und anderen Arzneimitteln, die CYP3A4 induzieren oder hemmen können. Darüber hinaus wurde das Risiko einer QT-Verlängerung erwähnt, und dieses Risiko könnte sich bei einer positiven Vorgeschichte oder Familienanamnese in Bezug auf Herzrhythmusstörungen, Elektrolytstörungen und der gleichzeitigen Einnahme von Diuretika erhöhen. Urologen sollten über die Begleiterkrankungen und die Medikation ihrer Patienten informiert werden.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...