Radikale Nephroureterektomie: operatives Outcome und onkologische Sicherheit
Autorin:
Mag. Dr. Ingrid Berger
Abteilung für Urologie
Krankenhaus der Barmherzigen Brüder, Wien
E-Mail: ordination@dringridberger.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Datenlage hinsichtlich des Vergleichs des operativen Outcomes und der onkologischen Sicherheit der robotisch-assistierten laparoskopischen radikalen Nephroureterektomie und der offenen radikalen Nephroureterektomie ist derzeit noch dünn.
Keypoints
-
Die Datenlage zum Vergleich der offen-chirurgischen mit der robotisch assistierten laparoskopischen NU ist äußerst dünn.
-
Mit zunehmendem Tumorstadium und Tumorgrad steigt die Wahrscheinlichkeit einer Lymphknotenmetastasierung.
-
Bedenken hinsichtlich einer adäquaten Lymphadenektomie bei robotisch assistierten Operationen können in Studien nicht bestätigt werden.
-
Qualitätskriterien sind unabhängig von der Operationstechnik gefordert, sie werden aber erst bei etwas mehr 50% der durchgeführten Operationen berücksichtigt.
-
Vorgeschlagene Qualitätskriterien können Tetrafecta-Kriterien sein.
-
Die laparoskopische bzw. robotisch assistierte und die offen-chirurgische RNU haben vergleichbare onkologische Ergebnisse.
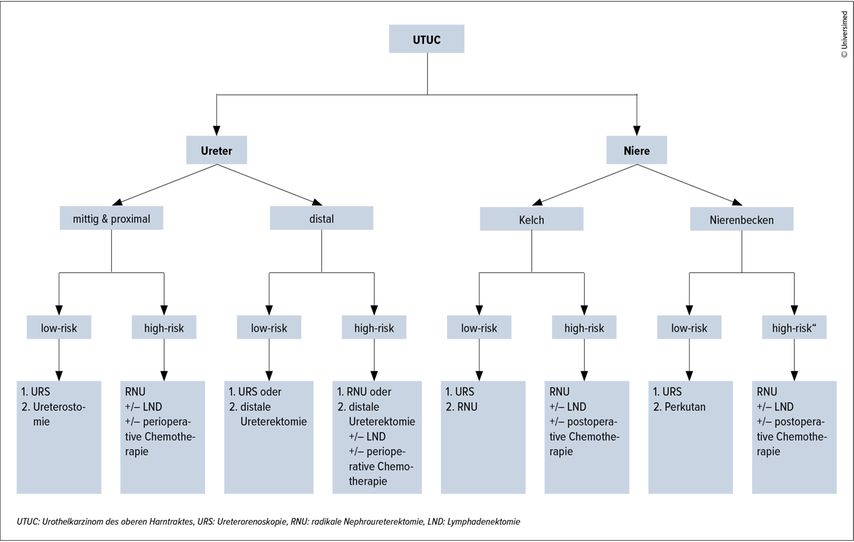
Die offen-chirurgische radikale Nephroureterektomie (ORNU) ist laut den EAU-Leitlinien immer noch die Standardtherapie des High-Risk-Urothelkarzinoms des oberen Harntrakts, und dies unabhängig von der Lokalisation des Tumors (Abb.1). Ganz generell muss dieser Eingriff den onkologischen Qualitätskriterien entsprechen, insbesondere um die Tumorzellaussaat zu verhindern, was ganz unabhängig vom gewählten chirurgischen Zugang gilt.
Die Datenlage zum Vergleich der offenen und robotisch assistierten sowie laparoskopischen Operationstechniken ist äußerst dünn, da es derzeit keine Level-1-Evidenz dazu gibt. Die einzige randomisiert-kontrollierte Studie stammt aus dem Jahr 2009 und vergleicht die laparoskopische Technik mit der offenen Technik. Die meisten Studien, die die laparoskopische radikale Nephroureterektomie (LRNU) mit der offenen radikalen Nephroureterektomie vergleichen, sind retrospektive Analysen.
Die laparoskopische Technik ist aber nicht mit der robotisch assistierten laparoskopischen radikalen Nephroureterektomie (RRNU) gleichzusetzen. Auch hier gibt es wenige Studien, die diese beiden chirurgischen Zugänge vergleichen, und direkte Gegenüberstellungen, die alle drei Operationstechniken vergleichen, sind selten. Da es sich bei den vorliegenden Studien vor allem um retrospektive Datenanalysen handelt, bergen diese Studien naturgemäß eine Biasgefahr. Darüber hinaus spielen für die Qualität der radikalen Nephroureterektomie Spitals- und Chirurgenvolumina eine entscheidende Rolle – wie es bei jedem anderen chirurgischen Eingriff auch der Fall ist.
Qualitätskriterien für die radikale Nephroureterektomie
Die EAU-Leitlinien sehen vor, dass zur Reduktion des Risikos für Tumorzellaussaat folgende Prinzipien eingehalten werden:
-
Das Nierenhohlraumsystem soll unversehrt bleiben.
-
Ein direkter Kontakt zwischen dem Tumor und den Instrumenten soll verhindert werden.
-
Der Eingriff soll in einem geschlossenen System stattfinden, daher soll ein Tumor-Morcellement vermieden und das Präparat mit einem Bergebeutel geborgen werden.
-
Die Niere und der Harnleiter mit der Blasenmanschette sollen en bloc reseziert werden.
-
Invasive oder große Tumoren (T3/T4 und/oder N+/M+) stellen eine Kontraindikation für minimal invasive OP-Techniken dar.
Gerade Punkt fünf steht in Diskussion, da die laparoskopische Technik immer mehr von der robotischen Technik abgelöst wird und beide Techniken nicht 1:1 gleichgesetzt werden können.
Standardisierte Qualitätskriterien für die radikale Nephroureterektomie sind weder eindeutig definiert noch validiert. In einer rezent publizierten Studie in European Urology Open Science wurde im Rahmen einer retrospektiven Analyse anhand von 1765 Patienten ein Vorschlag für Tetrafecta-Kriterien herausgearbeitet. Diese umfassten einen negativen Resektionsrand, eine Blasenmanschettenresektion und eine entsprechend den Leitlinien durchgeführte Lymphadenektomie sowie Rezidivfreiheit für 12 Monate. In einem medianen Follow-up von 30 Monaten wurden diese Tetrafecta-Kriterien nur bei 52,6% der Patienten erfüllt. Die 5-Jahres-Gesamtüberlebensrate war in der Gruppe, die die Tetrafecta-Kriterien erfüllten, signifikant höher (76% vs. 51%). Interessanterweise stellte sich bei dieser Studie heraus, dass die robotische Technik ein unabhängiger Prognosefaktor für die Einhaltung der Tetrafecta-Kriterien war. Noch steht eine externe Validierung dieser Kriterien aus, anhand derer ein Vergleich zwischen den Operationstechniken durchgeführt werden könnte. In einer anderen rezent publizierten Studie von König et al. in Cancers wurden als Pentafecta-Kriterien ein negativer Resektionsrand, eine komplette Blasenmanschettenresektion, das Fehlen hämatologischer Komplikationen, das Fehlen von anderen Komplikationen und eine Rezidivfreiheit für 12 Monate herausgearbeitet. 49% von 1718 Patienten erreichten diese Kriterien und es ergab sich eine bessere 5-Jahres-Gesamtüberlebensrate sowie eine bessere krebsspezifische Überlebensrate (68,7% vs. 50,1% und 79,8% vs. 62,7%, p=0,001). In einer multivariablen Analyse zeigte sich bei diesen Patienten ein längeres rezidivfreies und krebsspezifisches Überleben sowie ein längeres Gesamtüberleben.
Resektion der Blasenmanschette
Die Resektion der Blasenmanschette sollte laut den geforderten Qualitätskriterien bei einer radikalen Nephroureterektomie immer durchgeführt werden. Die laparoskopische Dissektion des distalen Ureters ist jedoch technisch schwierig und stellt eine Herausforderung gerade bei distalen Uretertumoren dar. Wird der distale Ureter inkomplett exzidiert und werden damit der intramurale Anteil und das Ostium nicht reseziert, steigt das Risiko für ein Lokalrezidiv. Sollte bei der Dissektion auch ein Blasenleck aufgrund eines inadäquaten Blasenverschlusses vorliegen, könnte dieses zur Tumorzellaussaat beitragen. Das in älteren Studien berichtete schlechtere onkologische Outcome der LRNU vs. ORNU könnte u.a. diesen Gründen geschuldet sein.
Intravesikale Rezidive treten häufig nach einer minimal invasiven NU auf. Als Risikofaktoren wurden eine ureteroskopische Tumorbiopsie, eine transurethrale Resektion der Blasenmanschette sowie positive Resektionsränder identifiziert. Daher sollte möglichst auf eine transurethrale Resektion des intramuralen Anteils des Harnleiters verzichtet werden.
In ca. einem Drittel der Studien zur LRNU wurde die Blasenmanschette nicht laparoskopisch entfernt, sondern offen-chirurgisch, sodass es sich hierbei um kombinierte chirurgische Eingriffe handelt. In vielen Fällen erfolgt überhaupt keine Exzision der Blasenmanschette.
Eine Studie basierend auf der SEERS-Datenbank betreffend den Zeitraum zwischen 2004 und 2014 konnte zeigen, dass von insgesamt 4266 Patienten nur bei 2913 Patienten (68,3%) die Blasenmanschette reseziert wurde. Gegen Ende dieses Zeitraums stieg der Anteil auf 74,5% an. Nach 60 Monaten war die krebsspezifische Mortalität in der Gruppe, bei der die Blasenmanschette entfernt wurde, deutlich geringer (19,7%) als in der Gruppe ohne Blasenmanschettenresektion (23,5%; p=0,005). Diese retrospektive Studie war allerdings nicht geeignet, die Rezidivraten oder die metastatische Progression zu untersuchen, die auf die Resektion der Blasenmanschette zurückzuführen waren oder nicht.
Aus der vorliegenden Datenlage könnte man schließen, dass die laparoskopische Entfernung der Blasenmanschette nicht so sicher ist wie die offene. Aufgrund der technischen Vorteile der robotischen gegenüber der laparoskopischen Operationstechnik (erleichterter Zugang zur retrotrigonalen Region durch EndoWrist-Instrumente) dürfte das robotische Verfahren einen entscheidenden Vorteil gegenüber dem laparoskopischen haben. Leider liegen keine Studien vor, die die onkologische Sicherheit der robotischen gegenüber der offenen Technik vergleichen.
Lymphadenektomie
Die Durchführung einer Lymphadenektomie ist ein weiteres Qualitätskriterium der RNU. Da das präoperative Staging unzuverlässig ist, sollte zum exakteren Tumorstaging eine Lymphadenektomie erfolgen. Eine präoperative Beurteilung des Lymphknotenstatus ist schwierig. Es gibt weder eine zuverlässige Bildgebung noch zytologische oder pathologische Befunde, die eine Lymphknotenmetastasierung voraussagen könnten. In der geringen Anzahl an Studien, die Patienten mit cN+ untersuchten, konnte nicht sicher gezeigt werden, ob der Überlebensvorteil aufgrund der Lymphadenektomie oder der verabreichten systemischen Chemotherapie erzielt wurde.
Es gibt immer noch keinen Konsens darüber, wo genau die lymphatischen Abflussstationen, insbesondere bei mittleren und distalen Harnleitertumoren, sind. Lymphknotenstationen werden mit den anatomischen Lokalisationen der Tumoren des oberen Harntrakts assoziiert. Die „Template“-Lymphadenektomie hat einen Einfluss auf das onkologische Ergebnis, da sie zur Eliminierung von Mikrometastasen beitragen kann. Die Definition der „Templates“ für die Lymphknotenentfernung ist nicht eindeutig. Meistens wurden die anatomischen „Templates“ nach Entscheidung des Operateurs festgelegt. In einer bereits 2007 publizierten Arbeit von Kondo konnte eine Abhängigkeit der Tumorlokalisation von anatomischen Grenzen der „Templates“ für die Lymphadenektomie gezeigt werden.
Demnach können „Template“-Lymphadenektomie-Tumorlokalisationen acht anatomischen Arealen zugeordnet werden:
-
rechtes Nierenbecken
-
rechter proximaler Ureter
-
rechter mittlerer Ureter
-
rechter distaler Ureter
-
linkes Nierenbecken
-
linker proximaler Ureter
-
linker mittlerer Ureter
-
linker distaler Ureter
Mit zunehmendem Tumorstadium und Tumorgrad steigt die Wahrscheinlichkeit einer Lymphknotenmetastasierung. Die Inzidenz von Lymphknotenmetastasen bei fortgeschritteneren Tumorstadien (≥pT2) rangiert zwischen 14,3% und 40%. Bei Nierenbeckenkarzinomen sowie proximalen bzw. mittleren Ureterkarzinomen liegt die Inzidenz von Lymphknotenmetastasen zwischen 20% und 30%. Bei Nierenbeckenkarzinomen sind meistens die hilären Lymphknoten betroffen, aber auch die paracavalen, retrocavalen bzw. paraaortalen oder interaortocavalen Lymphknoten. Bei distalen Ureterkarzinomen ist die Inzidenz von Lymphknotenmetastasierung deutlich geringer, sie liegt bei 10%. Bei distalen Ureterkarzinomen sind die häufigsten Prädilektionsstellen die Lymphknoten im Bereich der A./V. iliaca communis bzw. der Fossa obturatoria.
In der vorliegenden Datenlage zeigte sich, dass bei LRNU die Anzahl der entfernten Lymphknoten geringer war als bei ORNU, was einen onkologischen Nachteil für den Patienten bedeuten könnte. Kenigsberg et al. konnten zeigen, dass Patienten der LRNU-Kohorte weniger häufig eine Lymphknotenentfernung (19% vs. 35%, p<0,001) hatten, und wenn, war die Anzahl der entnommenen Lymphknoten geringer als bei der robotischen Technik (3 vs. 4, p<0,001). Durch den technischen Vorteil der robotischen Chirurgie vs. Laparoskopie ist eine robotisch assistierte Lymphadenektomie vergleichbar mit einem offen-chirurgischen Verfahren. Jüngeres Alter, RRNU, Operationen an einem akademischen Zentrum und die Verabreichung einer neoadjuvanten Chemotherapie sind mit einem positiven Vorhersagewert für eine Lymphadenektomie assoziiert.
Onkologische Sicherheit abhängig von der OP-Technik
Im „World Journal of Surgical Oncology“ publizierten Piszcek et al. 2021 eine Metaanalyse über 5959 Patienten (55,5%), die sich im Zeitraum von 2007 bis 2020 einer ORNU unterzogen, und 4771 Patienten (44,5%), die eine LRNU hatten. Die Ergebnisse zeigten keinen signifikanten Unterschied beim krebsspezifischen Überleben (HR: 0,84; 95%CI: 0,60–1,19; p=0,33), Gesamtüberleben (HR: 0,84; 95% CI: 0,62–1,13; p=0,25), intravesikalen rezidivfreien Überleben (HR: 1,08; 95% CI: 0,85–1,39; p=0,52) und beim rezidivfreien Überleben (HR: 1,09; 95% CI: 0,94–1,25; p=0,26) zwischen der LRNU- und der ORNU-Gruppe. Auch die Subgruppenanalyse für pT3/T4 und für alle pT mit N+ zeigte keine statistisch signifikanten Unterschiede bei Überlebensparametern zwischen LRNU und ORNU. Diese Metaanalyse legt nahe, dass die LRNU und ORNU vergleichbare onkologische Ergebnisse haben, selbst bei lokal fortgeschrittenen Erkrankungsstadien. Es widerspricht der Studie von Giuseppe Simone aus 2009, in der eine onkologische Unterlegenheit der LRNU gezeigt wurde.
Mourmouris et al. publizierten 2021 im „Archivio Italiano di Urologia e Andrologia“ die erste prospektive Analyse zur RRNU im Vergleich zur ORNU. Die RRNU erzielte gute onkologische Ergebnisse, selbst in fortgeschrittenen Tumorstadien. Die durchschnittliche Rate des rezidivfreien Überlebens innerhalb von 5 Jahren lag bei 57,1%, bei einem Tumorstadium von pT3a bei 28,3% und bei einem Tumorstadium von pT4 bei nur 6,7%.
Eine relativ rezente Studie konnte zeigen, dass die RRNU statistisch signifikante bessere onkologische Ergebnisse im Vergleich zur ORNU hatte – daher ein besseres rezidivfreies Überleben, krebsspezifisches Überleben und Gesamtüberleben. Allerdings zeigte sich in dieser Studie ein Bias dahingehend, dass bei Patienten, die offen operiert wurden, der Krebs lokal weiter fortgeschritten war bzw. Lymphknotenmetastasen auftraten.
Gefahr von „Port-Site“-Metastasen
Die Gefahr von „Port-Site“-Metastasen betrifft die laparoskopischen Operationstechniken. Es liegen keine expliziten Vergleiche zwischen robotischen und rein laparoskopischen Techniken vor. Die Analyse von Daten einer retrospektiven Studie in Urology 2019 zeigte bei der LRNU eine Inzidenz für Portmetastasen von 1,7%.
Für die Entstehung von „Port-Site“-Metastasen gibt es unterschiedlichsten Erklärungsmodelle. U.a. wird angenommen, dass auf molekularer Ebene eine abdominelle Wundhypoxie und folglich eine Azidose die Expression von Interleukin 8 induzieren, wodurch die Angiogenese über „vascular endothelial growth factor“ (VEGF) reguliert wird. In einer Studie von Martinez-Palones zeigte sich eine erhöhte Mikrogefäßdichte bei Patienten mit Portmetastasen. Immunhistochemisch zeigte sich in Portmetastasengewebe eine starke Expression von CD31, das im Endothel gefunden wurde. Daher wird angenommen, dass eine erhöhte Angiogenese im Bereich der Portmetastasen stattfindet.
Zu den wahrscheinlichsten Gründen für die Entstehung von Portmetastasen zählen die Verwendung von Kohlendioxid und die Aerosolisierung von Tumorzellen sowie der sogenannte Kamineffekt, der bei rascher Desufflation durch die Portstellen entsteht. Dadurch kommt es zu einer hohen Dichte an Tumorzellen an den Portstellen. Allerdings ist auch diese Theorie umstritten. In einer im Jahr 2014 veröffentlichen Metaanalyse, welche 20 randomisiert-kontrollierte Studien aus Tiermodellen zu dieser Thematik umfasste, zeigte sich kein statistisch signifikanter Unterschied zwischen laparoskopischen sowie gaslosen laparoskopischen Eingriffen und offen-chirurgischen Verfahren.
Weitere Erklärungen für Portmetastasen könnten die exzessive Manipulation am Tumor selbst, eine hämatogene Aussaat, eine wiederholte Trokarsetzung und die damit verbundene Traumatisierung des Gewebes sein, welche die Implantation von Tumorzellen erleichtern könnte.
Um das Risiko von Portmetastasen zu reduzieren, wurde vorgeschlagen, die Desufflation des Abdomens über die Trokare durchzuführen, um den Kamineffekt zu verhindern, sowie im Bereich der Portinzisionen die Faszie mit dem Peritoneum zu verschließen.
In einer 2021 publizierten retrospektiven Studie von Morselli et al. wurde der Frage nachgegangen, ob die laparoskopische Technik bei Patienten mit High-Grade-Karzinom des oberen Harntrakts (pT ≥2) eher zu einer Tumoraussaat führt als die offene Technik. Die robotische Technik wurde nicht angewendet. Die Studie umfasste insgesamt 107 RNU. 47 (43,9%) wurden laparoskopisch und 60 (56,1%) wurden offen-chirurgisch operiert. Das Tumorstadium war im Arm der offen-chirurgischen Verfahren etwas höher (T3–T4 bei 44 Patienten, entspricht 73,3%) als im laparoskopischen Arm (T3–T4 bei 20 Patienten, entspricht 43,4%). Die Operationstechnik hatte keinen Einfluss auf die Rezidivlokalisation, die Rezidivrate oder das Gesamtüberleben, aber eine peritoneale Karzinose trat nur im laparoskopischen Arm auf, wenn auch nicht statistisch signifikant.
Komplikationsrate
Eines der größten robotischen Zentren konnte eine geringere Komplikationsrate bei robotischer Technik aufzeigen. Die Komplikationsrate lag bei 2,6%, mit sehr guten intra- und postoperativen Ergebnissen. Eine multivariate Studie bestätigte, dass die RRNU weniger postoperative Komplikationen mit sich bringt. Dieser Vorteil war für die intraoperativen Komplikationen allerdings nicht nachweisbar. Patienten, die sich einer RRNU unterzogen, hatten einen kürzeren Spitalsaufenthalt, einen geringeren Blutverlust, eine geringere Transfusionsrate sowie geringere R1-Raten im Vergleich zur ORNU. Die Operationszeit war in der offen-chirurgischen Gruppe kürzer.
In einer rezent publizierten Studie in Cancers 2022 zeigten Bae et al., dass der Anteil der RRNU von 9% im Jahr 2017 bis 2021 auf 67% angestiegen ist. Operationszeit, Blutverlust, Dauer des Spitalsaufenthalts und die 90-Tages-Komplikationsrate waren in dieser Studie zwischen RRNU, LRNU und ORNU vergleichbar. Die 3-Jahres-Gesamtüberlebensrate lag für die ORNU bei 91,8%, für die LRNU bei 90,4% und für die RRNU bei 92,1% (p>0,059). Es zeigte sich kein Unterschied im progressionsfreien Überleben, im krebsspezifischen Überleben oder im Gesamtüberleben.
Kenigsberg et al. diskutierten 2021, dass die RRNU der laparoskopischen Technik überlegen sein könnte. Bei der RRNU im Vergleich zur LRNU lag ein medianes Gesamtüberleben von 71,1 Monaten vs. 62,6 Monate (p=0,033) vor. Patienten, die mit der laparoskopischen Technik operiert wurden, waren im Durchschnitt älter (72,7 vs. 71,4 Jahre; p<0,001), aber es lagen keine Unterschiede hinsichtlich der Komorbiditäten und des pathologischen Tumorstadiums oder des Tumorgrades vor. Im Zuge einer LRNU wurde eher zu offen-chirurgischen Verfahren konvertiert. Diese Patienten hatten einen längeren stationären Aufenthalt und eine höhere 30- und 90-Tages-Mortalität. Somit war in dieser Studie die Durchführung einer LRNU ein unabhängiger Prognosefaktor für die Mortalität (p=0,030). Alter, Grad, positive Resektionsränder sowie das pT/pN-Stadium waren hingegen mit der Mortalitätsrate assoziiert.
Blaseninstillationstherapie
Die Rezidivrate in der Blase nach RNU liegt zwischen 22% und 47%. Zwei prospektive randomisierte Studien und zwei Metaanalysen konnten zeigen, dass eine einmalige postoperative intravesikale Instillation mit einem Chemotherapeutikum (z.B. Mitomycin C) das Rezidivrisiko in der Blase im ersten Jahr nach der RNU senkt. Die Instillation setzt jedoch einen absolut dichten Blasenverschluss voraus. Seit 2013 ist die Empfehlung einer postoperativen intravesikalen Instillationstherapie in den EAU-Leitlinien verankert. Seither ist der Anteil an durchgeführten postoperativen intravesikalen Instillationstherapien von 0% auf 24% angestiegen.
In einer rezent publizierten Studie von Kenigsberg et al. wurden Daten aus 17 akademischen Zentren zwischen 2006 und 2020 ausgewertet, wonach 78% der Patienten keine postoperative intravesikale Instillation erhielten. In einer multivariablen Regressionsanalyse waren das jüngere Patientenalter (OR 0,940; p<0,001), die laparoskopische Operationstechnik (OR 2,403; p=0,008) und die endoskopische Blasenmanschettenresektion (OR 7,619; p<0,001) als signifikante prognostische Faktoren für eine postoperative intravesikale Instillationstherapie zu identifizieren.
Nicht nur eine postoperative Instillationstherapie kann das Blasenrezidivrisiko senken, sondern auch eine perioperative Blasenspülung. In einer japanischen retrospektiven Studie (2001–2018) wurden Daten zum intravesikalen Rezidiv untersucht. Es konnte in einer multivariaten Analyse gezeigt werden, dass eine perioperative intravesikale Spülung mit destilliertem Wasser oder isotoner Kochsalzlösung ein unabhängiger Prognosefaktor für die Verhinderung eines Blasenrezidivs ist (p=0,0051). Der Vergleich zwischen der Gruppe mit und ohne perioperative Blasenspülung zeigte eine signifikante Verringerung des Blasenrezidivrisikos in der Gruppe der Patienten, die eine Spülung erhielten (25,0% vs. 52,5%, p=0,0066). Dabei war es unerheblich, welche Art der Spüllösung verwendet wurde.
Diskussion
Die Datenlage zur chirurgischen und onkologischen Sicherheit der robotisch assistierten laparoskopischen radikalen Nephroureterektomie, v.a. im Vergleich zu anderen Operationstechniken (offen-chirurgisch bzw. laparoskopisch), ist dünn. Die Studien sind aufgrund unterschiedlicher operativer Zugänge und nicht durchgeführter Blasenmanschettenresektionen sowie Lymphadenektomien nur schlecht vergleichbar. Darüber hinaus handelt es sich in der überwiegenden Zahl der Studien um retrospektive Analysen.
In den EAU-Leitlinien wird daher weiterhin die ORNU als Standardtherapie empfohlen, speziell bei fortgeschrittenen Tumorstadien.
Tatsache ist jedoch, dass in den letzten Jahren der Anteil der robotisch assistierten radikalen Nephroureterektomien deutlich zugenommen hat. Gleichzeitig kam es auch zu einem kontinuierlichen Anstieg der Anzahl von Blasenmanschettenresektionen und Lymphadenektomien im Rahmen dieses Eingriffs. Rezente Studien konnten zeigen, dass sogenannte Tetrafecta-Kriterien bei robotisch durchgeführten radikalen Nephroureterektomien eher eingehalten werden als bei anderen Operationstechniken. Dies spricht für eine Zunahme der Qualität bei diesem Eingriff und sollte letztendlich auch zu einer Verbesserung der onkologischen Sicherheit führen, was noch in prospektiv randomisierten Studien gezeigt werden muss. Es wird gerade an einem Review und einer Metaanalyse gearbeitet, welche offen-chirurgische vs. robotische onkologische Verfahren im Zeitraum zwischen 2000 und 2020 vergleichen. Das Ergebnis dieser Arbeit wird ein wichtiger Beitrag für eine transparentere Entscheidungsgrundlage und für eine onkologisch sichere Behandlung unserer Patienten sein.
Literatur:
• Bae H et al.: Robotic Radical nephroureterectomy with bladder cuff excision for upper tract urothelial carcinoma: a trend analysis of utilization and a comparative study. Cancers 2022; 14(10): 2497 • Benabou K et al.: Port-site metastasis in gynecological malignancies. JSLS 2021; 25(1): e2020.00081 • Braun AE et al.: Controversies in management of the bladder cuff at nephroureterectomy. Transl Androl Urol 2020; 9(4): 1868-80 • Duquesne I et al.: Lymphadenectomy for Upper Tract Urothelial Carcinoma: A systematic review. J Clin Med 2019; 8(8): 1190 • Cacciamani GE et al.: Robotic versus open urological oncological surgery: study protocol of a systematic review and meta-analysis. BMJ Open 2020; 10(2): e036609 • Huang YP et al.: Is robotic superior to laparoscopic approach for radical nephroureterectomy with bladder cuff excision in treating upper urinary tract urothelial carcinoma? J Endourol 2022; doi: 10.1089/end.2022.0154. Online ahead of print. • Kapoor A et al.: The impact of method of distal ureter management during radical nephroureterectomy on tumour recurrence. Can Urol Assoc J 2014; 8(11-12): 845-52 • Kenigsberg AP et al.: Practice trends for perioperative intravesical chemotherapy in upper tract urothelial carcinoma: Low but increasing utilization during minimally invasive nephroureterectomy. Urol Oncol 2022; 40(10): 452. e17-452.e23 • Kenigsberg AP et al.: Robotic nephroureterectomy vs laparoscopic nephroureterectomy: increased utilization, rates of lymphadenectomy, decreased morbidity robotically. J Endourol 2021; 35(3): 312-8 • Ko R et al.: Transitional-cell carcinoma recurrence rate after nephroureterectomy in patients who undergo open excision of bladder cuff v transurethral incision of the ureteral orifice. J Endourol 2007; 21(7): 730-4 • Kondo T et al.: Impact of the extent of regional lymphadenectomy on the survival of patients with urothelial carcinoma of the upper urinary tract. J Urol 2007; 178(4 Pt 1): 1212-7 • McIntosh AG et al.: Role of lymph node dissection at the time of open or minimally invasive nephroureterectomy. Transl Androl Urol 2021; 10(5): 2233-45 • Medina et al.: Distal ureter and bladder cuff excision using the “Keyhole Technique” during robotic Radical Nephroureterectomy. Int Braz J Urol 2022; 48(5): 876-7 • Mourmouris P et al.: Is robotic radical nephroureterectomy a safe alternative to open approach: The first prospective analysis. Arch Ital di Urol Androl 2021; 93(4): 408-11 • Nazzani S et al.: Urothelial cancer nephroureterectomy with or without bladder cuff excision for localized urothelial carcinoma of the renal pelvis. Eur Urol Focus 2020; 6(2): 298-304 • Peyronnet B et al.: Oncological Outcomes of laparoscopic nephroureterectomy versus open radical nephroureterectomy for upper tract urothelial carcinoma: An European Association of Urology Guidelines systematic review. Uro Urol Focus 2019; 5(2): 205-23 • Roupret M et al. EAU Guidelines on Upper Urinary Tract Urothelial Carcinoma. Eur Urol 2017; 71(4): e111-e112 • Veccia A et al.: Single-stage Xi® robotic radical nephroureterectomy for upper tract urothelial carcinoma: surgical technique and outcomes Single stage Xi® robotic RNU without patients repositioning and robot re-docking were done between 2015 and 2019 and collected in a large worldwide multi-institutional study, the ROBotic surgery for Upper tract Urothelial cancer STudy (ROBUUST). Minerva Urol Nephrol 2022; 74(2): 233-41 • Xylinas E et al.: Intravesical recurrence after radical nephroureterectomy for upper tract urothelial carcinomas: predictors and impact on subsequent oncological outcomes from a national multicenter study. World J Urol 2013; 31(1): 61-8
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...