Neoadjuvante Therapiekonzepte
Autor:
Dr. Wolfgang Loidl
Prostate Cancer Center
Robotische Chirurgie Wiener Privat Klinik
Gastprofessor Medizinische Universität Wien
Lehrbeauftragter LMU München Großhadern
E-Mail: loidl@wpk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den Therapiealgorithmen der verschiedenen Fachgesellschaftenfehlt derzeit jegliche neoadjuvante Möglichkeit beim Prostatakarzinom.Bei fast allen malignen Erkrankungen haben sich bisher neoadjuvante Therapiekonzepte erfolgreich durchgesetzt.
Keypoints
-
Die neoadjuvante Therapie des lokal fortgeschrittenen Prostatakarzinoms ist schlecht untersucht.
-
Als sinnvolle Studienendpunkte wurden Verringerung der R1-Rate sowie Verkleinerung des Tumorvolumens und des Tumorstadiums definiert.
-
In der ARNEO-Studie konnten diese Ziele mit Degarelix/Apalutamid erreicht werden.
-
Sehr großes Interesse erweckt der noch experimentelle neoadjuvante Einsatz von Lutetium 177, einem Radioliganden.
-
In Zukunft werden molekulargenetische Aussagen über den Einsatz von neoadjuvanter Therapie mitentscheiden.
Geprüft durch randomisierte Phase-III-Studien verbessert sich das 18-Monate-Gesamtüberleben beim Pankreaskarzinom (PCa), einem Karzinom mit der höchsten Mortalitätsrate, von 47,3% auf 66,7%. Durch eine neoadjuvante Immunchemotherapie verbessert sich die pathologisch komplette Ansprechrate von 2,2% auf 24% beim nichtkleinzelligen Bronchialkarzinom. Die für die Prognose so entscheidende pathologisch komplette Ansprechrate beim Mammakarzinom verbessert sich durch eine adäquate neoadjuvante Therapie von 29% auf 79%. Es gäbe noch viele andere Beispiele, die die Sinnhaftigkeit einer einleitenden systemischen Therapie beweisen. In der urologischen Onkologie sind in der Vergangenheit schlecht rekrutierte Studien ohne Aussagekraft die Regel gewesen. So konnten die Protokolle zur neoadjuvanten Therapie beim Urothelkarzinom der Blase die urologische Gemeinschaft nie überzeugen. Der Überlebensvorteil von bis zu 8% führt trotzdem nur in weniger als einem Viertel aller Patienten zur Anwendung.
PCa: Schnittränder und Volumenbestimmung
Zum Prostatakarzinom wurden immer wieder Studien durchgeführt. Eine Androgendeprivationstherapie konnte ein pathologisches Ansprechen (Verringerung der R1-Rate, Verkleinerung des Tumorvolumens) erzielen. Eine Verbesserung der Rezidivrate (biochemisches Rezidiv) oder des krebsspezifischen Überlebens konnte nicht gezeigt werden. Die Studien waren für viele Fragestellungen „underpowered“. Der Großteil der eingebrachten Patienten hatte einen Low-Risk- oder Intermediate-Risk-Tumor. Somit sind diese Ergebnisse wenig hilfreich und nicht aussagekräftig. Einzig sogenannte Surrogatmarker für die Endpunkte der folgenden Studien sind dadurch entstanden. Die Definition von positiven Schnitträndern (R1) ist relativ klar, der prognostische Wert eines positiven Schnittrandes ist unumstritten. Eine Verringerung der Rate an positiven Schnitträndern durch eine einleitende Therapie wäre für den Verlauf des Prostatakarzinoms bedeutend. Schwieriger ist die Objektivierung der Reduktion des Tumorvolumens. Ideal wäre das Erreichen einer pT0-Situation, das heißt, ein neoadjuvantes Konzept bewirkt die komplette Eradikation des primär histologisch gesicherten Tumors. Dies wird durch eine neoadjuvante Chemotherapie in bis zu 40% beim Urothelkarzinom der Blase erreicht, wobei ein Bias durch die primäre transurethrale Resektion des Tumors entsteht. Beim Prostatakarzinom wird ein pT0 in den seltensten Fällen erzielt. In den Studien wird daher für das Ansprechen der neoadjuvanten Therapie von minimal residueller Erkrankung (<10%) gesprochen. Zur primären Volumenbestimmung des Tumors wird das multiparametrische MRT der Prostata herangezogen, sekundär stehen die Großflächenschnitte des Präparates zur Verfügung. Naturgemäß entstehen dadurch Unschärfen. Neueste Untersuchungen können die Aktivität von PSMA (Prostata-spezifisches Membranantigen) mittels PET-CT (Positronenemissions-Computertomografie) messen und prä- und posttherapeutische Effekte verifizieren. Es kann damit nicht nur eine Volumenveränderung, sondern auch eine Modulation der Zellularität (Zelldichte, Aktivität) des Tumors bestimmt werden. Ein besonderes Problem sind hier die für das Prostatakarzinom typische Multifokalität und die Heterogenität der Tumorzellen (30% sind PSMA-negativ). Die Index-Tumor-Hypothese, die schon für die fokale Therapie herangezogen wird, spielt auch hier eine ungeklärte Rolle.
Neoadjuvante Therapie bei lokal fortgeschrittenem Hochrisikotumor
Ziel aller Untersuchungen ist es, mittels einer neoadjuvanten Therapie einen lokal fortgeschrittenen oder Hochrisikotumor so zu behandeln, dass die radikale Operation im Anschluss zu einer hohen Kurationsrate führt. Die Inklusionskriterien sind oft uneinheitlich. Beim lokal fortgeschrittenen Karzinom ist das klinische Stadium im Vordergrund (cT3–cT4), beim Hochrisikotumor sind PSA-Werte >20ng/ml, ein Gleason-Score >4 und Lymphknotenbefall entscheidend.
Allen Untersuchungen gemein ist, dass die Fallzahlen gering und die Nachbeobachtungszeiten kurz sind. Es liegen fast ausschließlich Ergebnisse von Phase-I- und Phase-II-Studien vor. Medikamentös wurden Kombinationen von GnRH-Agonisten mit neuen gezielten Hormontherapien eingesetzt (Abirateron, Apalutamid, Enzalutamid). Chemotherapeutisch wurden Docetaxel (einzige randomisierte Phase-III-Studie) und Cabazitaxel angewendet. Auch zu PARP-Inhibitoren (Niraparib) gibt es Daten. Zukunftsweisend sind erste Ergebnisse vom Einsatz der PSMA-Liganden-Therapie (Lutetium 177) und die Möglichkeit einer stereotaktischen Strahlentherapie.
ARNEO-Studie
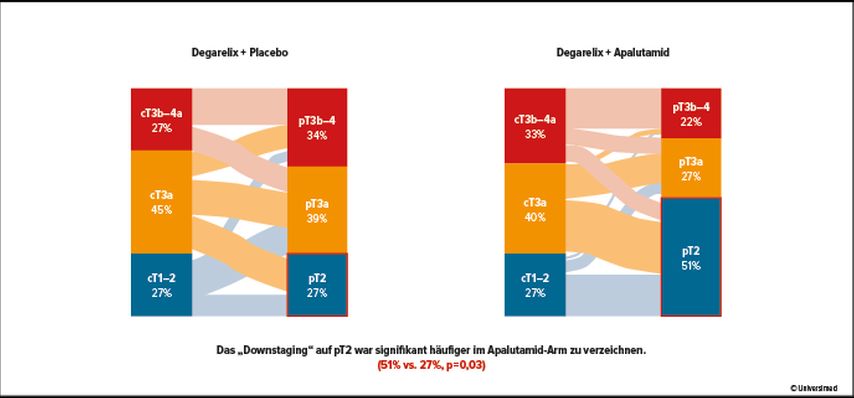
Im November 2022 wurde die ARNEO-Studie aus Leuven vorgestellt und publiziert. In einem randomisierten Phase-II-Setting wurde Degarelix mit oder ohne Apalutamid für 3 Monate vor der Operation verabreicht. Inkludiert wurden lokal fortgeschrittene (cT3–cT4) und Hochrisikokarzinome. Endpunkte waren eine minimal residuelle Erkrankung, die PSA-Kinetik und Toxizität sowie Lebensqualität. Es wurden bildgebende Biomarker (PSMA-PET) und immunhistochemische sowie molekularbiologische Marker für das Ansprechen gemessen. Es konnte ein Downstaging von cT3 auf pT2 mit der Kombination von Degarelix mit Apalutamid in 51% der Fälle erreicht werden, im Degarelix-Arm ohne Apalutamid nur in 27% der Fälle (p=0,03; Abb.1). Mittels PSMA-PET-CT wurden die intratumoralen Aktivitäten (SUV) prä- und posttherapeutisch gemessen. Patienten mit gutem Ansprechen hatten eine signifikante Reduktion der Aktivität in der Prostata und/oder in Lymphknoten zu verzeichnen. Die Veränderung der Aktivität konnte sehr gut mit der Veränderung des Tumorvolumens korreliert werden. Molekulargenetisch wurde bei einem Verlust des PTEN-Gens („PTENloss“) ein dramatisch schlechteres Ergebnis erzielt. Patienten ohne Verlust von PTEN erreichten in 43% ein pathologisches Ansprechen mit minimal residueller Erkrankung, im Gegensatz dazu konnte dies für Männer mit PTEN-Verlust in nur 11% gefunden werden. Somit wäre diese Bestimmung ein prädiktiver Faktor.
Abb. 1: ARNEO-Studie: Veränderung von klinischem Stadium (cT) zu pathologischem Stadium (pT) („Downstaging“, „Upstaging“; nach Devos G et al., Eur Urol 2022)
Zusammenfassend zeigte die Kombination Degarelix/Apalutamid ein signifikant besseres Ansprechen im Vergleich zur Degarelix-Monotherapie. Die PSMA-Aktivität kann das Ansprechen anzeigen und PTEN-Verlust ist ein negativer Prädiktor.
Kombinationschemotherapie im neoadjuvanten Setting
Eine großangelegte Phase-III-Studie (PROTEUS-Studie) mit ähnlichem Design ist aufgelegt und sollte demnächst fertig rekrutieren. Während die Studien mit Degarelix/Apalutamid in der Phase II ein positives Ergebnis gebracht haben, waren die Studien mit der Kombination ADT/Chemotherapie negativ. Sowohl Docetaxel als auch Cabazitaxel konnten im neoadjuvanten Setting keinen Vorteil erzielen. Die Phase-III-Studie aus dem Memorial Sloan Kettering Cancer Center mit dem Vergleich von ADT/Docetaxel vs. ADT alleine zeigte keinen Vorteil im krebsspezifischen Überleben. Verunreinigt wurde das Ergebnis zuungunsten der Kombination, weil ein hoher Prozentsatz von Patienten im ADT-Monotherapiearm bei PSA-Anstieg einer Strahlentherapie zugeführt wurde.
PARP-Inhibitor
Interessant ist der Ansatz einer PARP-Inhibitor-Therapie bei Patienten mit BRCA- 1/2-Mutation im lokal fortgeschrittenen Tumor. Beim metastasierten kastrationsrefraktärenKarzinom (mCRPC) ist diese Therapie ja zugelassen. Diese Untersuchungen laufen noch. Ergebnisse werden 2024 erwartet.
PSMA-Liganden (Lutetium 177)
LuTectomy heißt die Phase-I-Studie, bei der Lutetium 177 neodjuvant beim lokal fortgeschrittenen Prostatakarzinom getestet wird. Diese auf PSMA-Liganden basierte Therapie war in der VISION-Studie in der 2. Linie des mCRPC bereits erfolgreicher als die Chemotherapie (Cabazitaxel). Männer mit Hochrisiko- und lokal fortgeschrittenem Tumor mit positivem PSMA-PET-CT erhielten in der ersten Kohorte lediglich eine singuläre Gabe von Lutetium 177. Studienendpunkt waren die Dosimetrie im Primärtumor (und in den Lymphknoten), das PSA-Ansprechen, das histologische Ansprechen, PET-Veränderungen, die Sicherheit der Operation sowie Toxizität. Die Dosimetrie konnte bewiesen werden. In 80% der Fälle konnte ein Behandlungseffekt in den Großflächenschnitten der Prostata festgestellt werden. Bei keinem Patienten fand sich ein pT0-Effekt oder eine minimal residuelle Krankheit. Es gab keine Signale für eine erhöhte Toxizität oder vermehrt Komplikationen intra- und perioperativ. Die zweite Kohorte erhält nun 2 Zyklen Lutetium 177. Es bleibt zu hoffen, dass durch diese Dosisverdoppelung eine höhere Effektivität erzielt werden kann. Die neoadjuvante Strahlentherapie hat eine lange Tradition (z.B. beim Rektumkarzinom). Eine amerikanische Studiengruppe stellte im Februar 2023 beim ASCO-GU ein Projekt vor, in dem eine MRT-gestützte stereotaktische Strahlentherapie vor eine Operation gestellt wird.
Fazit
Molekulargenetische Untersuchungen des Biopsiematerials vor der Strahlentherapie und des Operationspräparates sollen den Einfluss der Behandlung auf das immunologische Tumormikroenvironment beleuchten. Dies könnte Aufschluss geben über zukünftige zielgerichtete Therapien.Nach erfolgter neoadjuvanter Therapie eines Mannes mit lokal fortgeschrittenem Prostatakarzinom oder einem Hochrisikotumor wird man in Zukunft bereits aus der Molekulargenetik der Histologie ablesen können, welche zusätzlichen Therapien notwendig sein werden, um diese Patienten zu heilen. Es werden dazu von konventioneller Chemotherapie bis hin zu gezielten Immuntherapien individuell maßgeschneiderte Konzepte erarbeitet werden können.Die Zukunft der neoadjuvanten Therapie beim Prostatakarzinom hat erst begonnen.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Andrologie und rekonstruktive Urologie: Innovationen und was Sie für die Praxis wissen müssen
Der Kongress der Europäischen Vereinigung für Urologie (EAU) in Madrid bot ein Palette an andrologischen Themen und Highlights in der rekonstruktiven Urologie. Das Spektrum erstreckte ...
Nierenkarzinom: Spannendes, aber kaum Fortschritte im metastasierten Stadium
Wie schon beim ESMO 2024 erkennbar war, hat sich in der Therapie des metastasierten Nierenzellkarzinoms nicht viel geändert. Das spiegelt sich auch in der aktualisierten EAU-Leitlinie ...
Neue Entwicklungen im Management des benignen Prostatasyndroms
Die Therapie des benignen Prostatasyndroms (BPS) entwickelt sich hin zu individuell angepassten Strategien für jeden Patienten. Auf dem EAU-Kongress 2025 wurden Studien vorgestellt, die ...