Metastasierte Keimzelltumoren des Hodens – welchen Algorithmus wählen?
Bericht:
Vera Weininger, BA
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Tumorhistologie und die prognostische Einteilung nach IGCCCG sind bei metastasierten Keimzelltumoren des Hodens die Eckpfeiler der Therapieentscheidung. Expert:innen widmeten sich dem seltenen Schwerpunktthema metastasiertes Hodenkarzinom im Rahmen des 9. Michael J. Marberger Meeting am 15. Dezember 2023 in Wien und diskutierten therapeutische Ansätze und das Management von Seminomen und nichtseminomatösen Keimzelltumoren.
Keypoints
-
AS mit regelmäßigen Nachsorgeuntersuchungen mittels Tumormarker und CT bzw. MRT-Untersuchungen ist eine mögliche Vorgehensweise.
-
Verglichen mit der RPLND besteht unter CTx und RTx langfristig ein erhöhtes Risiko für CVD und sekundäre Malignome.
-
Die Postchemotherapie RPLND ist integraler Bestandteil im Management von NSGCT.
-
Komplexe Post-Chemotherapie-RPLND sind Experten in spezialisierten Zentren vorbehalten.
-
Nach der ersten Salvage- und insbesondere nach Hochdosis-Chemotherapie sind weitere Therapieansätze meist als palliativ anzusehen..
-
GCT-Rezidive müssen aufgrund der Komplexität in multidisziplinären Teams betreut werden.
Rezidive und Behandlungs-assoziierte Komorbiditäten sind im Erkrankungsverlauf und bei gängigen Therapien von Seminomen im Frühstadium häufig auftretende Komplikationen. Die Prävalenz von Keimzelltumoren des Hodens verteilt sich je zur Hälfte auf Seminome und nichtseminomatöse Keimzelltumoren (NSGCT). Ein wesentlicher Unterschied liegt in der Stadienverteilung der verschiedenen Keimzelltumoren des Hodens, da Seminome weitaus häufiger im Frühstadium (Stadium I in 80% der Fälle) detektiert werden, als es bei NSGCT der Fall ist (33%).
Active Surveillance bei Stadium-I-Seminomen
Aus Therapietrends in den USA aus dem Jahr 2011 lässt sich seit der Jahrhundertwende ein Befürworten der Active Surveillance (AS) nach Orchiektomie bei Patienten mit Stadium-I-Seminomen ableiten. Mittels retrospektiver Datenanalyse aus dem Jahr 2014 von Patienten mit Stadium-I-Seminomen wurden in einem medianen Follow-up von 52 Monaten die Häufigkeit von Rezidiven unter AS nach Orchiektomie und deren Effektivität ausgewertet.1 Bei einer Gesamtzahl von 1344 Patienten traten bei 13% im Beobachtungszeitraum Rezidive auf (n=173).1 Das krankheitsspezifische Überleben (DFS) und das Gesamtüberleben (OS) lagen bei 99%, der mediane Zeitraum bis zum Auftreten eines Rezidivs bei 14 Monaten.1 87% der Rezidive konnten mittels Computertomografie (CT) des Abdomens initial detektiert werden.1 Die Effektivität der Detektion von Lymphknotenrezidiven mittels CT bei Stadium-I-Seminomen unter AS mit einer Rezidivdetektionsrate von ca. 97% ist schon seit 2010 bekannt.2 Die Leitlinien des National Comprehensive Cancer Network (NCCN) geben hierzu Intervalle für Abdomen-/Becken-CTs bei Patienten unter AS nach erfolgter Orchiektomie vor.3 „Zukünftig sollten hier optimale Intervalle für Post-OP-CT- und MRT-Bildgebungen definiert werden“, betont Dr. Joel Sheinfeld, Deputy Chief und Direktor des Urology Fellowship Program des Memorial Sloan Kettering Cancer Center, New York, USA. Der Experte hebt die AS mit regelmäßiger CT-Rezidivdetektion bei Stadium-I-Seminomen hervor.
CTx & RTx vs. retroperitoneale Lymphknotendissektion
Im NCCN-Therapiealgorithmus von Stadium IIA- und IIB-Seminomen besteht in beiden Stadien eine starke Gewichtung auf Strahlentherapie (RTx) bzw. Chemotherapie (CTx).4 Das Risiko, durch die Therapietoxizität einer RTx oder CTx Langzeitfolgen zu entwickeln, erstreckt sich über einen sehr langen Zeitraum nach Erstdiagnose.5 Kardiovaskuläre Erkrankungen (CVD) können demnach 10–15 Jahrebzw. sekundäre Malignome (SMN) sogar 20–25 Jahre nach Diagnosestellung auftreten.5 „Das kumulative Risiko für CVD/SMN nach CTx- bzw. RTx-Behandlung von Keimzelltumoren ist damit weitaus höher, als es in Daten zur retroperitonealen Lymphknotendissektion der Fall ist“, so Sheinfeld.
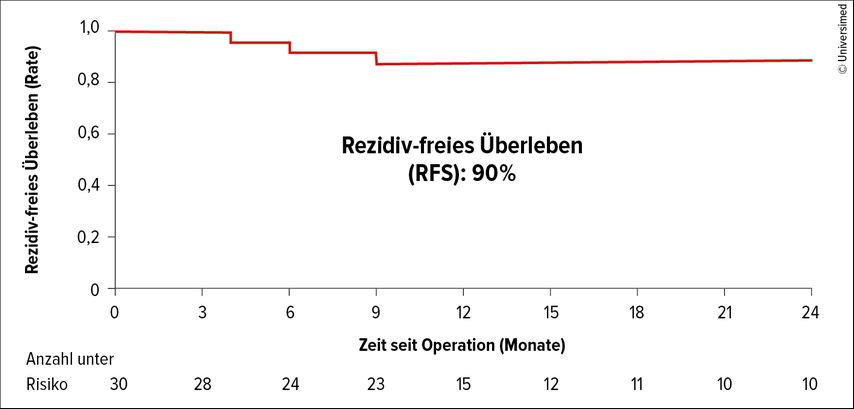
In einer kleinen Phase-II-Studie zur retroperitonealen Lymphknotendissektion (RPLND) bei früh metastasierten Seminomen wurden 55 Patienten mit Stadium-I- und/oder Rückfall auf Stadium-IIA/B-Seminome (25%) bzw. mit Stadium-IIA/B-Seminomen bei Erstpräsentation (75%) inkludiert.6 Das primäre Ergebnis der Studie war ein Rezidiv-freies Überleben (RFS) von 2 Jahren bei 81% der Patienten, die eine RPLND erhielten.6 Die COTRIMS-Studie bestätigte bei noch kurzer Nachbeobachtungszeit die hohe Heilungsrate durch RPLND bei Stadium-IIA/B-Seminom-Patienten (RFS: 90%; Abb. 1).7 Eine RPLND war zudem mit deutlich weniger Behandlungs-bezogener Morbidität assoziiert, als es im COTRIMS-Patientenkollektiv mit indizierter RTx- und CTx-Therapie der Fall war.7 Diese Strategie ist aktuell noch Studien vorbehalten.
Abb. 1: Ergebnisse der COTRIMS-Studie: Kaplan-Meier-Kurve zu Rezidiv-freiem Überleben nach RPLND bei Stadium-IIA/B-Seminom-Patienten (modifiziert nach Heidenreich A et al. 2023)7
NSGCT – Post-Chemotherapie-Restmasseresektion und Metastasektomie
Die EAU-Leitlinien empfehlen, nach Chemotherapie bei nichtseminomatösen Keimzelltumoren residuelle Metastasen in allen Arealen vollständig zu resezieren.8 In der klinischen Praxis braucht es dafür eine sehr hohe chirurgische Expertise, um bei oft komplexer anatomischer Lokalisation der Restmassen den geeigneten Zugangsweg retroperitoneal, suprahilär und retrokrural zu wählen. „Präoperativ sollte immer der beste Zugangsweg zur Tumorrestmasse, zu großen retroperitonealen Gefäßen bzw. zu benachbarten Organen abgewogen werden“, so Univ.-Prof. DDr. h.c. Axel Heidenreich, Klinikdirektor und Leiter des Uro-onkologischen Zentrums der Universitätsklinik Köln, Deutschland. „Denn sobald eine RPLND, die bereits durchgeführt wurde, wiederholt werden muss, ist der Eingriff immer als komplexe Situation einzustufen, da häufig zusätzlich eine Resektion von benachbarten Organen wie Niere, Duodenum, Milz und Leber und eine Resektion der retrokruralen Lymphknoten indiziert sind.“
Sheinfeld hebt hier die Wichtigkeit bilateraler Templates (e.g. anatomische Grenzen des rechten und linken Retroperitoneums) in der RPLND-Chirurgie hervor. Sie vergrößern aber optimieren anders als unilaterale Templates den therapeutischen Wert des Eingriffs und das Tumorstaging. „Modifizierte Templates sind onkologisch definitiv unterlegen, da es leicht zu Unterklassifizierungen des Stadiums und möglicherweise zu einer nicht ausreichenden Behandlung des Retroperitoneums kommen kann“, so Sheinfeld.
Resektion benachbarter Organe und von Gefäßen
Der Eingriff zur Organresektion ist in 10–15% der Fälle nach Chemotherapie notwendig, um kein vitales Krebsgewebe oder Teratom zurückzulassen.9 Es gibt prädiktive Marker, die eine vaskuläre Resektion der Vena cava inferior oder der Aorta abdominalis und eine venöse/arterielle Beteiligung bei Patienten wahrscheinlich machen. Eine vaskuläre Resektion ist häufiger notwendig bei intermediärer/schlechter Prognose verglichen mit guter Prognose (14,1% vs. 4,8%; p=0,0047), bei Residualtumoren >5cm vs. Residualtumoren <5cm (17,9% vs. 3,7%; p=0,0001) bzw. bei Residualtumoren, die zwei Drittel des Gefäßdurchmessers der Vena cava oder der Aorta umhüllen.10
Die Häufigkeit von Operations-assoziierten Komplikationen bei gefäßchirurgischem Eingriff unterscheidet sich nicht wesentlich von derjenigen einer nichtkomplexen RPLND-Operation.9 „Wann auch immer ein benachbartes Organ reseziert werden muss, muss dieser Eingriff zwingend durchgeführt werden, denn die meisten Post-Chemotherapie-RPLNDs sind kurative Eingriffe“, betont Heidenreich.
Salvage-Therapiestrategie – Tumorrezidiv nach konventioneller CT
„20–30% der Patienten mit Keimzelltumoren des Hodens haben, abhängig von den prognostischen Faktorennach IGCCCG einen Rückfall nach erfolgter Erstlinientherapie und die Prognose nach Zweitlinientherapie ist ungünstig“, so Prof. Dr. Maria De Santis, Sektionsleiterin interdisziplinäre Uro-Onkologie der Charité Berlin, Deutschland. In einer Rückfallsituation sind daher prognostische Marker zur Prognoseabschätzung von Vorteil, an die eine Salvage-Therapiestrategie angelehnt werden kann. In einer Metaanalyse von Lorch et al. wurden als unabhängige prognostische Variablen zur Prognoseabschätzung die Tumorhistologie, die primäre Tumorlokalisation, das Ansprechen und die Länge des progressionsfreien Intervalls nach Erstlinie, Tumormarker (AFP, HCG) sowie Leber-, Knochen- und Gehirnmetastasen zum Zeitpunkt der Salvage-Therapie ermittelt.11 Zusammengefasst ergibt sich daraus die International Prognostic Factors Study Group Classification, durch die eine Aussage über den Zeitraum des PFS bei Keimzelltumorrezidiv getroffen werden kann (sehr niedriges bis sehr hohes Risiko für Progression).
Hochdosis vs. konventionelle Dosis bei Salvage-Chemotherapie
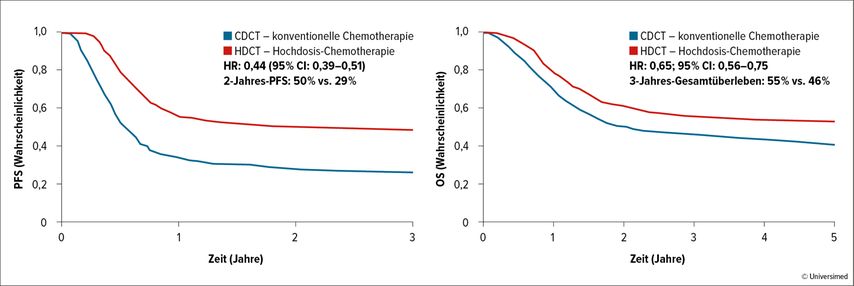
Zur Effektivität der konventionellen Dosis bei Salvage-Chemotherapie („salvage conventional-dose chemotherapy“, SCDCT) liegen derzeit keine großen randomisierten Studienergebnisse vor. Lediglich mit dem TIP-Regime (Paclitaxel, Ifosfamid, Cisplatin) als Zweitlinientherapie konnte eine krankheitsfreie Rate von 80% bei hochselektiven Patienten mit sehr niedrigem bis niedrigem Progressionsrisiko erzielt werden.12 Eine retrospektive Studie aus dem Jahr 2011 verglich SCDCT mit Hochdosis-Salvage-Chemotherapie (SHDCT) als Zweitlinientherapie nach Rückfall bei Patienten mit metastasiertem Keimzelltumor (GCT). Es konnte ein Benefit für SHDCT im PFS (HR: 0,44; 95% CI: 0,39–0,51) und im OS (HR: 0,65; 95% CI: 0,56–0,75) gezeigt werden.11 Bei niedrigem Progressionsrisiko lagen ähnliche Daten für das OS sowohl bei SHDCT als auch SCDCT vor.11 Über alle Risikogruppen hinweg ergab sich ein Vorteil für die SHDCT vs. SCDCT im 2-Jahres-PFS (50% vs. 29%) und 3-Jahres-Gesamtüberleben (55% vs. 46%; Abb. 2).11
Abb. 2: Salvage-Chemotherapie: SCDCT vs. SHDCT über alle Risikogruppen der International Prognostic Factors Group hinweg (modifiziert nach Lorch A et al. 2011)11
„Eine sequenzielle SHDCT ist der SCDCT überlegen und sollte für alle Rezidivpatienten angedacht werden, bis festgemacht werden kann, ob für diese Patienten auch eine SCDCT ausreichend ist“, so De Santis. Die SHDCT ist in der Zweitlinie oder darüber hinaus weniger effektiv als in der Erstlinien-Salvagetherapie. „Operative Methoden sind im Setting der Salvage-Strategie jedoch immer kritisch zu betrachten“, ergänzt De Santis. Jede weitere Chemotherapie, die über die erste Salvage-Chemotherapie hinausgeht (egal, ob Mono-, Double- oder Tripeltherapie), ist demnach als palliativ anzusehen und hat nur eine sehr limitierte Langzeitwirksamkeit.
Ausblick
Die Post-Chemotherapie-RPLND ist integraler Bestandteil im Management von Hodenkrebs und durch die Komplexität sind diese operativen Eingriffe v.a. Experten in spezialisierten Zentren vorbehalten. Zukünftig könnten hier mittels Radiomics-Bildgebung vor RPLND mit sehr hoher Genauigkeit (96%) malignes und benignes Gewebe bei metastasierten Keimzelltumoren des Hodens detektiert undvoneinander differenziert werden, was bei benigner Fibrosierung eine RPLND nach Chemotherapie abwenden könnte.13 Zwei Biomarker (AGR2, KRT19) könnten zusätzlich zukünftig bei der Differenzierung zwischen Teratomen und Nekrosen nach Chemotherapie im PET-CT-Scan helfen.14 Bei Rezidiven nach Chemotherapie gibt es abseits der SHDCT erste vielversprechend Ergebnisse zu CLDN6-CAR-T-Zellen, die in Phase-I- und Phase-II-Studien eine ermutigende Wirksamkeit bei schwer vorbehandelten GCT-Patienten zeigen (ORR 57% and DCR 85%; n=7).15
Quelle:
Sessions „Emerging role of RPLND in low-stage seminoma“ von Dr. Joel Sheinfeld, „Surgical management of complex residual masses following chemotherapy for metastatic germ cell tumors“ von DDr. Axel Heidenreich, „Management of testis cancer relapse“ von Dr. Maria De Santisam 15. Dezember im Rahmen der Veranstaltung „Visiting Professorships & 9th Michael J. Marberger Meeting“, 13.–18. Dezember 2023, Wien
Literatur:
1 Kallmannsberger C et al.: Patterns of relapse in patients with clinical stage I testicular cancer managed with active surveillance. J Clin Oncol 2015; 33(1): 51-7 2 Tolan S et al.: No role for routine chest radiography in stage I seminoma surveillance. Eur Urol 2010; 57(3): 474-9 3 Beard CJ et al.: Follow-up management of patients with testicular cancer: a multidisciplinary consensus-based approach. J Natl Compr Canc Netw 2015; 13(6): 811-22 4 Gilligan T et al.: NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Testicular Cancer. Version 1.2022. https://www.lissod.com.ua/doctor/files/testicular-%D0%A0%D0%B0%D0%BA%20%D1%8F%D0%B8%D1%87%D0%B5%D0%BA.pdf ; zuletzt aufgerufen am 26.1.2024 5 van den Belt-Dusebout AW et al.: Treatment-specific risks of second malignancies and cardiovascular disease in 5-year survivors of testicular cancer. J Clin Oncol 2007; 25(28): 4370-8 6 Daneshmand S et al.: Surgery in early metastatic seminoma: a phase II trial of retroperitoneal lymph node dissection for testicular seminoma with limited retroperitoneal lymphadenopathy. J Clin Oncol 2023; 41(16): 3009-18 7 Heidenreich A et al.: Retroperitoneal lymph node dissection in clinical stage IIA/B metastatic seminoma: results of the COlogne trial of retroperitoneal lymphadenectomy in metastatic seminoma (COTRIMS). Eur Urol Oncol 2023; S2588-9311(23)00117-7 8 Nicol D et al.: EAU Guidelines on testicular cancer. Limited update März 2023. https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Testicular-Cancer-2023_2023-04-12-091409_hqrv.pdf ; zuletzt aufgerufen am 26.1.2024 9 Heidenreich A et al.: Surgical management of complex residual masses following systemic chemotherapy for metastatic testicular germ cell tumours. Ann Oncol 2017; 28(2): 362-7 10 Winter C et al.: Residual tumor size and IGCCCG risk classification predict additional vascular procedures in patients with germ cell tumors and residual tumor resection: a multicenter analysis of the German Testicular Cancer Study Group. Eur Urol 2012; 61(2): 403-9 11 Lorch A et al.: Conventional-dose versus high-dose chemotherapy as first salvage treatment in male patients with metastatic germ cell tumors: evidence from a large international database. J Clin Oncol 2011; 29(16): 2178-84 12 Motzer RJ et al.: Paclitaxel, ifosfamide, and cisplatin second-line therapy for patients with relapsed testicular germ cell cancer. J Clin Oncol 2000; 18(12): 2413-8 13 Baessler B et al.: Radiomics allows for detection of benign and malignant histopathology in patients with metastatic testicular germ cell tumors prior to post-chemotherapy retroperitoneal lymph node dissection. Eur Radiol 2020; 30(4): 2334-45 14 Nestler T et al.: Differentially expressed messenger RNA/proteins can distinguish teratoma from necrosis in postchemotherapy retroperitoneal lymph node dissection tissue. Cancer 2023; 129(4): 634-42 15 Maeckensen A et al.: A phase I trial to evaluate safety and efficacy of CLDN6 CAR T cells and CLDN6-encoding mRNA vaccine-mediated in vivo expansion in patients with CLDN6-positive advanced solid tumours. Ann Oncol 2022; 33(7): 1404-5
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...