Hodentumor – Diagnostik und Therapie
Autor:
OA Dr. Franz Stoiber
Abteilung für Urologie und Andrologie
Salzkammergut-Klinikum Vöcklabruck
E-Mail: franz.stoiber@ooeg.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Keimzelltumor stellt die häufigste maligne Erkrankung des jungen Mannes mit einer Inzidenz von 9–11 pro 100000 Männer dar. Das 5-Jahres-Überleben in allen Stadien liegt bei über 95%. Eine Übersicht zeigt den aktuellen Stand der Diagnostik und Therapie sowie was im Langzeitverlauf zu erwarten ist.
Keypoints
-
Die Heilungsraten von Patienten mit Keimzelltumor sind hervorragend – es gibt sehr viele Langzeitüberlebende.
-
Langzeittoxizitäten sind den angewandten Therapien (Chemo- und Radiotherapie) geschuldet.
-
Eine erhöhte kardiovaskuläre Mortalität ist nicht bestätigt, jedoch eine erhöhte kardiovaskuläre Morbidität.
-
Daher sollten Chemo- und Radiotherapie vermieden oder zumindest reduziert werden und der Observanz sollte der Vorzug gegeben werden.
-
Patienten müssen über diese Langzeitfolgen aufgeklärt und auf Vorsorgeprogramme hingewiesen werden.
Die größte Häufigkeit weisen die skandinavischen Länder, wie Norwegen und Dänemark, aber auch die Schweiz auf.Knapp 60% der Tumoren treten als Seminome, 40% als Mischtumoren, sogenannte Nichtseminome auf, die sich aus embryonalem sowie Chorionkarzinom und Dottersacktumor wie auch aus reifem und unreifem Teratom zusammensetzen. Letzteres enthält Knochen, Knorpel, Drüsen und weitere völlig ausgereifte Gewebstypen, gilt als chemoresistent und ist nur chirurgisch sanierbar. 70% aller Tumoren sind lokal begrenzt, 5% können auch extragonadal auftreten und manifestieren sich meist als sogenannte „Midlinetumoren“ im Retroperitoneum oder – mit schlechtester Prognose – im Mediastinum. Eine prognostische und diagnostische Rolle für das Vorhandensein eines Keimzelltumors spielt das Isochromosom i12p, das in 80% nachgewiesen werden kann.
Der Altersgipfel der Seminompatienten liegt mit 35 Jahren höher als der der Nichtseminome mit einer zweiten Spitze im 5. bis 6. Lebensjahrzehnt, während die Patienten mit einem Nichtseminom meist in der 2. bis 3. Dekade diagnostiziert werden.
Das relative familiäre Hodentumorrisiko (RR) beträgt 2,0, aber auch Gonadendysgenesien und der Kryptorchismus sind mit einem ähnlich hohen RR von 2,9 vergesellschaftet.
Stadieneinteilung
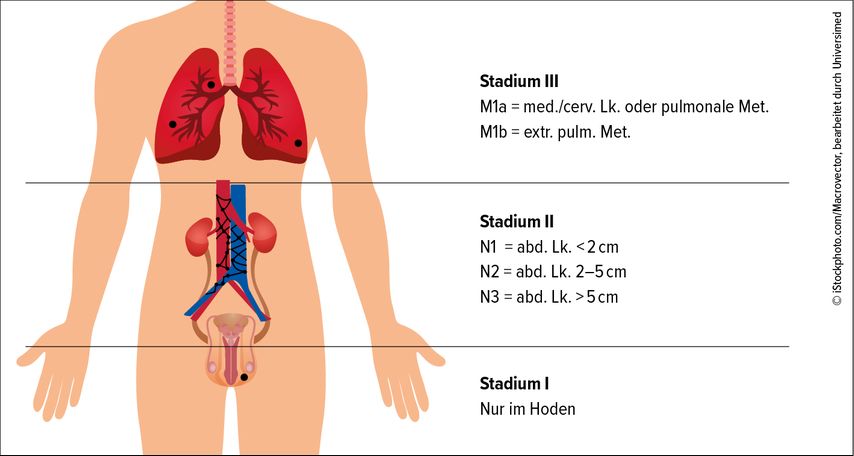
Die Stadieneinteilung erfolgt nach UICC bzw. der Lugano-Klassifikation, wonach das Stadium I lokal auf das Organ beschränkt ist (Abb. 1). Retroperitoneale Lymphknotenmetastasen in der Größenordnung von <2cm bis >5cm bestimmen das Stadium II (A: <2cm, B: 2–5cm; C: >5cm Querdurchmesser), wobei die Lokalisation für den jeweils tumortragenden Hoden spezifisch ist: Der linksseitige Tumor metastasiert in der Regel paraaortal mit der „Landingzone“ unter dem Abgang der Nierenvene sowie retro-, präaortal und links iliakal.
Der rechtsseitige Tumor setzt die Metastase meist paracaval in Höhe der Vena- testicularis-Einmündung, dann retro- und interaortocaval sowie iliakal rechts. Ein Switch auf die kontralaterale Seite wird eher beim rechtsseitigen Tumor beobachtet. Dies hat auch dazu geführt, dass die retroperitoneale Lymphadenektomie in spezieller Indikation meist nach diesen sogenannten Templates erfolgt. Die supradiaphragmale Ausbreitung, entweder pulmonal oder extrapulmonal, bestimmt dann das Stadium III (A: pulmonal oder lymphogen zervikal und/oder mediastinal; B: extrapulmonal viszeral). Eine Besonderheit des pT-Stadiums ist das pT0, das keinen Tumor im Hoden, sondern eventuell eine Narbe findet, wobei allerdings gleichzeitig bereits eine retroperitoneale oder anders lokalisierte Metastase vorliegen kann. Dies wird dann auch als „burned out“ Testis bezeichnet. Die metastatische Deposition ist seitenzugewandt und kein Midlinetumor. Als pT2 gelten sowohl die Penetration der Tunica albuginea als auch die Angio-/Lymphinvasion (VI/LI).
Risikokriterien
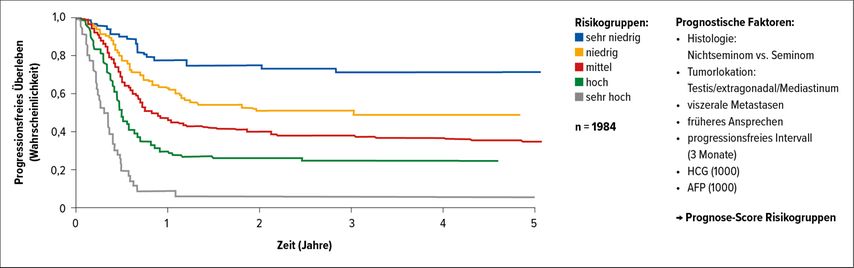
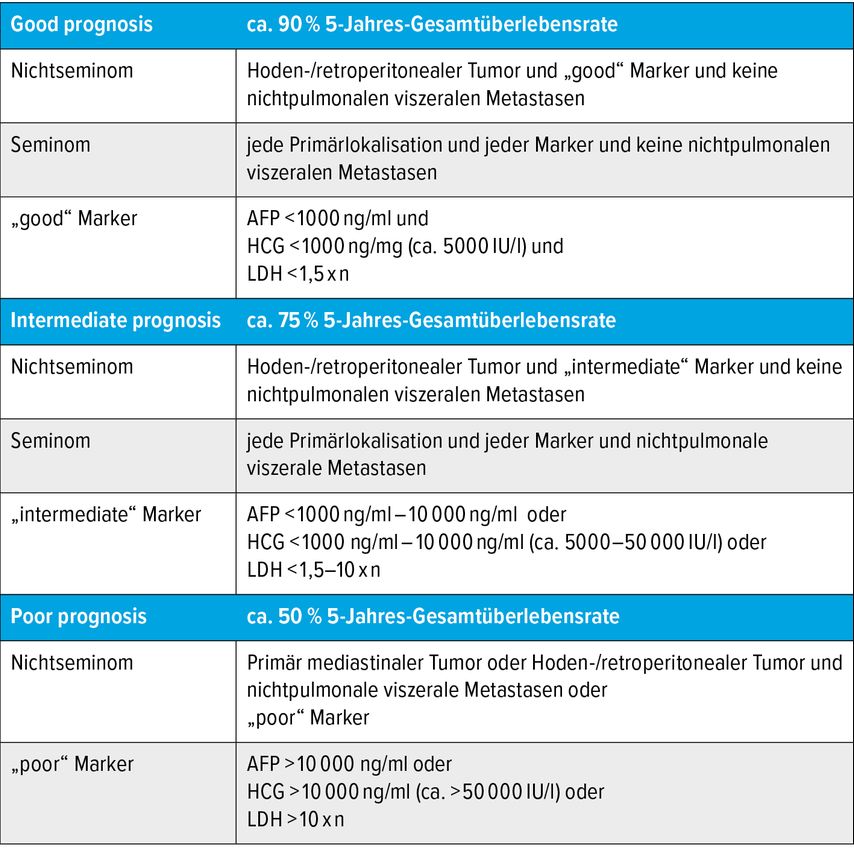
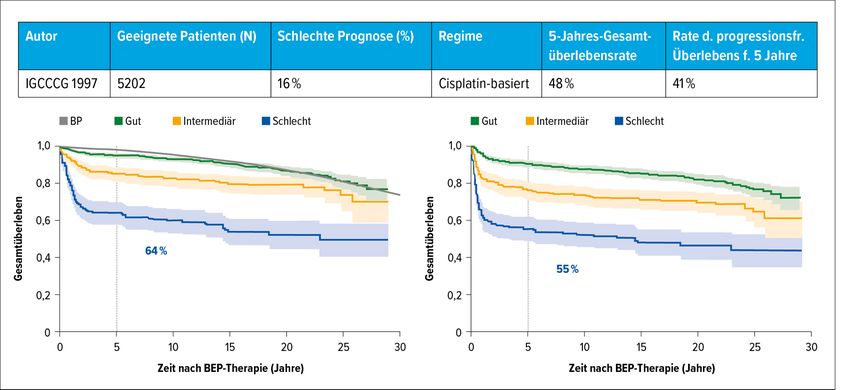
Seit 1997 gilt die IGCCCG-Klassifikation, die den Hodentumor nach „Good“-, „Intermediate“- und „Poor risk“-Kriterien einteilt (Tab. 1). Dabei werden die Lokalisation des Primärtumors (gonadal vs. extragonadal), die der Metastasen (extrapulmonal/viszeral) und, in der Onkologie einzigartig, die Höhe der Tumormarker AFP, Beta-HCG und LDH, klassifiziert als S0–3, herangezogen. Daraus ergab sich eine 5-Jahres-Überlebensrate für die 3 Gruppen von 90%, 75% und 50%, die im Laufe der letzten 20 Jahre um 10 und 15% in allen Risikogruppen angestiegen ist (Tab. 2 und Abb. 2).
Tab. 2 und Abb. 2: Schlechte Prognose – damals (1997) und heute (2017). Tabelle nach International Germ Cell Cancer Collaborative Group (IGCCCG), J Clin Oncol 1997; 15(2): 594-603; Abbildung nach Kier MG et al.: Eur Urol 2017; 71(2): 290-8
Symptomatik und Diagnostik
Auffällig wird der Patient mit einer getasteten schmerzlosen Verhärtung des Hodens. Selten führen Brustschwellung, Kreuzschmerzen, asymptomatische Hydronephrosen, neurologische oder respiratorische Symptome oder Hodenschmerzen (aufgrund einer Einblutung des Tumors und der daraus folgenden Kapselspannung) zur Diagnose, die in den allermeisten Fällen durch eine Hodensonografie erhärtet wird. Eine MRT wird lediglich in Ausnahmefällen benötigt.
Die Bestimmung der Tumormarker und eine CT sind die weiteren Stagingmaßnahmen. Lediglich bei exzessiv erhöhtem Beta- HCG, ausgeprägter pulmonaler Metastasierung und neurologischer Symptomatik sollte ein Schädel-MRT angeschlossen werden. Die PET-CT hat im primären Staging keinen Stellenwert. Eine Biopsie ist nur bei einem extragonadalen Primum mit unklaren Tumormarkern erforderlich. Die Kryokonservierung der Spermien sollte vor jeder Therapie angeboten werden.
Die Bestimmung der Tumormarker AFP, Beta-HCG und LDH (beim Seminom und nikotinabstinenten Patienten kann die HPLAP hilfreich sein, da sie in 50–60% positiv ist) bei Erstdiagnose bzw. vor der Orchiektomie und postoperativ ist essenziell. Erst dann kann die Risikostratifizierung nach IGCCCG durchgeführt werden. Die Marker müssen vor jedem Chemozyklus kontrolliert werden und dienen als wesentliches Follow-up-Instrument.
Deren Bestimmung sollte alle 3–5 Tage nach Orchiektomie bis zum Nadir, bis zu einer eventuellen Negativierung oder bis zum neuerlichen Anstieg erfolgen.
Das AFP ist v.a. beim Dottersacktumor („yolk sac tumor“), beim embryonalen Karzinom und Teratokarzinom erhöht, nie aber beim Seminom und Chorionkarzinom. Malignome des GI-Traktes und vor allem Leberdysfunktionen gehen ebenfalls mit einer Erhöhung einher. Selten kommt es zu konstitutionellen Erhöhungen, die allerdings keinen linearen oder gar exponentiellen Anstieg zeigen und zwischen 10 und 30ng/ml stagnieren. Die Halbwertszeit (HWZ) des AFP liegt bei 5–7 Tagen. Das HCG hingegen hat eine HWZ von 24–36h und ist bei 30% der Seminome sowie in 40–60% der Chorionkarzinome positiv, bei diesen kann es exorbitante Höhen erreichen.
Falsch positive Werte finden sich, wenn gynäkologische Tumoren, Blasenkarzinome oder Malignome des GI-Traktes vorliegen. Deshalb sind Tumormarker nicht als Screeningtool geeignet. Bei unklaren HCG-Erhöhungen sollte in der Anamnese ein Cannabisabusus eruiert werden. Die unspezifische LDH ist unter anderem beim „Good prognosis“-Seminom beachtenswert, denn eine 2,5-fache Erhöhung verschiebt den Tumor in ein intermediäres Risikostadium und zieht eine andere Therapie nach sich.
Brandneu und noch in klinischer Evaluierung ist die mikro-RNA miR-371a-3p als Tumormarker mit einer knapp 90%igen Sensitivität, der Diagnostik und Therapieerfolg zukünftig präziser anzeigen soll.
Therapie
Die primäre operative Behandlung umfasst die inguinale Orchiektomie des tumortragenden Hodens sowie die Biopsie des kontralateralen Organs zur Bestimmung einer eventuell vorhandenen GCNIS („germ-cell neoplasia in situ“) beim unter 45-jährigen Patienten, die in 2–4% der Fälle vorliegen kann und dann in 70% innerhalb von 7 Jahren zu einem invasiven Tumor werden kann. Beim Vorliegen einer solchen empfiehlt sich die Radiotherapie (RT) des Einzelhodens mit 18–20Gy, die durchaus zeitversetzt durchgeführt werden kann. In seltenen Fällen wie einer primären Intensivpflichtigkeit aufgrund ausgedehnter viszeraler Metastasierung kann laut einem ESMO Consensus Paper eine primäre Orchiektomie zugunsten einer eventuellen induktiven „Mini-Chemotherapie“ mit Cisplatin/Etoposid in 2-wöchigen Intervallen mit nachfolgenden regelrechten Chemotherapiezyklen hintangestellt, darf aber nie ausgelassen werden. Die Therapie des Keimzelltumors richtet sich nach dem klinischen Stadium, der Histologie und der Risikoeinschätzung nach IGCCCG. Im Stadium I des Seminoms gibt es 2 retrospektiv evaluierte Risikofaktoren, die eine okkulte Metastasierung voraussagen. Fehlt die Rete-testis-Infiltration und ist der Tumor kleiner als 4cm, liegt ein Rezidivrisiko von lediglich 5% vor und die aktive Surveillance ist die Methode der Wahl. Bei Vorliegen beider Faktoren kommt es bei ca. einem Fünftel der Patienten in den nächsten 6–36 Monaten zum Auftreten von Metastasen, das Risiko dafür kann mit 2 Zyklen adjuvantem Carboplatin auf 1–2% reduziert werden. Liegt lediglich 1 Faktor vor, wobei die Rete-testis-Infiltration schwerer wiegt als die Größe, stehen mit einem Zyklus Carboplatin oder der Radiotherapie zwei nahezu äquieffektive Therapien zur Verfügung. Eine Surveillance ist immer eine Option, da sich das Gesamtüberleben mit einer erst bei vorhandener Metastasierung eingeleiteten Therapie nicht ändert, wohl aber die Intensität einer solchen.
Die RT erfolgt mit 20–26Gy und umfasst das Retroperitoneum in Höhe BWK 11 bis LWK 4/5. Die Toxizität beider therapeutischer Verfahren ist gering, aber man sollte das doch vorhandene Induktionspotenzial von etwa 1–2% für Zweitmalignome durch eine RT ab 15 Jahren nach Therapieende nicht außer Acht lassen. Für Carboplatin gibt es diesbezüglich keine Risiken. Das Stadium IS nimmt insofern eine Sonderstellung ein, als dass trotz Markerpersistenz nach Orchiektomie keine Metastasen in der Bildgebung gefunden werden können. Somit sollte nach Ausschluss anderer Ursachen für diese Markererhöhung eine Kontrolle der Bildgebung nach 6–8 Wochen angestrebt und mit der Therapie bis zum Nachweis von Absiedelungen bzw. einem eindeutigen linearen oder exponentiellen Markeranstieg zugewartet werden. Einer systemischen Therapie ist gegenüber einer retroperitonealen Lymphadenektomie (RLA), die auch von diagnostischer Wertigkeit (Mikrometastasen) sein kann, der Vorzug zu geben, da Metastasen vorwiegend außerhalb des Retroperitoneums auftraten.
Das in nur 15% aller Keimzelltumoren vorkommende Stadium IIA/B des Seminoms stellt eine sehr gute Radiotherapieindikation dar, da die Alternativtherapie 3 Zyklen PEB (Cisplatin/Etoposid/Bleomycin) eine höhere Toxizität aufweist und die Rezidivrate annähernd ident ist. Randomisierte Vergleichsstudien fehlen wegen der Seltenheit des Stadiums, sodass die Patienten über Nebenwirkungen, Langzeittoxizitäten wie Sekundärmalignome und mögliche Salvage-Therapien bei Rezidiven aufgeklärt werden müssen. Die Dosis der RT unterscheidet sich im Stadium A und B (30 vs. 36 Gy). Die Therapie des Stadiums IIC des Seminoms mit einer meist lymphogenen retroperitonealen Bulky Disease ist die Domäne der je nach IGCCCG-Risiko 3–4 Zyklen umfassenden PEB-Chemotherapie. Der Residualtumor sollte dann mit einem FDG-PET 6 Wochen nach Beendigung der Chemozyklen kontrolliert und bei negativem Befund einer Observanz unterzogen werden. Der „negative predictive value“ (NPV) bei Residualtumoren über 3cm liegt bei über 90%. Ein positives PET-Ergebnis bedarf einer engmaschigen Kontrolle oder kann reseziert werden, wenngleich die desmoplastische Reaktion des postchemotherapeutischen Seminoms die Operation äußerst anspruchsvoll macht. Eine RT bleibt ohne Benefit.
Ein eindeutiger Progress wird mit einer Salvage-Chemotherapie behandelt.
Die aktive Surveillance ist auch die Domäne beim nichtseminomatösen Keimzelltumor (NSGCT) im Stadium I, wobei die beiden Risikofaktoren für eine Metastasierung prospektiv validiert wurden. Liegen eine intratumorale Angio-/Lymphinvasion (V1/L1) und ein embryonales Karzinom in über 50% des Tumors vor, kommt es in 50–80% der Fälle zum Rezidiv. Das Risiko dafür kann durch einen Zyklus PEB Chemotherapie auf 2–3% reduziert werden. Allein der V1+-Tumor ist mit einem mehr als 25%igen Rezidivrisiko verbunden.
Diesseits des Atlantiks ist die in den USA häufiger praktizierte retroperitoneale Lymphadenektomie in den Hintergrund getreten, da sie keinen Vorteil gegenüber einem Zyklus PEB zeigen konnte, selten und somit nicht flächendeckend hochqualitativ angewandt wird und somit mit einer höheren Morbidität vergesellschaftet ist. Eine gute Indikation stellt allerdings das Vorliegen eines reifen Teratoms im Hoden dar, aber auch hier sind die aktive Surveillance und die verzögerte RLA erst bei Auftreten von markernegativen Metastasen eine gangbare Alternative. Die Lymphknotenvergrößerungen im Stadium IIA des NSGCT können auch reaktiv sein, sodass bei Markernegativität eine Kontrolle der Bildgebung nach 6–8 Wochen empfohlen wird. Eine RLA sollte dann bei eindeutigem Progress erwogen werden, da die Möglichkeit des Vorliegens eines reifen Teratoms besteht. Im Falle einer Markerpositivität wird die primäre Chemotherapie präferiert und im Falle eines posttherapeutischen Residuums sollte dieses reseziert werden, wenn es größer als 1cm ist. Wird eine primäre RLA durchgeführt, sollte im pN0-Stadium observiert werden und bei pN1, 2 eine adjuvante Chemotherapie mit 2 Zyklen PE, die das Rezidivrisiko auf 2–3% absenkt, der Observanz gegenübergestellt werden. Im Stadium IIB des NSGCT bevorzugt man heute primär die Chemotherapie mit 3 Zyklen PEB oder 4 Zyklen PE bei einer Bleomycin-Kontraindikation und reseziert dann den Resttumor im Rahmen einer Template-gesteuerten RLA. Seltener wird der umgekehrte Ablauf mit primärer RLA und 2 Zyklen umfassender adjuvanter Chemotherapie angeboten. Mit der primären Chemotherapie besteht eine höhere Chance, dass nur mit einer Modalität das Auslangen gefunden und die Morbidität niedrig gehalten wird.
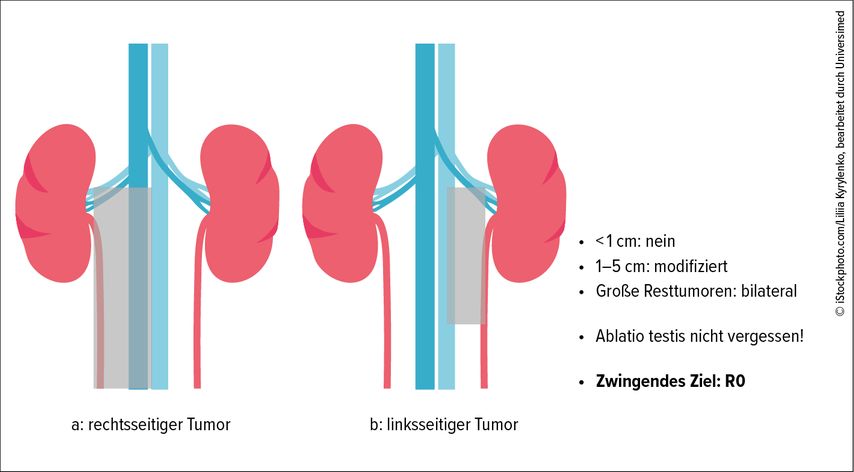
Das Stadium IIC des NSGCT ist nach IGCCCG mit 3–4 Zyklen PEB zu therapieren und der Residualtumor sollte mit einer R0-Intention reseziert werden. Die Nekrosewahrscheinlichkeit liegt dabei um die 50%, vitaler Tumor wird in 10–20% und ein Teratom in knapp 40% der Fälle gefunden. Die Resektion kann abhängig von der Tumorgröße Template-gesteuert oder bilateral und eventuell schnellschnittgesteuert (vor allem bei Vorliegen eines Teratoms) erfolgen (Abb. 3). Das metastasierte Stadium wird je nach IGCCCG-Risikokategorie mit 3 bzw. 4 Zyklen PEB-Chemotherapie behandelt. Liegt eine Bleomycin-Kontraindikation vor (Alter >45 Jahre, Nikotinabusus und eingeschränkte Lungenfunktion, Niereninsuffizienz), können anstelle von 3 Zyklen PEB 4 Zyklen PE in der „Good prognosis“-Gruppe gleichwertig appliziert werden. In den Gruppen mit „intermediate“ und „poor risk“ müssen 4 Zyklen PEB oder alternativ PEI (Cisplatin/Etoposid/Ifosfamid) oder TIP (Paclitaxel/Ifosfamid/Ciaplatin) mit GCSF-Support beim älteren Patienten verabreicht werden. Das Seminom kennt keine „Poor risk“-Kategorie. Die Chemotherapie soll volldosiert und ohne zeitliche Verzögerung unabhängig von der Hämatotoxizität im 3-wöchigen Intervall verabreicht werden. Ein Restaging wird nach 2 Zyklen oder bei inadäquatem Markerabfall, der vor jedem Zyklus kontrolliert wird, empfohlen. Wegen einer Thromboserate von bis zu 20% soll auf einen zentralen Venenzugang möglichst verzichtet werden.
Die postchemotherapeutische Residualtumorresektion im metastasierten Stadium III muss alle Lokalisationen umfassen, da eine Konkordanz der Metastasenhistologie lediglich in 20–50% vorliegt. Lediglich eine Nekrose in einer Lunge erspart die Resektion der kontralateralen Seite. Primär sollte mit der Resektion des Retroperitoneums 4–6 Wochen nach Chemotherapie bei negativen, nicht steigenden und auf niedrigem Niveau stagnierenden Tumormarkern begonnen werden. Die ca. 16% umfassende Gruppe der „Poor risk“-Patienten hat derzeit den höchsten Research-Bedarf, da noch keine Standardtherapie etabliert ist. Ein eindeutiger Vorteil einer primären Hochdosischemotherapie gegenüber der seit 1987 geltenden, 4 Zyklen umfassenden konventionellen PEB-Chemotherapie ist trotz zahlreicher Intensivierungsversuche noch nicht gezeigt worden. Lediglich in Einzelfällen konnte die HD-Chemotherapie bei primären zerebralen oder hepatalen Metastasen und bei primären mediastinalen Keimzelltumoren einen Überlebensvorteil zeigen.
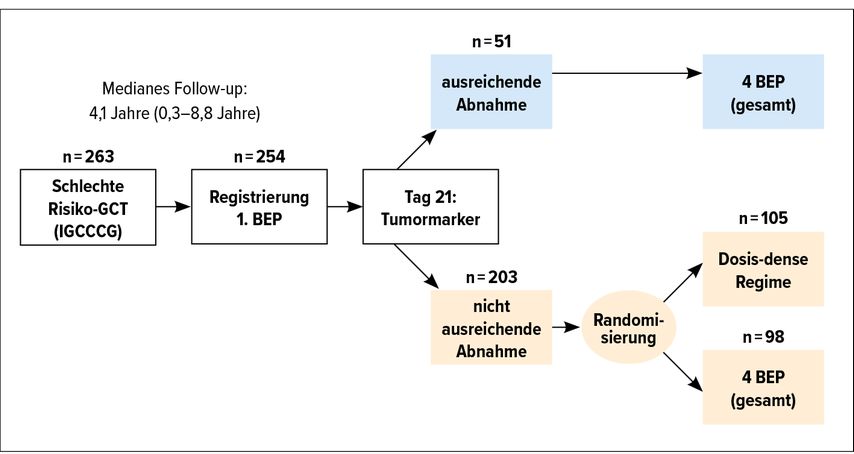
Der Nachweis eines ungenügenden Tumormarkerabfalls nach dem ersten Zyklus PEB definierte eine prognostisch ungünstige Patientengruppe, deren Therapie anschließend intensiviert wurde, worauf sie ein längeres Überleben zeigte als die konventionell therapierte Gruppe, jedoch ein kürzeres im Vergleich mit jenen Patienten, die einen Markerabfall entsprechend der Halbwertszeit zeigten (Abb. 4). Die Art der intensivierten Chemotherapie ist allerdings noch unklar, sie wird oft im Sinne einer sequenziellen HD-Therapie nach TICE-Schema angeboten. Ein ähnliches Dilemma finden wir bei der Therapie eines Relapses nach cisplatinhältiger Chemotherapie, der in etwa in 20–30% auftritt.
Abb. 4: Personalisierte Chemotherapie basierend auf der Abnahme der Tumormarker bei Hodentumoren mit schlechter Prognose (GETUG 13). Randomisierte Phase-III-Multicenterstudie (nach Y Loriot et al.: Eur J Cancer 2017; 87: 140-6)
Risiko für Relaps
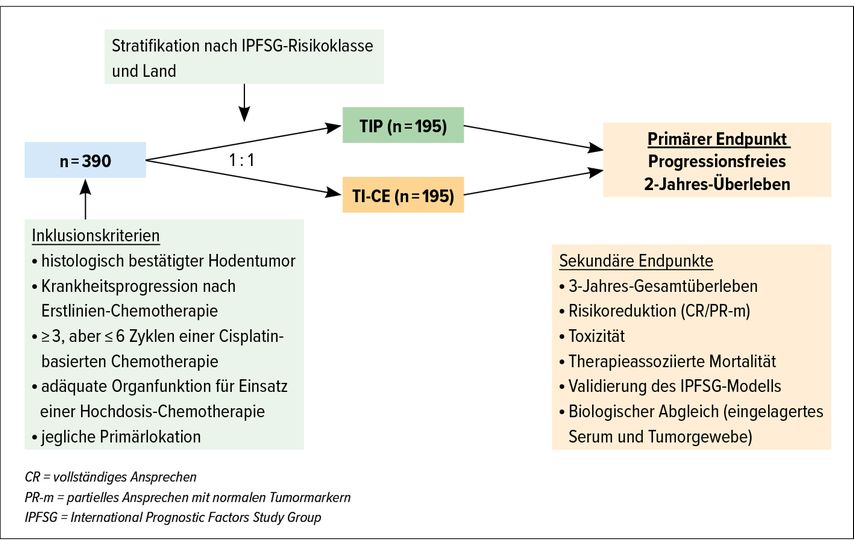
Mit den von A. Lorch und J. Beyer definierten Risikofaktoren (Histologie, Tumorlokalisation, Viszeralmetastasen, Therapieansprechen, progressionsfreies Intervall und Tumormarkerhöhe) konnten 5 Gruppen unterschiedlichsten Risikos bestimmt werden („very low“, „low“, „intermediate“, „high“ und „very high risk“), die sowohl mit einer sequenziellen HD-Chemotherapie, die weniger toxisch war als die Single-HD-Therapie, als auch mit einem konventionellen Salvage-TIP-Schema (Taxol, Ifosphamid, Platin) 60–70% Komplettremissionsraten und Überlebensraten nach 2 Jahren von ca. 60–80% aufwiesen (Abb.5). Seit 2018 läuft derzeit dazu die wohl wichtigste Hodentumorstudie, die TIGER-Studie, die TIP mit TICE, einem sequenziellen HD-Chemotherapieprotokoll, vergleicht (Abb. 6). Im 2. Relaps gilt die HD-Chemotherapie als Standard, sie hat ein Ansprechen von knapp 30–40% mit einem Langzeitüberleben von lediglich 15–25%. Der eventuelle Relaps ereignet sich sehr früh, sodass das Auftreten eines solchen nach mehr als 2 Jahren als „late relapse“ bezeichnet wird. Das mediane Intervall bis zum Spätrezidiv liegt bei 7–10 Jahren, es kommt lediglich in 2–4% vor. Es betrifft das Nichtseminom häufiger als das Seminom (1,4 vs. 3%).
Abb. 5: Klassifikation prognostischer Risikofaktoren bei metastasiertem Hodentumor und Versagen einer Cisplatin-basierten First-Line-Chemotherapie
Abb. 6: Design der TIGER-Studie im Jahr 2011: Therapie im 1. Rezidiv (nach Feldmann DR et al.: J Cancer 2011; 2: 374-7)
Symptomatisch werden die Patienten in bis zu 70% mit Rücken- oder Abdominalschmerzen. In 50% sind die Marker das erste Zeichen, wobei in mehr als der Hälfte der Fälle das AFP häufiger erhöht ist als das HCG. Histologisch imponiert das reife Teratom bei knapp zwei Dritteln, gefolgt von sarkomatoiden Transformationen und Adenokarzinomen. Die Prädilektionsstelle des „late relapse“ ist in mehr als 50% der Fälle das Retroperitoneum, gefolgt vom Mediastinum. Die Tumoren sind überwiegend chemoresistent und sollten primär komplett reseziert werden, um die generell schlechte Prognose zu verbessern. Auch die an die speziellen Histologien angepassten Chemoprotokolle zeigen nur selten einen Benefit.
Fazit
Die hervorragenden Heilungsraten der Patienten mit einem Keimzelltumor bringen erfreulicherweise sehr viele Langzeitüberlebende, die dann durch die Langzeittoxizitäten der angewandten Therapien, vorwiegend der Chemo-und Radiotherapie, zukünftig gefährdet sind. Das Krebsregister der Norweger, die gemeinsam mit den Niederländern die besten Daten hinsichtlich Spättoxizitäten liefern, stellt eine 23%ige Steigerung der sogenannten „non-testicular cancer mortality“ (non-TC) gegenüber der Gesamtbevölkerung fest. Von knapp 6000 Patienten sind zwischen 1980 und 2009 12% an „Non-TC“-Ursachen gestorben, in der Regel an sekundären, nicht Hodentumor-assoziierten Zweitmalignomen an Oropharynx, Leber, Pankreas, Blase, Ösophagus, Lunge sowie an Leukämien. Das signifikant erhöhte Risiko für diese Zweitmalignome steigt nach mehr als 4 erhaltenen Chemotherapiezyklen und nach mehr als 10 Jahren Follow-up. Die von den Niederländern in den 1990er-Jahren postulierte erhöhte kardiovaskuläre Mortalität konnte im norwegischen Krebsregister nicht bestätigt werden, wenngleich im ersten posttherapeutischen Jahr die kardiovaskuläre Morbidität erhöht und das 20-Jahre-Risiko bei knapp 20% liegt. Schwer erklärbar ist die erhöhte Suizidrate unter Langzeitüberlebenden nach Chemotherapie im norwegischen Register. In Anbetracht dessen sollte die Anwendung von Chemo- und Radiotherapie vermieden oder zumindest reduziert werden und der Observanz, wo immer möglich, der Vorzug gegeben werden. Unsere Patienten müssen besonders über diese Langzeitfolgen aufgeklärt und auf entsprechende Vorsorgeprogramme hingewiesen werden.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Historische Momente aus Wiener urologischen Abteilungen
Der 51. Österreichische Urologenkongress in der Messe Wien vom 22. bis 25.5.2025, veranstaltet zusammen mit der bayrischen Schwestergesellschaft, fokussierte nicht nur wichtige ...
Zytoreduktive Nephrektomie im Jahr 2025 – ein evidenzfreier Raum?
Die zytoreduktive Nephrektomie (CN) ist heutzutage weiterhin ein fester Bestandteil der Therapie des metastasierten Nierenzellkarzinoms (mRCC). Doch ob und wann ein Patient einer CN ...
Blasenerhalt trotz BCG-Versagen bei High-Risk-Tumoren: intravesikale Strategien heute und morgen
Standard bei BCG-Versagen beim nichtmuskelinvasiven Blasenkarzinom ist die radikale Zystektomie. Alternativen mit Gemcitabin oder Mitomycin sind onkologisch unterlegen. Neue Ansätze wie ...
%20und%20heute%20(2017).jpg)