Das urogenitale Mikrobiom
Autorin:
Ursula Lemberger, MSc. PhD
Abteilung für Urologie
Medizinische Universität Wien
Das lang anhaltende Dogma einer sterilen Blase konnte in den letzten Jahren durch die Weiterentwicklung von Sequenzierungstechniken, wie dem Next-Generation Sequencing (NGS), widerlegt werden. Diese Techniken erlauben eine umfassende Charakterisierung unseres urogenitalen Mikrobioms und liefern damit neue Erkenntnisse für die Grundlagenforschung, aber auch für klinische/therapeutische Applikationen, wie die gezieltere Anwendung von Antibiotika, die Resistenzenprävention und die Substitutionstherapie mit Kommensalen und Probiota.
Keypoints
-
Antibiotika verändern das intestinale und somit auch das urogenitale Mikrobiom.
-
Dysbiosen führen zu Harnwegsinfekten, Inkontinenz, neurogener Blasendysfunktion, interstitieller Zystitis, Prostatitis und Vaginosen.
-
Bakterien haben Einfluss auf das Ansprechen von Immuntherapie bei Krebspatienten.
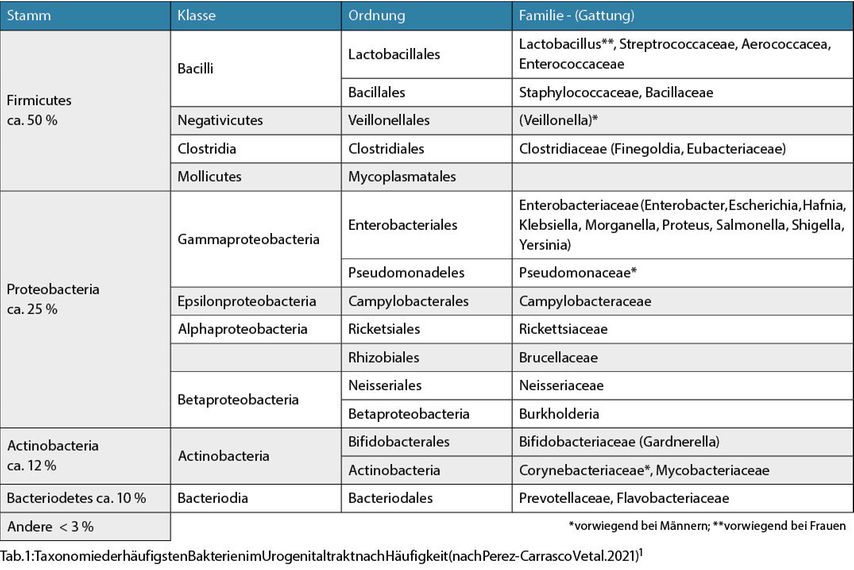
Die Sequenzierung der hypervariablen Genregionen (V1–V9) der bakteriellen 16S ribosomalen Untereinheit („16S rRNA Sequencing“) ermöglichen eine qualitative sowie quantitative Charakterisierung von Bakterien auf Gattungsebene. Durch die Erstellung riesiger Sequenzierdatenbanken und die Verifizierung der gefundenen Bakterien durch hochsensitive Kulturmethoden („enhanced quantitative urine culture“; EQUC) ist mittlerweile auch eine Identifizierung auf Speziesebene möglich. Heute weiß man, dass sowohl die Blase als auch der gesamte Urogenitaltrakt mit mehr oder weniger spezifischen Kommensalen besiedelt ist, die maßgeblich zur Homöostase der Organe beitragen. Im katheterisierten Harn von gesunden Erwachsenen findet man ca. 200 verschiedene Bakteriengattungen (Tab.1).1
Tab. 1: Taxonomie der häufigsten Bakterien im Urogenitaltrakt nach Häufigkeit (nach Perez-Carrasco V et al. 2021)1
Altersabhängige physiologische Besiedelung
Die physiologische Komposition der urogenitalen Kommensalen ist geschlechtsspezifisch und altersabhängig. Das Blasenmikrobiom von gesunden (kontinent, ohne „lower urinary tract symptoms“; LUTS) erwachsenen Frauen besteht vorwiegend aus Lactobacillus ssp., Gardnerella, Prevotella, Escherichia, Streptococcus, Atopobium, Actinomyces und Staphylococcus. Etwas seltener kommen Sneathia, Corynebacterium, Aerococcus und Bifidobacterium vor.2–7 Junge adipöse Frauen (Ø 36 Jahre, Ø BMI 33,4) sind stärker mit Gardnerella besiedelt, während im Harn von Frauen über 60 Jahre vermehrt Escherichia vorkommt, ohne dass diese trotz der Pathogene die klassischen Beschwerden von Harnwegsinfekten oder Vaginosen aufweisen.8,9 Auch vaginal dominieren diverse Lactobazillusarten, vor allem L. crispartus, L. ineres, L. gasseri, und L. jensenii, wobei bei postmenopausalen Frauen die Anzahl wie auch die Diversität der Bakterien abnehmen.10 So findet man Jonquetella, Parvimonas, Proteiniphilum und Saccharofermentans ausschließlich bei gesunden Probanden über 70 Jahre.11
Bakterielle Diversität und Abundanz sind bei Männern etwas geringer als bei Frauen. Im Urin von gesunden Männern prädominieren Pseudomonas, Corynebacterium, Streptococcus, Veillonella, Prevotella, Staphylococcus und Finegoldia. Lactobacillus spp. sind meist seltener als bei Frauen.1,8,12,13
Die Zusammensetzung des urogenitalen Mikrobioms bei Erwachsenen ist zwar ähnlich, allerdings gibt es starke individuelle Unterschiede. Die bakterielle Diversität ist stark abhängig von der individuellen Lebensweise (Ernährung) und somit vom pH-Wert des Urins sowie vom Miktionsverhalten (Häufigkeit, Toilettenpapier- oder Wasserreinigung), aber auch von anderen kulturellen und sozioökonomischen Bedingungen – bei Männern auch abhängig von der Beschneidung. So entstehen demografische bzw. ethnische Unterschiede in der mikrobiellen Komposition.1
Funktionalität des urogenitalen Mikrobioms
Obwohl das Mikrobiom charakteristisch unterschiedlich ausgeprägt ist, besteht ein systemischer Zusammenhang für den Körper. Das menschliche Mikrobiom stellt eine protektive biophysikalische Barriere dar, baut Umweltgifte und Stoffwechselmetaboliten ab, verhindert die Ansiedelung von Pathogenen und trägt maßgeblich zur Ausbildung unseres Immunsystems bei.
Das urogenitale Mikrobiom unterliegt einer gewissen Plastizität und ist in der Lage, pathogene Bakterien zu kompensieren bzw. unschädlich zu machen. So können Personen, die mit bekannten Pathogenen besiedelt sind, völlig beschwerde- und symptomfrei sein. Allerdings kann eine Veränderung der bakteriellen Komposition bzw. eine Fehlbesiedelung zu Harnwegsinfekten und deren Chronifizierung, aber auch zu Inkontinenz, neurogener Blasendysfunktion, interstitieller Zystitis, Prostatitis und zu Vaginosen führen. Wie in allen Organen begünstigen chronische Entzündungen auch im Urogenitaltrakt die Tumorentstehung und somit können Bakterien auch zur Entstehung von Neoplasien beitragen.
Dysbiose
Die Veränderung der physiologischen bakteriellen Zusammensetzung bzw. die Verringerung der bakteriellen Diversität nennt man Dysbiose. Die größte Gefahr für die bakterielle Homöostase des Urogenitaltrakts sind Langzeittherapien mit Antibiotika und Manipulationen mit Fremdkörpern wie z.B. Kathetern. Rezente Studien haben gezeigt, dass unser Lebensstil, geprägt von einseitiger, übermäßiger und faserarmer Kost und reduzierter Bewegung, zum Verlust der intestinalen mikrobiellen Diversität führen. Der verringerte Konkurrenzdruck unter den Kommensalen, ein veränderter pH-Wert, Sauerstoffspannung und die Verfügbarkeit von Nährstoffen begünstigen wiederum das Ansiedeln von Pathogenen auch im Urogenitaltrakt.1 Die häufigsten Konsequenzen von Dysbiosen mit den schwersten Folgen für den Urogenitaltrakt sind:
Harnwegsinfekte
Harnwegsinfekte (HWI) sind die am häufigsten erworbenen bakteriellen Infektionen und generell durch eine Dysbiose charakterisiert. Die häufigsten Pathogene im HWI sind E. coli und Enterococcus, wobei besonders Koinfektionen zu Komplikationen wie Zystitis, Pyelonephritis und Urosepsis führen können.14,15 So fördert Enterococcus faecalis durch die Sekretion von L-Ornithin die Produktion von Siderophor in E. coli, wodurch diese auch in einer eisenreduzierten Umgebung wachsen können – eine polymikrobielle Infektion entsteht.16 Weiters wurden Corynebacterium glucuronolyticum,Streptococcus gallolyticus und Aerococcus sanguinicola als opportunistische Uropathogene beschrieben.1 Frauen mit rezidivierenden Vaginosen weisen oft eine Verschiebung des Mikrobioms Richtung Anaerobier auf, darunter z.B. Gardnerella vaginalis, die wiederum das Wachstum von E.coli triggern. Gleichzeitig leiden diese Frauen auch häufiger an HWI als Frauen mit Lactobacillus-lastigem Vaginalmikrobiom.17 Ein weiterer Effekt einer E.coli/ G.vaginalis-Superinfektion ist der ATP- und Ca2+-Influx in das Uroepithel, was zur dauerhaften Kontraktion der Blase und somit zur Symptomatik einer Dranginkontinenz (UUI) führt.18 Hier hat sich gezeigt, dass die vaginale Behandlung mit L. crispatus und probiotischen Stämmen wie L. rhamnosusGR1, L. fermentum RC-14 und L. reuteri B-54 nachweislich die Anfälligkeit für diese Erkrankungen verringert. Lactobazillen verstoffwechseln Kohlenhydrate aus der Schleimhaut zu Milchsäure. Die damit verbundene Absenkung des pH-Wertes vermindert das Ansiedeln von Pathogenen. Außerdem verhindern sie den ATP- und Ca2+-Influx, was zu einer Entspannung der Blasenmuskulatur führt.18 Die Substitution mit Lactobazillen kann so auch die Häufigkeit von Harnwegsinfekten und UUI bei katheterisierten Personen bzw. bei Frauen nach Operationen verringern.19 Die Behandlung mit Probiotika direkt in der Blase hat sich als effizienter als vaginale oder orale Applikationen erwiesen und kann vor allem beim HWI zu einer schnellen und andauernden Veränderung Richtung physiologischem Mikrobiom führen.20
Für Antibiotikatherapien bei HWI gilt natürlich: Je genauer das Pathogen bestimmt werden kann, desto effizienter kann die Therapie gestaltet werden. Eine durch Aerococcus urinae verursachte Zystitis kann effizient mit Nitrofuantoin behandelt werden, während bei einer Pleonephritis derselbe Erreger am besten mit Ciprofloxacin bekämpft wird. Ciprofloxacin ist wiederum wirkungslos, wenn die Infektion durch Aerococcus sanguinicola ausgelöst wird.21 Auch bei einem E.coli-bedingten HWI ist die Gabe von Ciprofloxacin kontraindiziert, da es die Freisetzung von ATP in intrazellulär persistierende E. coli fördert, was wiederum zu vermehrtem Ca2+-Influx und einer UUI-Symptomatik führt.18Enterococcus faecium ist resistent gegen die häufigsten Betalaktame, deren Gabe allerdings zu einer Verstärkung der Dysbiose durch das Vernichten von Kommensalen führt.22
Wenn der Harnwegsinfekt nicht von einem Bakterium verursacht wird, sondern von methanogenen Archaeen, einer einzelligen, bakterienartigen Urform, sind Fosfomycin, Cotrimoxazol (Sulfomethoxazol and Trimethoprim), Amoxicillin-Clavulan-Säure und Ofloxacin wirkungslos.23
In unzähligen Studien wurde gezeigt, dass die dauerhafte und falsche Antibiotikatherapie nicht nur Resistenzen fördert, sondern auch das intestinale Mikrobiom nachhaltig verändert, da es, wie wir wissen, einen enormen Einfluss auf das urogenitale Mikrobiom hat.24 Der Teufelskreis der systemischen Dysbiose schließt sich damit.
Blasentumoren
Auch Patienten mit Urothelkarzinom weisen schwere Dysbiosen auf. Vor allem bei progredienten und rezidivierenden Blasentumoren besteht ein Zusammenhang mit einer hohen Abundanz von proinflammatorischen und pathogenen Bakterien, wie Acinetobacter, Anaerococcus, Sphingobacteriaceae, Herbaspirillum, Porphyrobacter, Bacteroides und Actinomyces europeaus.12,25,26 Allerdings ist die Blasenschleimhaut bei Tumorpatienten anders besiedelt als der Harn, was eine Identifizierung von Pathogenen über die Harnkultur unmöglich macht. So sind Akkermansia, Bacteroides, Clostridium sensu stricto, Enterobacter and Klebsiella im Gewebe überrepräsentiert, während man sie im Harn seltener findet. Dieser ist vorwiegend mit Lactobacillus, Corynebacterium, Streptococcus und Staphylococcus besiedelt.27
Bisher konnte nur ein Bakterium als eindeutig kanzerogen identifiziert werden: Fusobacterium nucleatum, das auch mit kolorektalen Tumoren assoziiert ist, bindet über das Adhesin FadA an die Wirtszellen und führt dort zu einer Deregulation des Wnt-Signalwegs, eines wichtigen Zellproliferationssignalwegs.28 In einer männlichen Kohorte konnte gezeigt werden, dass F.nucleatum ausschließlich bei Blasenkrebspatienten, nicht aber bei den gesunden Kontrollen vorkommt.12 Das intestinale Mikrobiom hat einen immensen systemischen Einfluss auf das Immunsystem und zeigt auch Therapieerfolge bei Immuntherapie.29
Bei Patienten mit Nieren- oder Lungenkarzinomen konnte gezeigt werden, dass der Therapieerfolg von PD-1-/PD-L1-Inhibitoren maßgeblich von einer Antibiotika-assoziierten intestinalen Dysbiose abhängig ist.30,31 Die Daten wurden bei Melanompatienten bestätigt, wobei sich Non-responder hauptsächlich durch verminderte Abundanz von Akkermansia muciniphila und Bifidobacterium ssp. auszeichneten. Eine orale Substitution mit diesen Bakterien konnte das Therapieansprechen signifikant verbessern.32 Im Tierexperiment wurde bewiesen, dass die dauerhafte Gabe von Antibiotika den Therapieerfolg von Immuntherapien bei Mäusen drastisch verschlechtert.31
Es ist denkbar, dass eine intestinale bzw. urologische Dysbiose auch der Grund für das schlechte Ansprechen von Immuntherapien bei Patienten mit muskelinvasiven Blasentumoren ist. Ob die Zusammensetzung des Blasenmikrobioms auch Auswirkungen auf den Erfolg von Bacillus Calmette–Guérin basierter Therapie hat, ist Gegenstand meiner aktuellen Forschungsarbeit.
Nierenerkrankungen
Auch für den Erfolg einer Nierentransplantation dürften Bakterien eine tragende Rolle spielen. Interstitielle Fibrose und tubuläre Atrophien (IFTA) sind Konsequenzen von inflammatorischen Zytokinen und deren exzessiver Ablagerung in extrazellulärer Matrix. Studien haben gezeigt, dass auch bei IFTA eine Dysbiose vorliegt: Frauen weisen weniger Laktobazillen im Harn auf, während Männer mit Abstoßungsreaktionen weniger stark mit Streptococcus besiedelt sind. Bei beiden Geschlechtern war die Abundanz von pathogenen Bakterien, wie Propionibacterium acne, Prevotella disiens, G.vaginalis, Finegoldia magna, Corynebacterium, Rhodococcus und Fusobacterium, erhöht.33,34 Es ist denkbar, dass das veränderte Mikrobiom eine überschießende Immunreaktion weiter fördert. Ob die Dysbiose Konsequenz oder Ursache der IFTA ist, muss weiter erforscht werden, damit Abstoßungsreaktionen reduziert werden können.
Mehrere Studien haben gezeigt, dass Patienten mit Nierensteinen ebenfalls eine Reduktion der mikrobiellen Diversität und eine vermehrte Besiedelung mit pathogenen Bakterien im katheterisierten Harn aufweisen. Vor allem bei männlichen Patienten war die Abundanz von Prevotella, das durch Exkretion von kurzkettigen Fettsäuren eine antiinflammatorische Wirkung hat, stark reduziert.35 Auch hier wurde gezeigt, dass die frühkindliche und dauerhafte orale Gabe von Antibiotika (Fluorochinolon, Chephalosporin, Nitrofurantoin/Methenamin, Solfonamid und Breitspektrum-Penicillin) maßgeblich zur Bildung von Nierensteinen bei trägt.36
In einer unserer rezenten Studien wurde das Mikrobiom von Nierensteinen und katheterisierten Urin von 100 Patienten mit Nepholithiasis untersucht. Im Vergleich zu einer altersangepassten Kontrollgruppe ohne Steinerkrankungen war das Mikrobiom der Steinpatienten weniger divers, außerdem wiesen diese Patienten eine Dysbiose auf. Die Steine von Patienten mit metabolischem Syndrom waren vor allem mit klassischen Fäkalkeimen besiedelt. Die Anhäufung dieser Keime, wie Escherichia Shigella,Klebsiella, Enterococcus und Aerococcuswurde bereits im Urin von Patienten mit Typ-2-Diabetes und LUTS beschrieben.37 Weiters konnten wir in allen Steintypen Bakterien nachweisen, was die Theorie, dass nur Struvitsteine besiedelt sind bzw. dass es einen Zusammenhang zwischen Bakterien und der Bildung von Struvitsteinen gibt, widerlegt.
Zusammenfassung
Trotz der intensiven Beforschung des Mikrobioms in den letzten Jahren sind noch viele Fragen offen. Vor allem die Hoffnung auf Identifizierung von eindeutig pathogenen Mikroorganismen konnte bis dato nicht erfüllt werden – mit Ausnahme von Fusobacterium nucleatum bei Blasenkrebs. Vielmehr scheint es, als unterliege das urogenitale Mikrobiom einem sensiblen Gleichgewicht, in dem sich Veränderungen der Komposition nachhaltig nachteiliger auswirken als die Infektion mit einem einzelnen Pathogen. Da die Rolle bzw. die Existenz des urogenitalen Mikrobioms auch in Fachkreisen immer noch angezweifelt wird, ist es essenziell, dass zukünftige Forschung die Techniken zur Identifikation von Bakterien, vor allem bei gesunden Individuen, verbessert, das komplexe Zusammenspiel von intestinalem und urogenitalem Mikrobiom weiter aufklärt und die Wirkungmechanismen von Uropathogenen, aber auch von Probiotika besser verständlich macht, um eine valide Grundlage für die Bereitstellung einer gezielten und effizienten Therapie von urogenitalen Erkrankungen möglich zu machen.
Literatur:
1 Perez-Carrasco V et al.: Urinary microbiome: yin and yang of the urinary tract. Front Cell Infect Microbiol 2021; 11: 617002 2 Price TK et al.: The urobiome of continent adult women: a cross-sectional study. BJOG 2020; 127(2): 193-201 3 Siddiqui H et al.: Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons. BMC Microbiol 2021; 11: 244 4 Thomas-White K et al.: The bladder is not sterile: history and current discoveries on the urinary microbiome. Curr Bladder Dysfunct Rep 2016; 11(1): 18-24 5 Thomas-White K et al.: Culturing of female bladder bacteria reveals an interconnected urogenital microbiota. Nat Commun 2018; 9(1): 1557 6 Whiteside SA et al.: The microbiome of the urinary tract--a role beyond infection. Nat Rev Urol 2015; 12(2): 81-90 7 Wolfe AJ et al.: Evidence of uncultivated bacteria in the adult female bladder. J Clin Microbiol 2012; 50(4): 1376-83 8 Gottschick C et al.: The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome 2017; 5(1): 99 9 Shirtliff ME et al.: Cross-kingdom interactions: Candida albicans and bacteria. FEMS Microbiol Lett 2009; 299(1): 1-8 10 Smith SB, Ravel J: The vaginal microbiota, host defence and reproductive physiology. J Physiol 2017; 595(2): 451-463 11 Curtiss N et al.: Age, menopausal status and the bladder microbiome. Eur J Obstet Gynecol Reprod Biol 2018; 228: 126-9 12 Bucevic Popovic V et al.: The urinary microbiome associated with bladder cancer. Sci Rep 2018; 8(1): 12157 13 Fouts DE et al.: Integrated next-generation sequencing of 16S rDNA and metaproteomics differentiate the healthy urine microbiome from asymptomatic bacteriuria in neuropathic bladder associated with spinal cord injury. J Transl Med 2012; 10: 174 14 Kline KA, Lewis AL: Gram-positive uropathogens, polymicrobial urinary tract infection, and the emerging microbiota of the urinary tract. Microbiol Spectr 2016; 4(2): 10.1128 15 Neugent ML et al.: Advances in understanding the human urinary microbiome and its potential role in urinary tract infection. mBio 2020; 11(2): e00218-20 16 Keogh D et al.: Enterococcal metabolite cues facilitate interspecies niche modulation and polymicrobial infection. Cell Host Microbe 2016; 20(4): 493-503 17 Sumati AH, Saritha NK: Association of urinary tract infection in women with bacterial vaginosis. J Glob Infect Dis 2009; 1(2): 151-2 18 Abbasiann B et al.: Potential role of extracellular ATP released by bacteria in bladder infection and contractility. mSphere 2019; 4(5): e00439-19 19 Ghartey JP et al.: Lactobacillus crispatus dominant vaginal microbiome is associated with inhibitory activity of female genital tract secretions against Escherichia coli. PLoS One 2014; 9(5): e96659 20 Forster CS et al.: A single intravesical instillation of Lactobacillus rhamnosus GG is safe in children and adults with neuropathic bladder: A phase Ia clinical trial. JSpinal Cord Med 2021; 44(1): 62-9 21 Oskooi M et al.: Aprospective observational treatment study of aerococcal urinary tract infection. J Infect 2018; 76(4): 354-60 22 Magruder M et al.: Gut uropathogen abundance is a risk factor for development of bacteriuria and urinary tract infection. Nat Commun 2019; 10(1): 5521 23 Grine G et al.: Co-culture of methanobrevibacter smithii with enterobacteria during urinary infection. EBioMedicine 2019; 43: 333-7 24 Elvers KT et al.: Antibiotic-induced changes in the human gut microbiota for the most commonly prescribed antibiotics in primary care in the UK: a systematic review. BMJ Open 2020; 10(9): e035677 25 Bi H et al.: Urinary microbiota - a potential biomarker and therapeutic target for bladder cancer. J Med Microbiol 2019; 68(10): 1471-8 26 Wu P et al.: Profiling the urinary microbiota in male patients with bladder cancer in China. Front Cell Infect Microbiol 2018; 8: 167 27 Mansour B et al.: Bladder cancer-related microbiota: examining differences in urine and tissue samples. Sci Rep 2020; 10(1): 11042 28 Wang S et al.: Fusobacterium nucleatum acts as a pro-carcinogenic bacterium in colorectal cancer: from association to causality. Front Cell Dev Biol 2021; 9: 710165 29 Iida N et al.: Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment. Science 2013; 342(6161): 967-70 30 Gopalakrishnan V et al.: Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2018; 359(6371): 97-103 31 Routy B et al.: Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science 2018; 359(6371): 91-7 32 Matson V et al.: The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients. Science 2018; 359 (6371): 104-8 33 Modena BD et al.: Changes in urinary microbiome populations correlate in kidney transplants with interstitial fibrosis and tubular atrophy documented in early surveillance biopsies. Am J Transplant 2017; 17(3): 712-23 34 Wu JF et al.: Urinary microbiome associated with chronic allograft dysfunction in kidney transplant recipients. Clin Transplant 2018; 32(12): e13436 35 Xie J et al.: Profiling the urinary microbiome in men with calcium-based kidney stones. BMC Microbiol 2020; 20: 41 36 Tasian GE et al.: Oral antibiotic exposure and kidney stone disease. J Am Soc Nephrol 2018; 29(6): 1731-40 37 Chen J et al.: Relationship between alterations of urinary microbiota and cultured negative lower urinary tract symptoms in female type 2 diabetes patients. BMC Urol 2019; 19(1): 78
Das könnte Sie auch interessieren:
ESMO 2025: neue Therapiekonzepte beim Urothelkarzinom
Der diesjährige ESMO stand ganz im Zeichen des Urothelkarzinoms. Neue Studiendaten beim nichtmuskelinvasiven, muskelinvasiven und metastasierten Urothelkarzinom eröffnen Perspektiven für ...
Mikroplastik und Gesundheit – was Ärztinnen und Ärzte wissen sollten
Kunststoffe sind aus unserem Alltag nicht wegzudenken – ihre kleinsten Fragmente, Mikro- und Nanoplastik, sind längst überall: in der Luft, im Wasser, in Lebensmitteln und sogar im ...
Journal Club
Der aktuelle Journal Club wurde für Sie von der Abteilung für Urologie und Andrologie, Universitätsklinikum St. Pölten, gestaltet. Im Journal Club werden neu publizierte Studien ...