Aktuelle diagnostische und therapeutische Herausforderungen
Autoren:
Mag. Dr. Melanie R. Hassler-Di Fratta
Dr. Hadi Mostafaei
Dr. Johanna Krauter
Universitätsklinik für Urologie
Medizinische Universität Wien
Die Etablierung von Biomarkern in der Diagnostik und Therapie des Hodenkarzinoms könnte zukünftig eine Hilfestellung bei Diagnosestellung und zusätzlich vielversprechend vor adjuvanter Therapie im Stadium I als auch bei Residualtumor nach Chemotherapie sein. Zusätzlich stellt sich die Frage nach der optimalen Therapie bei Rezidiven und therapierefraktären Tumoren.
Keypoints
-
Neue Biomarker wie z.B. miR-371a-3p zeigen eine signifikant bessere Sensitivität und Spezifität für alle Stadium-I-Keimzelltumoren des Hodens außer Teratomen.
-
Operationen im Retroperitoneum bei Residualtumoren nach Chemotherapie sollten multidisziplinär an Zentren durchgeführt werden.
-
Die Techniken zur unilateralen „template surgery“ und Funktionserhaltung haben sich in den letzten Jahren sukzessive weiterentwickelt.
-
Im Rezidivsetting nach Chemotherapie kommen sowohl konventionelle wie auch Hochdosischemotherapie zur Anwendung.
-
Die optionale Salvagechemotherapie für Rezidive wird derzeit im Rahmen einer Phase-III-Studie evaluiert.
-
Cisplatin-refraktäre Hodentumoren stellen die größte klinische Herausforderung dar.
-
Daten aus der molekularen Präzisionsmedizin könnten bei manchen dieser Tumoren zu neuen Behandlungsansätzen führen.
Hodenkrebs ist der häufigste bösartige Tumor bei jungen Männern mit Heilungsraten über 95% aller und über 90% der Patienten mit einem metastasierten Tumor. Durch die Implementierung Cisplatin-basierter Chemotherapie und optimierter chirurgischer Techniken versterben nicht mehr als 5% der Patienten im metastasierten Stadium. Eine aktuelle Herausforderung in der Diagnostik und Therapie des Hodenkarzinoms stellt u.a. die Etablierung von Biomarkern zur Hilfestellung bei Diagnose und vor adjuvanter Therapie im Stadium I wie auch bei Residualtumor nach Chemotherapie dar. Ebenso werden derzeit die optimale Therapieauswahl bei Rezidiven nach Chemotherapie und neue Behandlungsansätze bei therapierefraktären Tumoren untersucht.
Neue Biomarker
miR-371a-3p
Bei klinischem Verdacht auf einen Hodentumor werden routinemäßig die Serumtumormarker α-Fetoprotein (AFP) und β-Choriogonadotropin (β-HCG) bestimmt, welche mit dem Vorhandensein gewisser histologischer Subtypen der Keimzelltumoren korrelieren. AFP ist in 40–60% der Patienten mit einem Embryonalzellkarzinom und 100% der Patienten mit einem Dottersacktumor erhöht. β-HCG ist bei Patienten mit einem Chorionkarzinom, bei 40–60% der Patienten mit einem Embryonalzellkarzinom sowie bei 20% der Patienten mit einem Seminom positiv. Teratome weisen in der Regel weder AFP noch β-HCG-Elevation auf.1 Ein sensitiverer Marker für Keimzelltumoren ist microRNA (miRNA) miR-371a-3p, welcher bei allen Subtypen außer bei Teratomen erhöht ist. Aufgrund der geringeren Halbwertszeit der miRNA (3,7–7 Stunden) kommt es auch nach Orchiektomie zu einem schnelleren Abfall als bei konventionellen Markern, und miR-371a-3p-Levels könnten zur Unterscheidung zwischen Stadium-I- und Stadium-II-Tumoren bzw. zur Detektion von Mikrometastasen verwendet werden.2 Bezüglich der Prognose von Rezidiven im Stadium I, welche besonders für Patienten mit Risikofaktoren wie Tumorgröße und Rete-testis-Infiltration bei Seminomen und lymphovaskulärer Invasion bei Nicht-Seminomen für die Auswahl einer adjuvanten Chemotherapie relevant sind, könnte die Geschwindigkeit des Abfalls an miR-371a-3p mit dem Auftreten von Rezidiven korreliert sein. Die Daten dazu sind jedoch noch präliminär.3 Allerdings ist die Sensitivität der miR-371a-3p für die Detektion eines Rezidivs sehr hoch (94,1%), und ein Anstieg der miRNA kann bereits vor einem radiografisch detektierbaren Rezidiv beobachtet werden.4 Derzeit wird die miRNA jedoch noch nicht routinemäßig als Tumormarker bestimmt, dies liegt u.a. an bisher uneinheitlichen Messprotokollen und Probevorbereitungsmethoden sowie am Fehlen eines validierten „Cut-off“-Wertes zur Detektion der miRNA-371a-3p. Ein weiterer Nachteil ist, dass sie von Teratomen kaum exprimiert wird.5
cfDNA
Zellfreie DNA (cfDNA), ein weiterer neuer Biomarker in der Diagnose und Prognose von Keimzelltumoren, weist diesen Nachteil nicht auf. Zellfreie DNA umfasst die gesamte zirkulierende DNA im Plasma und nicht nur die zirkulierende Tumor-DNA (ctDNA), allerdings kann der Anteil an ctDNA >10% der cfDNA betragen. cfDNA kann Gesunde von Patienten mit Keimzelltumor unterscheiden und hat eine hohe Sensitivität und Spezifität als diagnostischer Marker. cfDNA-Levels korrelieren auch mit dem Tumorstadium und könnten daher als diagnostischer Marker für okkulte Metastasen nach Orchiektomie herangezogen werden, entsprechende Studien diesbezüglich fehlen jedoch noch.6 Ein weiterer diagnostischer epigenetischer Biomarker ist der Methylierungsstatus des RASSF1A-Promoters, welcher in Hodentumorgewebe generell hypermethyliert ist. Der Methylierungsstatus kann durch Isolation von cfDNA gemessen werden, und die Detektion einer Hypermethylierung von RASSF1A hat Keimzelltumoren einschließlich Teratomen und GCNIS („testicular germ cell neoplasia in situ“) erfolgreich nachgewiesen.7 Eine Kombination von miR-371a-3p mit z.B. Hypermethylierung von RASSF1A in cfDNA könnte in Zukunft in der Diagnose und frühen Rezidivdiagnostik von Keimzelltumoren Anwendung finden.
Residualtumor nach Chemotherapie
Im metastasierten Stadium ist die Chemotherapie mit Cisplatin, Etoposid und Bleomycin (PEB) oder Cisplatin mit Etoposid (EP) obligat und führt zur Schrumpfung und Nekrose der Tumormasse. Sollte nach abgeschlossener Chemotherapie noch Restgewebe vorhanden sein, ist eine chirurgische Resektion des Residualtumors indiziert. Die häufigste Lokalisation von Residualtumorgewebe ist das Retroperitoneum. Eine retroperitoneale Lymphadenektomie nach Chemotherapie ist bei Nicht-Seminomen mit Lymphknoten (LK) >1cm und bei Seminomen >3cm ohne erhöhte Serumtumormarker indiziert.8 Bei Nicht-Seminomen mit LK <1cm beträgt die Rezidivrate ohne Operation 3% und 97% zeigen eine Gesamtüberlebensrate von 15 Jahren und mehr. Bei LK >1cm finden sich Teratome in 30–80% und aktiver Tumor in 10–15%. Bei Seminomen findet sich bei LK <3cm so gut wie nie aktives Tumorgewebe, bei LK>3cm, welche negativ im FDG-PET-CT sind, findet sich in 95% kein aktiver Tumor.9 Klinisch herausfordernd sind Residualmassen bei Seminomen mit >3cm Größe, da eine Operation aufgrund der desmoplastischen Reaktion mit Narbenbildung schwierig durchzuführen ist und das Morbiditätsrisiko vor Operationsplanung abgeschätzt werden sollte. Abhängig von der Lokalisation der zu resezierenden Tumormassen (Retroperitoneum, Lunge, Mediastinum, zervikale LK, Leber etc.) und zusätzlich nötigen Eingriffen (Nephrektomie, Resektionen an großen Gefäßen und vaskuläre Rekonstruktionen) ist in der Regel eine multidisziplinäre Betreuung des Patienten nötig, welche an großen Zentren durchgeführt werden sollte.
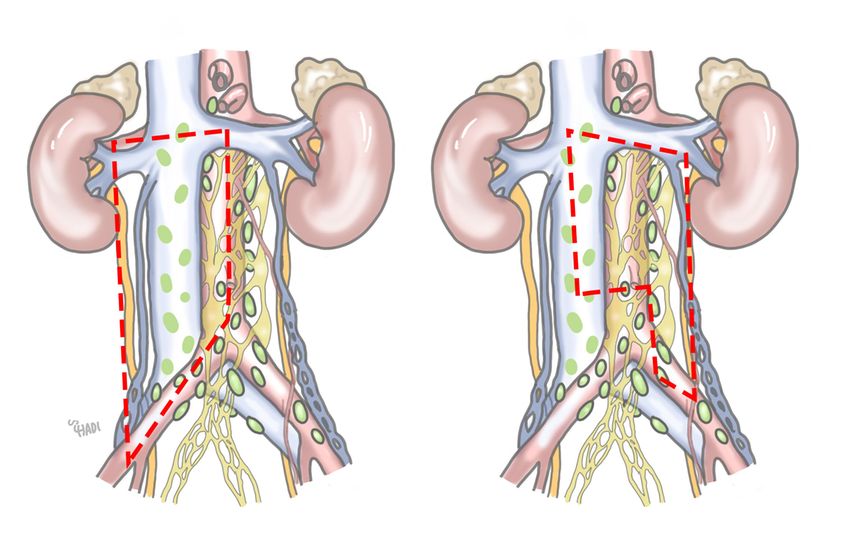
Die Technik der retroperitonealen Lymphadenektomie hat sich seit den 1960er-Jahren kontinuierlich verbessert. Unilaterale Templateoperationen sind möglich, wenn die Größe der LK nach Chemotherapie 5cm nicht übersteigt. Dieser Zugang erhält die Ejakulationsfähigkeit in 87% der Patienten im Vergleich zu 44% bei bilateraler Resektion.10 Eine bilaterale Resektion muss bei Tumormassen >5cm sowie bei bilateralen Residuen durchgeführt werden. Eine Übersicht über die Templates ist in Abbildung 1 dargestellt. Bei 32% aller Patienten werden außerdem vergrößerte LK außerhalb des Templates gefunden, auch diese müssen komplett reseziert werden.11 Für die Technik der Operation ist es entscheidend, dass alle Lymphkanäle identifiziert und geclippt werden, um Lymphozelenbildung zu vermeiden. Das sogenannte „Splitandrole“-Manöver hilft dabei, das Lymphgewebe um große Gefäße und postganglionäre Nervenfasern für den Erhalt der antegraden Ejakulation zu identifizieren.12 Dabei wird perivaskuläres Gewebe über der Vena cava und der Aorta auf Höhe der Vena renalis abpräpariert und dann sorgfältig nach lateral und medial vom Gefäß abgetrennt. Die Präparation kann nach kaudal über die Gefäße der Arteria und Vena iliaca communis weitergeführt werden, um das gesamte lymphatische Gewebe im Bereich des Templates zu entfernen. Der Erhalt der sympathischen Nervenfasern paravertebral lateral der Aorta auf der linken sowie posterior der Vena cava auf der rechten Seite sowie des Plexus hypogastricus im Bereich der Arteria mesenterica inferior ist essenziell zum Erhalt der Ejakulationsfunktion.
Abb. 1: Templates für rechts- und linksseitige modifizierte retroperitoneale Lymphadenektomie: Die rechte Seite beinhaltet präcavale, cavale, paracavale, retrocavale und interaortocavale LK sowie die Region lateral der Arteria und Vena iliaca communis. Resektionsgrenze sind der Ureter kaudal und lateral und die Vena renalis kranial. Links werden LK präaortal, retroaortal und paraaortal sowie interaortocaval bis zur A. mesenterica inferior reseziert. Kranial begrenzt die linke A. renalis, lateral und kaudal der Ureter das Resektionsfeld
Rezidive und therapierefraktäre Tumoren
Ungefähr 20–30% aller Patienten nach Chemotherapie in der Erstlinie erleiden ein Rezidiv.13 Das Risiko eines Rezidivs kann nach den Kriterien der International Germ Cell Cancer Collaborative Group (IGCCCG) abgeschätzt werden, welche Patienten abhängig von Ausbreitungsstadium und Höhe der Tumormarker in „Good“-, „Intermediate“- und „Poor Risk“-Gruppen einteilt. Zwischen 20 und 60% aller Rezidive nach Chemotherapie können mit Salvagechemotherapie geheilt werden.14 Im Salvagesetting werden sowohl konventionelle Dosierungen wie VeIP (Vinblastin, Ifosfamid, Cisplatin) oder TIP (Paclitaxel, Ifosfamid, Cisplatin) als auch Hochdosistherapien (HDCT) wie CE (Carboplatin, Etoposid) und TICE (Paclitaxel, Ifosfamid, Carboplatin, Etoposid) eingesetzt.15 HDCT sollte aufgrund der Komplexität und der hohen Rate an möglichen Komplikationen nur an spezialisierten Zentren durchgeführt werden. Die Heilungsraten nach Hochdosischemotherapie mit Blutstammzelltransplantation scheinen in Phase-I- und -II-Studien sowie retrospektiven Analysen höher zu sein, es können laut aktuellen Leitlinien aber beide Regimen eingesetzt werden.15 Eine aktuelle Phase-III-Studie, welche die konventionelle Gabe von 4 Zyklen TIP mit dem TICE-Regimen vergleicht (TIGER-Studie), wird derzeit gerade durchgeführt und wird möglicherweise die Frage, welcher Therapie der Vorzug im Salvagesetting gegeben werden sollte, beantworten.16
Cisplatin-resistente Tumoren sind selten, stellen aber eine große klinische Herausforderung dar. Verschiedene Mechanismen, wie z.B. verringerte Aufnahme von Cisplatin in die Zelle, erhöhter Abbau oder aktivierte DNA-Reparaturmechanismen, tragen zur Resistenz bei. Hohe PARP-Expression, Mikrosatelliteninstabilität, verringerte Expression von p53 und Fehlregulation des WNT/β-Catenin-Signalweges wurden ebenso bei Cisplatin-Resistenz beschrieben.8 Generell kommen nach Versagen von Cisplatin-basierten Therapien verschiedene Zytostatika wie z.B. Gemcitabin, Paclitaxel und Oxaliplatin zum Einsatz und bei Ansprechen ist eine Resektion der Residualtumoren empfohlen.17 Zielgerichtete Therapien oder Immuntherapien mit Checkpoint-Inhibitoren wurden in dieser Patientengruppe ebenfalls untersucht, zeigten aber nur in einem Bruchteil der Patienten zufriedenstellende Ansprechraten.18 Auch diese Patientengruppe sollte in einem spezialisierten Zentrum behandelt und nach Möglichkeit in klinische Studien eingeschlossen werden.
Literatur:
1 Lesko P et al.: Biomarkers of disease recurrence in stage I testicular germ cell tumours. Nat Rev Urol 2022; 19(11):637-58 2 Dieckmann KP et al.: MicroRNAs miR-371-3 in serum as diagnostic tools in the management of testicular germ cell tumours. Br J Cancer 2012; 107(10): 1754-60 3 van Agthoven T et al.: microRNA-371a-3p as informative biomarker for the follow-up of testicular germ cell cancer patients. Cell Oncol (Dordr) 2017; 40(4): 379-88 4 Fankhauser CD et al.: Detection of recurrences using serum miR-371a-3p during active surveillance in men with stage I testicular germ cell tumours. Br J Cancer 2022; 126(8):1140-4 5 Dieckmann KP et al.: Serum levels of microRNA-371a-3p (M371 Test) as a new biomarker of testicular germ cell tumors: results of a prospective multicentric study. J Clin Oncol 2019; 37(16): 1412-23 6 Ellinger J et al.: Cell-free circulating DNA: diagnostic value in patients with testicular germ cell cancer. J Urol 2009; 181(1): 363-71 7 Lobo J et al.: Liquid biopsies in the clinical management of germ cell tumor patients: state-of-the-art and future directions. Int J Mol Sci 2021; 22(5): 2654 8 Chovanec M, Cheng L: Advances in diagnosis and treatment of testicular cancer. BMJ 2022; 379: e070499 9 Treglia G et al.: Diagnostic performance of fluorine-18-fluorodeoxyglucose positron emission tomography in the postchemotherapy management of patients with seminoma: systematic review and meta-analysis. Biomed Res Int 2014; 2014: 852681 10 Hiester A et al.: Preservation of ejaculatory function after postchemotherapy retroperitoneal lymph node dissection (PC-RPLND) in patients with testicular cancer: template vs. bilateral resection. Front Surg 2018; 5: 80 11 Carver BS et al.: Incidence of metastatic nonseminomatous germ cell tumor outside the boundaries of a modified postchemotherapy retroperitoneal lymph node dissection. J Clin Oncol 2007; 25(28):4365-9 12 Alsyouf M, Daneshmand S: Intricacies of retroperitoneal lymph node dissection for testis cancer. Curr Opin Urol 2022; 32(1): 24-30 13 Motzer RJ et al.: Salvage chemotherapy for patients with germ cell tumors. The Memorial Sloan-Kettering Cancer Center experience (1979-1989). Cancer 1991; 67(5):1305-10 14 Adra N et al.: High-dose chemotherapy and autologous peripheral-blood stem-cell transplantation for relapsed metastatic germ cell tumors: the Indiana University experience. J Clin Oncol 2017; 35(10): 1096-1102 15 Chovanec M et al.: High-dose chemotherapy for relapsed testicular germ cell tumours. Nat Rev Urol 2022 16 Feldman DR et al.: Is high dose therapy superior to conventional dose therapy as initial treatment for relapsed germ cell tumors? The TIGER trial. J Cancer 2011; 2: 374-7 17 Oldenburg J et al.: Testicular seminoma and non-seminoma: ESMO-EURACAN Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022; 33(4): 362-75 18 Kalavska K et al.: Immunotherapy in testicular germ cell tumors. Front Oncol 2020; 10: 573977
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...