Adjuvante und neoadjuvante Therapie in der Behandlung des Nierenzellkarzinoms
Autor:
Assoc. Prof. PD Dr. Georg C. Hutterer
Universitätsklinik für Urologie
Medizinische Universität Graz
E-Mail: georg.hutterer@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Nierenzellkarzinom betrifft weltweit rund 3% der Menschen, die an malignen Tumoren erkranken, in den Industriestaaten geschätzt 3–5% , wobei die Inzidenz steigt. Im adjuvanten Setting wurde mit Pembrolizumab beim klarzelligen Nierenzellkarzinom mit hohem Rezidivrisiko die erste Substanz zugelassen, ein Anlass, die Therapieoptionen im Detail zu betrachten.
Keypoints
-
Der anti-PD-1-ICI Pembrolizumab repräsentiert die erste adjuvant zugelassene Substanz, die bei Patient:innen mit klarzelligem NZK mit hohem Rezidivrisiko einen signifikanten Vorteil des krankheitsfreien Überlebens (DFS) und ein tendenziell verlängertes OS demonstrieren konnte, wobei die Gesamtüberlebensdaten noch unreif sind.
-
Patient:innen mit klarzelligem NZK und hohem Rezidivrisiko sollte eine adjuvante Therapie für bis zu 12 Monate nach Besprechung des individuellen Nutzen-/Risikoprofils angeboten werden.
-
Im neoadjuvanten NZK-Setting ist derzeit nach internationalen Leitlinien keine ICI/TKI-Therapie zugelassen und sollte hochselektionierten Patient:innen (idealerweise im Rahmen klinischer Studien) vorbehalten werden.
Epidemiologie und Risikoeinteilung des Nierenzellkarzinoms
Das Nierenzellkarzinom (NZK) repräsentiert zur Zeit global ∼3% aller humanen malignen Tumoren, wobei die höchsten Inzidenzraten in westlichen Nationen beobachtet werden.1,2 Die Betrachtung aktueller (2023) statistischer US-Daten des NZK zeigt selbiges bezüglich einer geschätzten Inzidenzrate von >52300 (5%) an derzeit 6. Stelle unter allen Malignomen des Mannes und von >29400 (3%) an 9. Position aller Malignome der Frau. Die Mortalität betreffend findet sich das NZK 2023 bei beiden Geschlechtern in den USA nicht unter den 10 häufigsten malignen Erkrankungen des Menschen.3 Allerdings zeigte das NZK noch bis vor kurzem während der letzten 20 Jahre (sowohl weltweit als auch in Europa) jährliche Inzidenzzuwachsraten von bis zu ∼2%.4
Zudem besteht die Problematik dieser Tumorentität unverändert zu den letzten Dekaden darin, dass trotz chirurgisch kurativer Therapie (partielle oder totale Nephrektomie) bis zu ∼30% aller Betroffenen im weiteren zeitlichen Krankheitsverlauf metachrone Fernmetastasen entwickeln, womit das NZK in ein palliativ-therapeutisches Setting übergeht.5 Reflektiert wird diese ungünstige Langzeitprognose auch durch das 5-Jahres-krebsspezifische Überleben (CSS), welches im Stadium III (T1–T3, N1, M0; T3, N0, M0) nur mehr ∼53% beträgt.6
Aus diesen Überlegungen erklärt sich die dringende Notwendigkeit einer Risikoreduktion durch Senkung von Rezidivrate und Mortalität des NZK (insbesondere bei Hochrisiko-Patient:innen) mittels Verbesserung adjuvanter Therapiemodalitäten.
Die Evaluierung des NZK-Rezidivrisikos erfolgt anhand prädiktiver Risikomodelle und Algorithmen, wobei hier aus Platzgründen nur einige wichtige erwähnt werden sollen:
-
das „University of California at Los Angeles (UCLA) Integrated Scoring System (UISS)“, welches TNM-Stadium, Fuhrman-Grad der Kernatypie und ECOG Performance Status benutzt, um Patient:innen in 3 Risikokategorien (Low-, Intermediate- und High-Risk-Prognose-Gruppe) einzuteilen.7 Dieses Risikomodell ermöglicht beim nicht metastasierten NZK eine korrekte Vorhersage des postoperativen 2- und 5-Jahres-Überlebens (unabhängig vom histologischen Subtyp) in 76–86%.7
-
Der „Leibovich Prognosis Score“ verwendet TNM-Stadium, Lymphknotenstatus, Tumorgröße, Fuhrman-Grad der Kernatypie und histologische Tumornekrose, um beim klarzelligen NZK ein niedriges bzw. hohes Risiko für metastasierte Mortalität mit einer Vorhersagewahrscheinlichkeit von >80% zu prognostizieren.8
-
Weitere wichtige postoperative Risikomodelle sind etwa der „Stage, Size, Grade and Necrosis (SSIGN) Score“,9 das „Karakiewicz Nomogram“10 und das „Kattan Nomogram“.11
Eine klinische Routineanwendung dieser Risikomodelle und Algorithmen wird allerdings durch mehrere Faktoren erschwert, u.a. unterschiedliche Risikoestimate,12 keine adäquate Berücksichtigung der Tumorbiologie sowie fehlende Klarheit über den zeitlichen Einsatz möglicher adjuvanter Therapien.12 Neuere Risikomodelle für das klarzellige NZK, welche Genexpressionsmuster beinhalten, wie z.B. „ClearCode34“,13 haben bis dato jedoch ebenso wenig Eingang in die Routineprognostik gefunden.
Adjuvante Therapie
Frühe adjuvante Trials in der Ära vor den Tyrosinkinaseinhibitoren (TKI) verliefen durchwegs enttäuschend.14 Eine Metaanalyse, welche 10 randomisierte kontrollierte Studien mit >2600 Patient:innen inkludierte, demonstrierte keinen Vorteil für eine adjuvante Behandlung (Zytokin-Therapie, Vakzinierung, Chemotherapie, Thalidomid) im Vergleich zur alleinigen Nachsorge für das krankheitsfreie Überleben (DFS) oder das Gesamtüberleben (OS).14,15 Ebenso wenig konnten IFN-α oder IL-2 adjuvant (weder einzeln noch kombiniert) einen signifikanten Effekt auf das DFS oder OS nachweisen.14,16,17 Selbiges galt auch für die wöchentliche parenterale Verabfolgung des monoklonalen IgG1-Antikörpers Girentuximab bei Hochrisiko-Patient:innen mit klarzelligem NZK in der randomisierten Phase-III-Studie ARISER (DFS, HR: 0,97; OS, HR: 0,99).18
Ära der Tyrosinkinaseinhibitoren
Adjuvante Phase-III-Trials in der TKI-Ära zeichnen (mit Ausnahme von S-TRAC19) ein ähnliches Bild: ASSURE (Wirksamkeit von Sunitinib sowie Sorafenib vs. Placebo; DFS/Sunitinib, HR: 1,02; p=0,8; DFS/Sorafenib, HR: 0,97; p=0,7; medianes OS nicht erreicht; 5-Jahres-OS/Sunitinib, HR: 1,17; p=0,2; 5-Jahres-OS/Sorafenib, HR: 0,98; p=0,9),20 PROTECT (Wirksamkeit von Pazopanib vs. Placebo; OS/HR: 1,0; p>0,9),21 ATLAS (Wirksamkeit von Axitinib vs. Placebo; DFS/HR: 0,87; p=0,3),22 SORCE (Wirksamkeit von Sorafenib vs. Placebo bei NZK-Patient:innen mit intermediärem oder hohem Rezidivrisiko; 3-Jahres-DFS/HR: 1,01; p=0,9; 3-Jahres-OS/HR: 1,06; p=0,6).23 Einzig die S-TRAC-Studie19 demonstrierte ein verlängertes DFS mit Sunitinib vs. Placebo (6,8 vs. 5,6 Jahre; HR: 0,76; p=0,03), jedoch ohne Verlängerung des OS. Hingegen zeigen alle genannten adjuvanten TKI-Phase-III-Trials einen hohen Anteil klinisch relevanter Toxizitäten.14
Eine aktuelle Metaanalyse der oben genannten Phase-III-Studien (S-TRAC, ASSURE, PROTECT, ATLAS, SORCE) an >6500 NZK-Patient:innen demonstrierte ein signifikant verlängertes DFS vs. Placebo (gepoolte HR: 0,88; p=0,004), jedoch keinerlei signifikante OS-Verlängerung vs. Placebo mittels adjuvanter TKI-Therapien (gepoolte HR: 0,93; p=0,23).24 Die Autor:innen konkludieren, dass allenfalls hochselektionierte NZK-Patient:innen mit sehr schlechter Prognose von solchen adjuvanten Therapien (eingedenk gravierender Toxizitäten) profitieren können.
EVEREST SWOG S0931 verglich 1:1 randomisiert an >1500 operierten NZK-Patient:innen (intermediate high- [pT1, G3-4, N0 bis pT3a, G1-2, N0] oder very high-risk [pT3a, G3-4 bis pT4, G-any od. N+]) das rezidivfreie Überleben (RFS) nach adjuvanter Verabfolgung (54 Wochen) des mTOR-Inhibitors Everolimus vs. Placebo (DFS/HR: 0,85; OS/HR: 0,90).25 Nach einem medianen Follow-up von 6,3 Jahren verbesserte zwar Everolimus vs. Placebo das RFS, allerdings insignifikant (HR: 0,85; p=0,0246), da der prädefinierte Signifikanz-Level von p=0,022 verfehlt wurde; zudem wurde diese RFS-Verbesserung lediglich bei „Very high-risk“-Patient:innen observiert (HR: 0,79, p=0,011).25
Eine rezent bei der ASCO 2023 Jahrestagung präsentierte Subgruppenanalyse betreffend chromophobe (n=99) und papilläre (n=109) NZK demonstrierte nach derselben Follow-up-Zeit folgende Resultate: chromophobe NZK DFS/HR: 0,89; p=0,8; OS/HR: 0,93, p=0,9; papilläre NZK DFS/HR: 1,19; p=0,61; OS/HR: 1,47; p=0,3.26
Immuncheckpoint-Inhibitoren
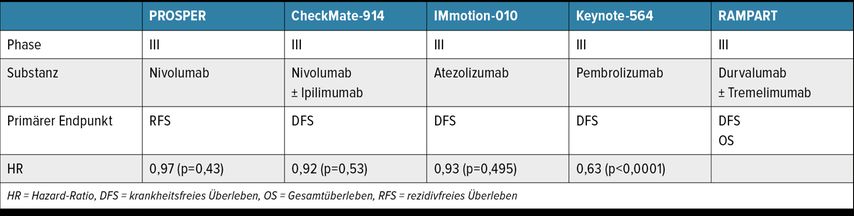
Die Etablierung von Immuncheckpoint-Inhibitoren (ICI) in der palliativen Kombinationstherapie des fortgeschrittenen oder metastasierten NZK konnte eine OS-Verbesserung demonstrieren, weshalb selbige mittlerweile zum Standard in der Erstlinientherapie geworden ist (Abb. 1).14,27 Eine exakte Beurteilung der Wertigkeit existierender adjuvanter ICI-Phase-III-Trials erweist sich in praxi allerdings als schwierig, nachdem u.a. direkte Studienvergleiche unmöglich sind, jeweils distinkte, mit verschiedenen Therapien behandelte NZK-Studienpopulationen untersucht und zudem in den einzelnen Trials nicht zuletzt differierende Studienendpunkte analysiert werden (Tab. 1).14
Abb. 1: a) Aktualisierte Empfehlungen der EAU-Richtlinien für die Erstbehandlung von cc-mRCC, b) Empfehlungen der EAU-Richtlinien für die Spättherapie (modifiziert nach Ljungberg B et al. 2023)40
IMmotion010 (Wirksamkeit von Atezolizumab vs. Placebo bei >770 Patient:innen mit klarzelligem NZK oder mit sarkomatoider Komponente und erhöhtem Rezidivrisiko; DFS/HR: 0,93; p=0,5),28 Check Mate 914 (Wirksamkeit von Nivolumab + Ipilimumab vs. Placebo bei >810 Patient:innen mit lokalisiertem, klarzelligem NZK; DFS/HR: 0,92; p=0,5),29 und PROSPER (Wirksamkeit von perioperativem Nivolumab vs. Observation; RFS/HR: 0,97; p=0,4)30 haben ihren jeweiligen primären Endpunkt verfehlt; die Resultate von RAMPART (3-armig; Durvalumab ± Tremelimumab vs. aktives Monitoring für 12 Monate bei NZK-Patient:innen mit intermdiärem oder hohem Rezidivrisiko; koprimäre Endpunkte: DFS und OS) sind noch ausständig.31
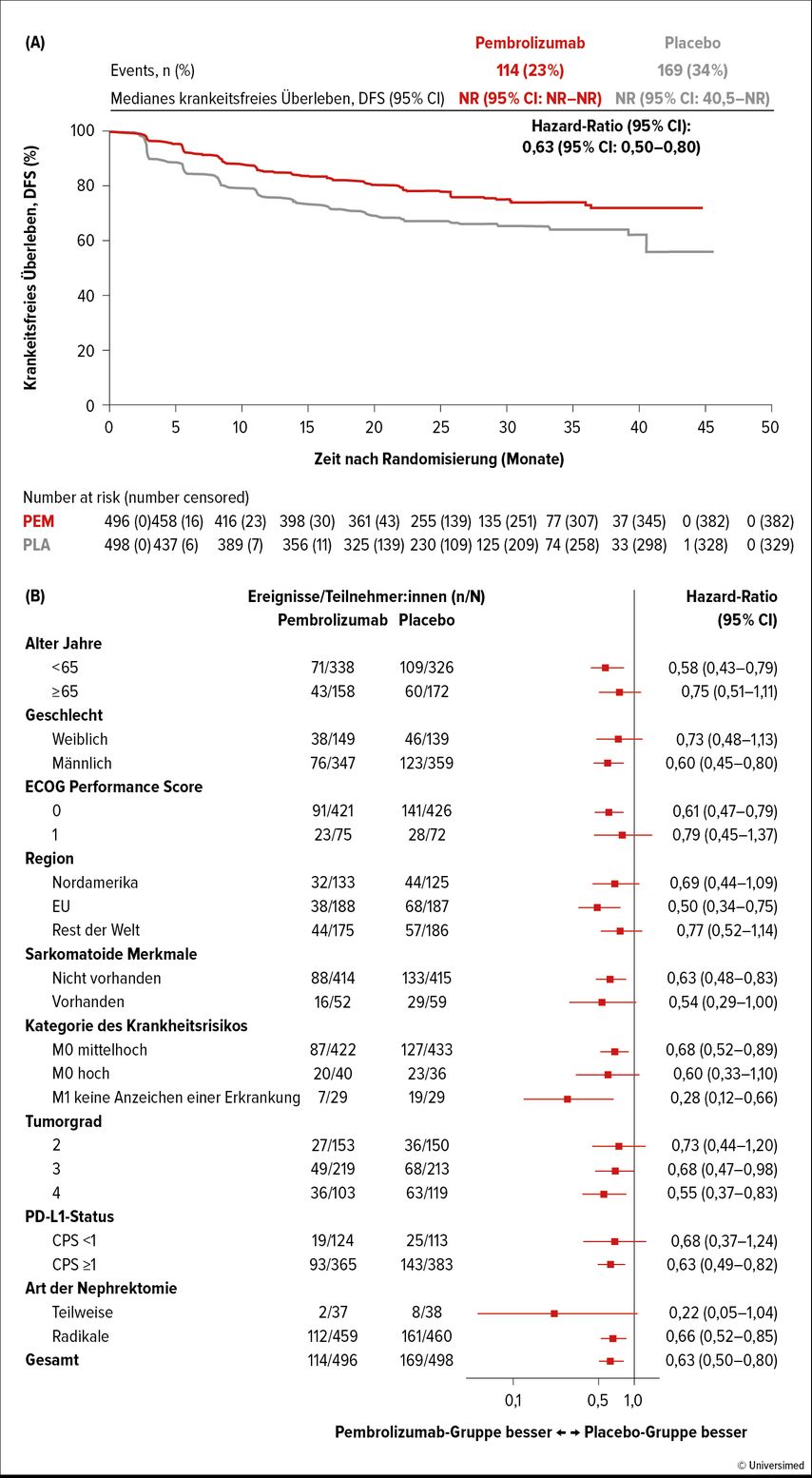
Die erste positive Phase-III-Studie bezüglich des DFS mittels adjuvanter Immuntherapie (Pembrolizumab nach Nephrektomie bei klarzelligen NZK-Patient:innen mit hohem Rezidivrisiko) repräsentiert der KEYNOTE-564-Trial, von welchem mittlerweile 30-Monate-Follow-up-Resultate publiziert wurden.32 In KEYNOTE-564 wurden von 06/2017–09/2019 (doppelblind, placebokontrolliert) 994 Patient:innen mit klarzelligem NZK, ≤12 Wochen vor Studienbeginn nephrektomiert, ohne vorangehende Systemtherapie, ECOG Performance Status 0–1, 1:1 auf 2 Studienarme randomisiert: i.v. Pembrolizumab (anti-PD-1-ICI) 200mg Q3W bis zu 17 Zyklen (∼1 Jahr) [n=496] vs. Placebo Q3W (n=498). Drei prädefinierte Risikokategorien von Patient:innen wurden etabliert: intermediär-hohes Risiko (pT2, G 4 oder sarkomatoide Anteile, N0, M0; od. pT3, jedes G, N0, M0); hohes Risiko (pT4, jedes G, N0, M0; oder jedes pT, jedes G, N+, M0) oder M1 NED (no evidence of disease) nach Resektion oligometastatischer Läsionen ≤12 Monate post Nephrektomie. Primärer Studienendpunkt war das DFS in der ITT-Population; sekundäre Endpunkte beinhalteten Verträglichkeit/Toxizitäten sowie OS; das mediane Follow-up betrug 30,1 Monate; zum Zeitpunkt dieser Analyse wurde der primäre Endpunkt DFS erreicht (Median in beiden Armen noch nicht erreicht, HR: 0,63); die estimierte DFS-Rate nach 30 Monaten betrug 75,2% im Pembrolizumab-Studienarm vs. 65,5% (Placebo). Der beobachtete DFS-Benefit zeigte sich in den Subgruppenanalysen konsistent (Abb. 2). Das mediane OS wurde in beiden Studienarmen noch nicht erreicht (HR: 0,52); die estimierte OS-Rate betrug 95,7% im Pembrolizumab-Studienarm vs. 91,4% (Placebo). 157/488 (32%) und 88/496 (18%) Patient:innen entwickelten ≥Grad-3-Nebenwirkungen (any-cause AEs) mit Pembrolizumab vs. Placebo. Unter den therapieassoziierten AEs mit einer Inzidenz ≥1% dominierten im Pembrolizumab-Arm adrenale Insuffizienz, Kolitis und diabetische Ketoazidose, wobei in beiden Studienarmen keine Todesfälle durch therapieassoziierte AEs beobachtet wurden. Immun-mediierte AEs (iAEs) entwickelten 174 (36%) Patient:innen im Pembrolizumab-Arm und 34 (7%) im Placebo-Arm; die häufigsten im Pembrolizumab-Arm waren Hypo- (103/21%) und Hyperthyreose (62/13%), im Placebo-Arm Hypothyreose (18/4%). Eine hoch dosierte systemische Kortikosteroidtherapie (≥40mg/d) aufgrund von iAEs benötigten 37 (8%) Patient:innen im Pembrolizumab-Arm vs. 3 (1%) im Placebo-Arm. Die häufigsten Ursachen für eine Therapieunterbrechung waren AEs (105/488 [22%] Pembrolizumab vs. 11/496 [2%] im Placebo-Arm sowie Rezidive 51/488 [10%] Pembrolizumab vs. 101/496 [20%] im Placebo-Arm. In der ITT-Population ereigneten sich 66 Todesfälle 23/496 [5%] Pembrolizumab und 43/498 [9%] im Placebo-Arm).
Pembrolizumab demonstrierte in der Interimsanalyse von KEYNOTE-564 eine signifikante und klinisch relevante Verbesserung des DFS vs. Placebo bei klarzelligen NZK-Patient:innen der prädefinierten Risikogruppen intermediär-hohes Risiko, hohes Risiko oder M-1 NED, was zur Erst- und bis dato einzigen Zulassung dieses anti-PD-1-ICI im adjuvanten Setting geführt hat (FDA: 11/2021; EMA: 01/2022).14 Nachdem bezüglich des OS das statistische Signifikanzniveau noch nicht erreicht wurde, ist ein weiteres Follow-up mit längerer Nachbeobachtungszeit und einer Maturität der OS-Daten unumgänglich.
Abb. 2: Kaplan-Meier-Diagramm: krankheitsfreies Überleben (primärer Endpunkt) für die Gesamtpopulation (A) und Subgruppenanalyse des krankheitsfreien Überlebens (B). CPS = kombinierter positiver Score. Das Kaplan-Meier-Diagramm zeigt die Auswertung der Daten zu dem Zeitpunkt an, zu dem bekannt war, dass der/die Teilnehmer:in am Leben waren und kein erneutes Auftreten hatten. ECOG = Eastern Cooperative Oncology Group. NR = nicht erreicht (modifiziert nach Powles T et al., 2022)32
Neoadjuvante Therapie
Die neoadjuvante medikamentöse Behandlung lokalisierter NZK betreffend wird der (historische) Einsatz von Zytokinen u.a. aufgrund fehlender Phase-III-Daten nicht empfohlen, obwohl beispielsweise in einer Phase-II-Studie mittels Verabfolgung von präoperativem IL-2 (vor Nephrektomie) sowohl das tumorspezifische (98 vs. 81% nach 1 Jahr; 86 vs. 73% nach 5 Jahren; p=0,04) als auch progressionsfreie Überleben (PFS) (94 vs. 84% nach 1 Jahr; 81 vs. 62% nach 5 Jahren; p=0,0019) verbessert werden konnten.14,33
Betrachtet man als Zielsetzung neoadjuvanter Therapie des NZK eine größtmögliche Reduktion der Primärtumormasse bzw. Metastasenlast vor chirurgischer Resektion, so spielt die Selektion betroffener Patient:innen, welche potenziell am meisten von einer chirurgischen Vorgangsweise profitieren können, eine fundamentale Rolle.34 Beim lokal fortgeschrittenen NZK könnte die Neoadjuvanz dazu beitragen, die chirurgische Erfolgsrate bei der Resektion von Hochrisikotumoren zu erhöhen, welche beispielsweise bereits in benachbarte Organsysteme und/oder große Blutgefäße infiltriert haben.35 Obwohl in diesem Zusammenhang mehrere Studien vielversprechende Resultate, wie ein Tumor-Downstaging oder einen erleichterten chirurgischen Zugang bei Tumoren mit V.cava-inf.-Thrombus demonstrieren konnten, wurden bis dato in internationalen Leitlinien keine neoadjuvanten medikamentösen Therapien beim NZK zugelassen.34–36
Die Effektivität der Immuntherapie basiert entscheidend auf einer Antigendetektion durch T-lymphozytäre T-Zell-Rezeptoren.37 Insofern besteht eine wesentliche Rationale für den Einsatz neoadjuvanter ICI-Therapien in der Phase der potenziell am stärksten ausgeprägten T-Zell-Aktivierung, d.h. während derer sich ein Primärtumor noch in situ befindet.34,38
Die Resultate rezenter bzw. laufender neoadjuvanter ICI-therapeutischer Studien, welche sowohl singuläre als auch Kombinationen von Antikörpern testen, sind durchwachsen. Die einarmige Open-Label-Phase-II-Studie NeoAvAx evaluiert die Kombination von neoadjuvantem Axitinib + Avelumab (über 12 Wochen vor chirurgischer Komplettresektion) bei 40 Patient:innen mit nicht metastasiertem, klarzelligem Hochrisiko-NZK mit dem primären Endpunkt einer Remission des Primums nach RECIST v1.1 (NCT03341845).38 Nach einem medianen Follow-up von 23,5 Monaten entwickelten 13/40 (32,5%) Patient:innen Rezidive; 3 Todesfälle wurden observiert; medianes DFS und OS wurden nicht erreicht; 30% der Patient:innen demonstrierten eine partielle Remission des Primums. Eine Biomarkeranalyse zeigte bei Patient:innen, welche ein Rezidiv entwickelten, deutlich geringere CD8+-Densitäten vs. Patient:innen ohne Rezidivtumoren. NeoAvAx repräsentiert die erste (wiewohl nicht randomisierte) neoadjuvante Studie einer ICI-VEGFR-TKI-Kombination beim lokal fortgeschrittenen Hochrisiko-NZK.38
Die (bis dato einzige) randomisierte Phase-III-Studie, welche die Wirksamkeit von perioperativem Nivolumab an >800 Hochrisiko-NZK-Patient:innen (≥T2, Nany, M0 oder oligo M1, jedweder histologischer Subtyp) analysiert, ist PROSPER/ECOG-ACRIN EA8143.39 Hintergrund ist ein mögliches „Priming“ des Immunsystems mit neoadjuvantem Nivolumab (1 Zyklus) vor partieller oder radikaler Nephrektomie, gefolgt von adjuvantem Nivolumab (i.v. 480mg q4w/9 Dosen) vs. alleinige Chirurgie.30 Primärer Endpunkt war RFS, sekundäre Endpunkte beinhalteten RFS bei klarzelliger Histologie (83% der Patient:innen), OS und Lebensqualität (QoL). Die Studie wurde frühzeitig gestoppt. Das mediane RFS wurde nicht erreicht, wobei sich beide Studienarme bezüglich des RFS nicht unterschieden (HR: 0,97; p=0,43). Die OS-Daten waren zum Analysezeitpunkt unreif, jedoch ebenfalls zwischen beiden Armen nicht different (HR: 1,48; p=0,93); ∼12% der Patient:innen aus beiden Armen brachen die Studie vorzeitig ab; therapieassoziierte AEs Grad 3–4 (≥1) entwickelten 20% im Nivolumab-Arm vs. 6% im Kontroll-Arm; die häufigsten AEs Grad 3–4 waren renale Läsionen (1% vs. 2%), Exantheme (2% vs. 0%), und Lipase-Elevation (4% vs. <1%); 15 (4%) karzinombedingte Todesfälle wurden im Nivolumab-Arm observiert, 18 (4%) im Kontroll-Arm. In diesem NZK-Hochrisikokollektiv demonstrierte perioperatives Nivolumab keine RFS-Verbesserung; das OS differierte in beiden Studienarmen ebenfalls nicht, wobei diese Daten noch unreif sind.30
Den offensichtlichen Vorteilen einer neoadjuvanten Therapie des NZK müssten naturgemäß auch mögliche Nachteile (Zunahme von Wundheilungsstörungen, medikamentös bedingte AEs und Toxizitäten, eventuelle Tumorprogression durch zeitlich verzögerte chirurgische Resektion, erhöhte chirurgische Komplikationsrate, etc.) gegenübergestellt werden.34 Insbesondere die Problematik einer möglichen prächirurgischen Krankheitsprogression unter neoadjuvanten ICI-Therapie-Non-Respondern erfordert prospektiv die Generierung validierter Biomarker der Immunantwort, um optimal geeignete Patient:innen für neoadjuvante ICI-Therapiemodalitäten zu selektionieren.
Literatur:
1 Ferlay J et al.: Cancer incidence and mortality patterns in Europe: Estimates for 40 countries and 25 major cancers in 2018. Eur J Cancer 2018; 103: 356-87 2 Capitanio U et al.: Epidemiology of renal cell carcinoma. Eur Urol 2019; 75(1): 74-84 3 Siegel RL et al.: Cancer statistics, 2023. CA Cancer J Clin 2023; 73(1): 17-48 4 Bukavina L et al.: Epidemiology of renal cell carcinoma: 2022 Update. Eur Urol 2022; 82(5): 529-42 5 Gupta K et al.: Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): a literature review. Cancer Treat Rev 2008; 34(3): 193-205 6 American Cancer Society. Survival rates for kidney cancer. https://www.cancer.org/cancer/kidney-cancer/detection-diagnosis-staging/survivalrates.html 7 Zisman A et al.: Improved prognostication of renal cell carcinoma using an integrated staging system. J Clin Oncol 2001; 19(6): 1649-57 8 Leibovich BC et al.: Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer 2003; 97(7): 1663-71 9 Frank I et al.: An outcome prediction model for patients with clear cell renal cell carcinoma treated with radical nephrectomy based on tumor stage, size, grade and necrosis: the SSIGN score J Urol 2002; 168(6): 2395-400 10 Karakiewicz PI et al.: Multi-institutional validation of a new renal cancer-specific survival nomogram. J Clin Oncol 2007; 25(11): 1316-22 11 Kattan MW et al.: A postoperative prognostic nomogram for renal cell carcinoma. J Urol 2001; 166(1): 63-7 12 Pal SK et al.: Adjuvant therapy for renal cell carcinoma: past, present, and future. Oncologist 2014; 19(8): 851-9 13 Brooks SA et al.: ClearCode34: A prognostic risk predictor for localized clear cell renal cell carcinoma. Eur Urol 2014; 66(1): 77-84 14 Hilser T et al.: [Current concepts for perioperative systemic therapy in advanced renal cell carcinoma]. Urologie 2022; 61(12): 1345-50 15 Bai Y et al.: Adjuvant therapy for locally advanced renal cell carcinoma: A meta-analysis and systematic review. Urol Oncol 2018; 36(2): 79.e1-e10 16 Atzpodien J et al.: Adjuvant treatment with interleukin-2- and interferon-alpha2a-based chemoimmunotherapy in renal cell carcinoma post tumour nephrectomy: results of a prospectively randomised trial of the German Cooperative Renal Carcinoma Chemoimmunotherapy Group (DGCIN). Br J Cancer 2005; 92(5): 843-6 17 Pizzocaro G et al.: Interferon adjuvant to radical nephrectomy in Robson stages II and III renal cell carcinoma: a multicentric randomized study. J Clin Oncol 2001; 19(2): 425-31 18 Chamie K et al.: Adjuvant Weekly Girentuximab Following Nephrectomy for High-Risk Renal Cell Carcinoma: The ARISER Randomized Clinical Trial. JAMA Oncol 2017; 3(7): 913-20 19 Ravaud A et al.: Adjuvant Sunitinib in High-Risk Renal-Cell Carcinoma after Nephrectomy. N Engl J Med 2016; 375(23): 2246-54 20 Haas NB et al.: Adjuvant sunitinib or sorafenib for high-risk, non-metastatic renal-cell carcinoma (ECOG-ACRIN E2805): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet 2016; 387(10032): 2008-16 21 Motzer RJ et al.: Randomized Phase III Trial of Adjuvant Pazopanib Versus Placebo After Nephrectomy in Patients With Localized or Locally Advanced Renal Cell Carcinoma. J Clin Oncol 2017; 35(35): 3916-23 22 Gross-Goupil M et al.: Axitinib versus placebo as an adjuvant treatment of renal cell carcinoma: results from the phase III, randomized ATLAS trial. Ann Oncol 2018; 29(12): 2371-78 23 Eisen T et al.: Adjuvant Sorafenib for Renal Cell Carcinoma at Intermediate or High Risk of Relapse: Results From the SORCE Randomized Phase III Intergroup Trial. J Clin Oncol 2020; 38(34): 4064-75 24 Laukhtina E et al.: Adjuvant therapy with tyrosine kinase inhibitors for localized and locally advanced renal cell carcinoma: an updated systematic review and meta-analysis. Urol Oncol 2021; 39(11): 764-73 25 https://www.clinicaltrials.gov/study/NCT01120249 26 Gulati S et al.: Adjuvant everolimus in patients (Pts) with localized non-clear cell renal cell carcinoma (RCC): Subgroup analysis from the Everest trial (SWOG S0931). J Clin Oncol 2023; 41(16 suppl): 4546 27 Ljungberg B et al.: European Association of Urology Guidelines on Renal Cell Carcinoma: The 2022 Update. Eur Urol 2022; 82(4): 399-410 28 Pal SK et al.: Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2022; 400(10358): 1103-16 29 Motzer RJ et al.: Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase III trial. Lancet 2023; 401(10379): 821-32 30 Allaf M et al.: LBA67 Phase III randomized study comparing perioperative nivolumab (nivo) versus observation in patients (Pts) with renal cell carcinoma (RCC) undergoing nephrectomy (PROSPER, ECOG-ACRIN EA8143), a National Clinical Trials Network trial. Ann Oncol 2022; 33(Suppl 7): S1432-3 31 Oza B et al.: RAMPART: A phase III multi-arm multi-stage trial of adjuvant checkpoint inhibitors in patients with resected primary renal cell carcinoma (RCC) at high or intermediate risk of relapse. Contemp Clin Trials 2021; 108: 106482 32 Powles T et al.: Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2022; 23(9): 1133-44 33 Klatte T et al.: Perioperative immunomodulation with interleukin-2 in patients with renal cell carcinoma: results of a controlled phase II trial. Br J Cancer 2006; 95(9): 1167-73 34 Martini A et al.: Neoadjuvant and adjuvant immunotherapy in renal cell carcinoma. World J Urol 2021; 39(5): 1369-76 35 Labbate C et al.: Complete response of renal cell carcinoma vena cava tumor thrombus to neoadjuvant immunotherapy. J Immunother Cancer 2019; 7(1): 66 36 Berquist SW et al.: Systemic therapy in the management of localized and locally advanced renal cell carcinoma: Current state and future perspectives. Int J Urol 2019; 26(5): 532-42 37 Sewell AK: Why must T cells be cross-reactive? Nat Rev Immunol 2012; 12(9): 669-77 38 Bex A et al.: A Phase II, single-arm trial of neoadjuvant axitinib plus avelumab in patients with localized renal cell carcinoma who are at high risk of relapse after nephrectomy (NEOAVAX). Future Oncol 2019; 15(19): 2203-09 39 https://classic.clinicaltrials.gov/ct2/show/NCT03055013 40 Ljungberg B et al. EAU Guidelines on Renal Cell Carcinoma – Limited Update March 2023, EAU Kongress 2023; https://uroweb.org/guidelines/renal-cell-carcinoma
Das könnte Sie auch interessieren:
Der Weg von neoadjuvanter Therapie und radikaler Zystektomie hin zum Blasenerhalt
Beim diesjährigen Post EAU 2025 Meeting in Wien präsentierte Dr. Kilian Gust, FEBU (Medizinische Universität Wien), ein aktuelles Update zur systemischen Therapie des muskelinvasiven ...
Highlights zum Prostatakarzinom vom EAU in Madrid
Zahlreiche im Rahmen des EAU-Kongresses 2025 in Madrid vorgestellte Arbeiten beschäftigten sich mit Diagnostik und Management des Prostatakarzinoms in allen Stadien der Erkrankung. So ...
Neues zur Li-ESWT in der Therapie der ED
Zwei Arbeiten zeigen den praktischen Einsatz der extrakorporalen Stoßwellentherapie mit niedriger Intensität (Li-ESWT; „low-intensity extracorporal shockwave therapy“) in der Therapie ...