Ablative Verfahren in der Behandlung von Nierentumorerkrankungen
Autoren:
Dr. Robin Padickakudy
Dr. Alvaro Amancio Fernandez Alcalde
Abteilung für Urologie und Andrologie
Klink Donaustadt, Wien
E-Mail: martin.marszalek@gesundheitsverbund.at
OA Dr. Taher Mahdi
Institut für diagnostische und interventionelle Radiologie,
Klinik Donaustadt, Wien
Bösartige Erkrankungen der Niere gehören, entsprechend der Inzidenz, zu den zehn häufigsten Malignomen in Österreich.1 Das Durchschnittsalter bei der Erstdiagnose beträgt ca. 70 Jahre.2 Es ist eine häufige Tumorentität, vor allem in einem älteren Patientenkollektiv mit konsekutiv erhöhter Morbidität. Die chirurgische Resektion stellt in der kurativen Therapie den Goldstandard dar.3 Indiesem spezifischen Patientenkollektiv kann jedoch ein chirurgisches Vorgehen aufgrund des Allgemeinzustands der Patienten herausfordernd sein.
Keypoints
-
Ablative Verfahren spielen bei kleinen Nierentumoren (<4cm) eine immer größere Rolle.
-
Als Verfahren stehen primär die Radiofrequenz-, die Mikrowellen- und die Kryoablation zur Verfügung.
-
Der Eingriff erfolgt CT-gezielt, wobei eine oder mehrere Sonden in den Tumor eingebracht werden. Die Aktivierung der Sonden bewirkt eine Temperaturdifferenz und damit das Absterben des Tumors.
-
Die Indikation für ein ablatives Verfahren wird meist im Rahmen eines interdisziplinären Tumorboards gestellt.
-
Ablative Verfahren bei Nierentumoren sind nicht primär als kurative Therapie zu sehen, zeigen aber Vorteile bei Patienten, die nicht fit für ein chirurgisches Vorgehen sind.
Entsprechend dem Bedarf an Alternativen hat sich in den letzten Jahren ein multimodales Therapiekonzept entwickelt, in dem ablative Verfahren, vor allem bei kleinen Tumoren (<4cm), eine immer größere Rolle spielen. Beschleunigt wurde diese Entwicklung durch die steigende Detektionsrate von kleinen Tumoren, durch die breitere Anwendung von Schnittbildverfahren und durch das zunehmende Bestreben, die Nierenfunktion zu erhalten.
Wirkprinzip & Ablauf des Eingriffs
Ablative Verfahren umfassen verschiedene Techniken, die genau abgegrenzte Areale mit sehr hohen oder niedrigen Temperaturen erzeugen. Diese extremen Temperaturen im Tumor führen zu dessen Absterben. Zu den Techniken zählen unter anderem die Radiofrequenzablation (RFA), die Mikrowellenablation oder die Kryoablation.4 Bei der RFA wird ein hochfrequenter Wechselstrom im Tumorgewebe benutzt, um Hitze und konsekutiv Zelldestruktion zu erzeugen. Bei der Mikrowellenablation wird ein wechselndes elektromagnetisches Feld genützt, um Wassermoleküle oszillierend auszurichten und durch die innere Reibung Hitze im Appliaktionsgebiet zu generieren. Bei der Kryoablation wird ein flüssiges Kühlmittel in eine Sonde eingeleitet, die im Tumor platziert wird. Die Kälte führt zur Zerstörung des umliegenden Gewebes.5
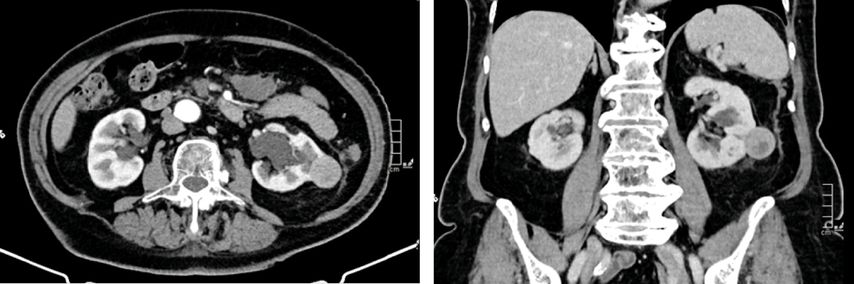
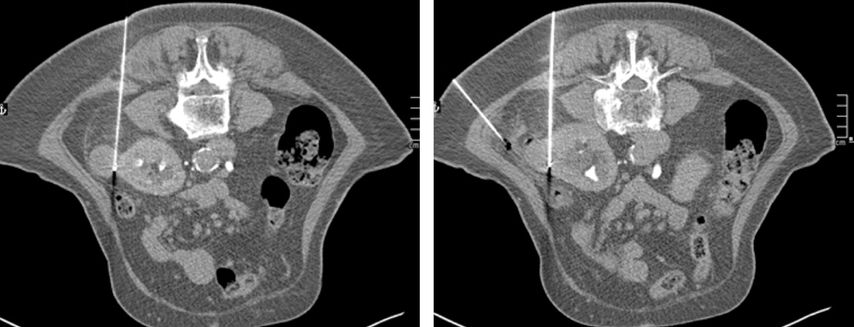
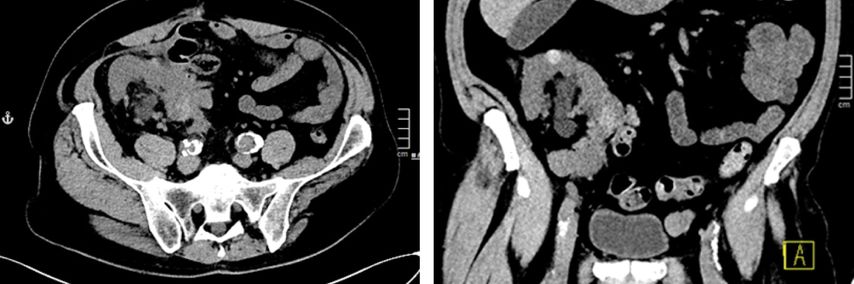
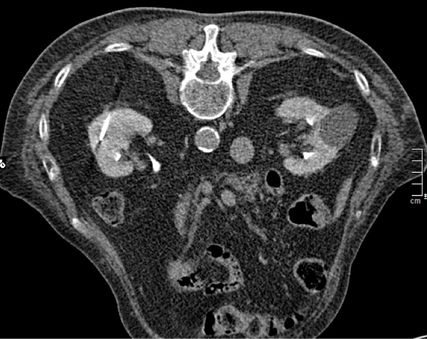
In Österreich sind ablative Verfahren der Niere Domäne der interventionellen Radiologie. Der Eingriff erfolgt in der Regel unter stationären Bedingungen. In den Nierentumor wird CT-gezielt eine oder mehrere Sonden eingebracht (Abb. 1–4), die durch Aktivierung die Temperaturdifferenz und somit das Absterben des Tumors bewirkt. Mit einer anschließenden CT-Untersuchung lässt sich der Effekt der Ablation bestätigen.
Die Patienten werden mehrere Stunden postinterventionell überwacht. Am Tag der Intervention erfolgt eine laborchemische Kontrolle. Üblicherweise werden die Patienten am 1. postoperativen Tag entlassen und können innerhalb weniger Tage wieder voll aktiv sein.
Die Zahl der ablativ behandelten Patienten steigt jährlich. Grund hierfür sind unter anderem gute Daten zur Effektivität der Therapie gepaart mit kaum schweren Komplikationen bzw. Nebenwirkungen. Somit stellen ablative Verfahren eine sinnvolle Alternative zur chirurgischen Resektion bei selektierten Patienten dar.6
Indikationen
Einen klar definierten Indikationsbereich für ablative Verfahren bei Nierentumorerkrankungen gibt es nicht. Meist wird die Indikation im Rahmen eines interdisziplinären Tumorboards gestellt. Gewisse Faktoren können die Entscheidung zwischen chirurgischem und ablativem Vorgehen in Richtung Ablation lenken, da Patienten vom Einsatz der Ablation profitieren können. Zu diesen Faktoren zählen unter anderem:
-
die Notwendigkeit zum nephronsparenden, funktionserhaltenden Vorgehen. Besonders relevant ist dies bei Patienten mit chronischer Niereninsuffizienz, bilateralen Nierentumoren, Einzelniere oder der genetischen Prädisposition für multiple Nierentumoren (z.B. Von-Hippel-Lindau-Syndrom).
-
die Multimorbidität bzw. fortgeschrittenes Alter des Patienten,
-
die Tumorgröße, vor allem Patienten mit einem kleinen (idealerweise unter 4cm) inzidentellen Nierentumor.
Patienten, die eines oder mehrere dieser Kriterien erfüllen, scheinen günstige Kandidaten für eine Ablation zu sein.
Patientenselektion
Da Tumorgröße und -lokalisation die entscheidenden Faktoren sind für einen erfolgreichen ablativen Eingriff, ist für die Patientenselektion die Bildgebung entscheidend.7 Diese sollte mittels CT mit Kontrastmittel bzw. einem MRT der Nieren erfolgen.
Bei der Planung des Eingriffs ist ein Sicherheitsabstand von 0,5 bis 1cm um den Tumor einzukalkulieren, um diesen onkologisch sicher zu behandeln.8
Exophytische Tumoren eignen sich für eine Ablation besser als zentrale Tumoren. Grund dafür ist einerseits die Gefahr der Verletzung großer Gefäße bzw. der Harnwege bei zentralen Tumoren, andererseits der verstärkte „heat-sink effect“. Dieser ist folgendermaßen begründet: Wenn extreme Temperaturen bei Tumoren angewandt werden, die von reichlich vaskularisiertem Gewebe umgebensind, wird die Wärme rascher durch die Gefäße abtransportiert, somit verringert sich der destruktive Effekt auf die Tumorzellen. Exophytische Tumoren sind umgeben von perirenalem Fett, das einen Isolationseffekt zeigt und damit die Wärme im Applikationsgebiet hält.9
Werden diese Faktoren berücksichtigt, lassen sich Patienten selektieren, bei denen ein nebenwirkungsarmer und onkologisch respektabler Verlauf zu erwarten ist.
Kontraindikationen
Bei der Patientenselektion gibt es einige relative Kontraindikationen. Eine Lebenserwartung unter einem Jahr sowie eine systemische Erkrankung mit Fernmetastasen zählen als relative Kontraindikationen. Weitere tumorspezifische relative Kontraindikationen sind eine Tumorgröße über 5cm, ein zentraler Tumor im Bereich des Nierenhilus bzw. des proximalen Ureters.
Eine weitere relative Kontraindikation ist eine Koagulopathie.
Auswahl des ablativen Verfahrens und des Zugangs
Die am häufigsten eingesetzten ablativen Verfahren sind die RFA und die Kryoablation. Das wesentlichste Auswahlkriterium sind die lokale Expertise und die Präferenz des Anwenders. Es liegt eine Metaanalyase vor, die das Outcome zwischen RFA und Kryoablation bei 1375 Eingriffen untersucht hat, wobei bei den Ergebnissen keine signifikanten Unterschiede festgestellt wurden.10
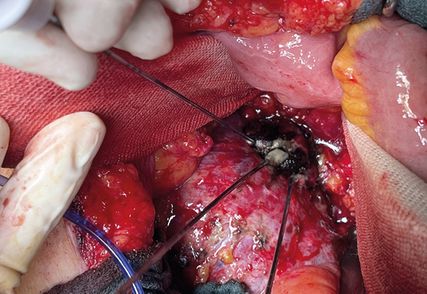
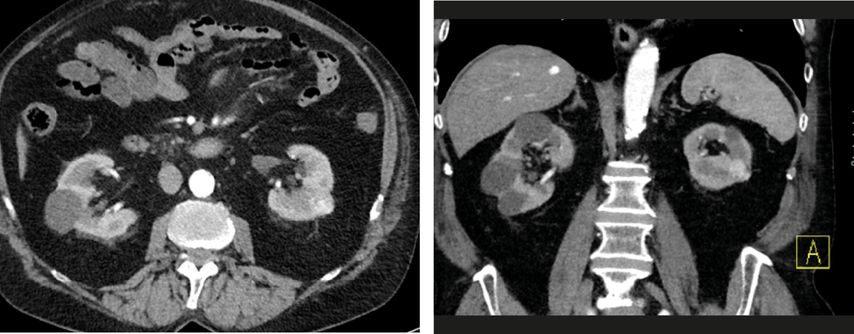
Die allermeisten ablativen Interventionen bei Nierentumoren erfolgen perkutan. Alternativ besteht auch die Möglichkeit des laparoskopischen bzw. offenen Zugangs mit Freilegung des Tumors und laparoskopischem bzw. offenem (Abb. 5–8) Einbringen der Sonde. Bei der Frage des Zugangs ist abgesehen von der lokalen Expertise die Lage des Tumors relevant. Ist der Tumor perkutan nicht bzw. schwer erreichbar, wie zum Beispiel bei einer Transplantatniere, bietet die Laparoskopie bzw. die offene Freilegung eine Alternative.
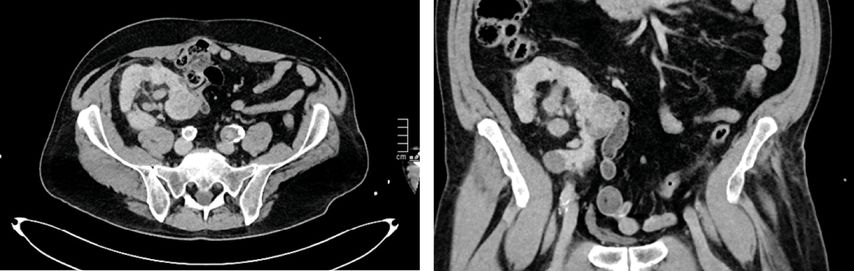
Abb. 7 und 8: CT-Kontrolle 6 Wochen nach offener Freilegung der Niere mit Thermoablation
Komplikationen
Im Allgemeinen zeichnen sich ablative Verfahren als relativ sichere Interventionen aus.11 Die meisten Komplikationen sind mild und bedürfen keiner Therapie. Schwere behandlungsbedürftige Komplikationen, die bei etwa 1–7% der Fälle auftreten können,12,13 umfassen unter anderem Komplikationen wie Blutungen, Gefäßverletzungen und Darmverletzungen.14 Zentrale Tumorlokalisation und Tumorgröße zeigen eine signifikante Assoziation mit einer erhöhten Komplikationsrate.15
Rolle der Biopsie
Die Rolle der Biopsie im Rahmen ablativer Verfahren wird kontrovers diskutiert. Diesbezüglich gibt es einige Aspekte, die für bzw. gegen eine Biopsie sprechen. Fällt die Entscheidung zugunsten der Biopsie, ergibt sich in weiterer Folge die Frage, ob die Biopsie simultan zur Ablation erfolgen sollte oder in einer eigenen Sitzung vor der Ablation.
Daten zeigen, dass bis zu 25% der Patienten, deren Nierentumor präinterventionell biopsiert wurde, histologisch einen benignen Befund zeigten. In dieser Situation stellt die Ablation also eine Überbehandlung dar, die durch eine vorhergehende Biopsie gegebenenfalls vermeidbar wäre.16 Demgegenüber zu stellen ist der Faktor der diagnostischen Genauigkeit einer Biopsie mit allenfalls falsch negativen Befunden.17 Ein Vorteil, den die Biopsie vor einer Ablation bietet, ist die histologische Charakterisierung des Tumors, bevor das Gewebe zerstört ist. Bei zunehmenden adjuvanten Therapieoptionen für Patienten mit erhöhtem Rezidivrisiko nach einer Nierentumorbehandlung kann die Kenntnis der histologischen Merkmale des Tumors das onkologische Outcome deutlich verbessern.
Onkologisches Outcome
Es gibt keine Untersuchungen, die das onkologische Outcome nach Ablation mit einer chirurgischen Resektion direkt vergleichen. Zum aktuellen Zeitpunkt ist somit eine klare evidenzbasierte Aussage zur Überlegenheit eines der beiden Verfahren nicht möglich. Viele Studien zeigen eine sehr gute kurzfristige Tumorkontrolle nach RFA bzw. Kryoablation,10 es gibt limitierte Daten bei chirurgisch nicht fitten Patienten nach einem ablativen Verfahren auch mit langfristig guten Ergebnissen.18
Ebenfalls gibt es derzeit keine belastbaren Daten, die das langfristige onkologische Outcome bei perkutanem versus laparoskopischen Zugang bzw. RFA versus Kryoablation bewerten.
Bezüglich des onkologischen Outcomes lässt sich zusammenfassend sagen, dass aufgrund der Datenlage ablative Verfahren bei Nierentumorerkrankungen nicht primär als kurative Therapie gewertet werden können. Sie zeigen aber deutliche Vorteile bei Patienten, die nicht fit genug für ein chirurgisches Vorgehen sind.18
Follow-up
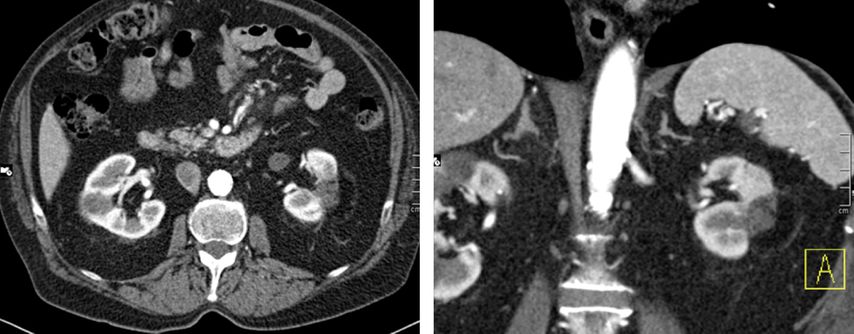
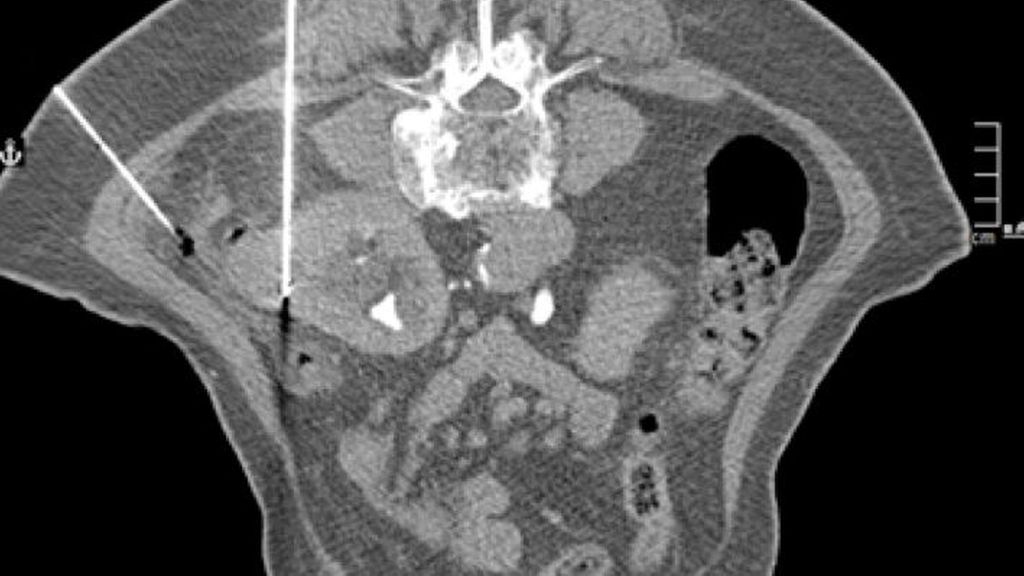
Prinzipiell sollte 3 Monate nach der Intervention eine Bildgebung erfolgen, in aller Regel mit einem kontrastmittelverstärkten CT (Abb. 9–13), um residuelles Tumorgewebe zu detektieren. Die weitere Nachsorge erfolgt standardmäßig in sechsmonatigen bzw. jährlichen Abständen.
Literatur:
1 Statistik Austria Krebserkrankungen 2 Deutsche Krebsgesellschaft 3 Bahadoram S et al.: G Ital Nefrol 2022; 39(3): 2022; 3 4 Wendler JJ et al.: Contemp Clin Trials 2015; 43: 10-9 5 Fujimori M et al.: Interv Radiol (Higashimatsuyama) 2020; 5(2): 32-42 6 Johnson BA et al.: JUrol 2019; 201(2): 251-8 7 Gervais DA et al.: AJR Am J Roentgenol 2005; 185(1): 64-71 8 Goldberg SN et al.: JVasc Interv Radiol 2001; 12(9): 1021-32 9 Lehmann KS et al.: J Hepatobiliary Pancreat Sci 2016; 23(8): 508-16 10 Kunkle DA et al.: Cancer 2008; 113(10): 2671-80 11 Atwell TD et al.: J Urol 2010; 184(4): 1291-5 12 Georgiades C et al.: Tech Vasc Interv Radiol 2013; 16(4): 230-8 13 Rodriguez R et al.: Cardiovasc Intervent Radiol 2011; 34(3): 573-8 14 Bertolotti L et al.: Diagnostics (Basel) 2023; 13(3): 388 15 Atwell TD et al.: J Vasc Interv Radiol 2012; 23(1): 48-54 16 Shannon BA et al.: J Urol 2008; 180(4): 1257-61; discussion 1261 17 Patel HD et al.: JUrol 2016; 195(5): 1340-7 18 Psutka SP et al.: Eur Urol 2013; 63(3): 486-92
Das könnte Sie auch interessieren:
Der Infektstein als therapeutische Herausforderung
Rund 10% aller Harnsteine sind sogenannte Infektsteine. Die therapeutische Herausforderung besteht im schnellen Steinwachstum, in der Rezidivneigung und einer Obstruktion der Harnwege. ...
Psychische und körperliche Auswirkungen verschobener elektiver Operationen
Pflege- und Personalmangel führten in Österreichs Urologie zu deutlichen Einschränkungen in der elektiven operativen Versorgung. Eine Studie der Medizinischen Universität Graz zeigt, ...
Perioperative Therapie mit Enfortumab Vedotin + Pembrolizumab bei Cisplatin-ungeeigneten Patienten mit MIBC
Die Phase-III-Studie KEYNOTE-905/EV-303 schließt eine entscheidende und seit Langem offene Versorgungslücke bei muskelinvasivem Blasenkarzinom: Für Cisplatin-ungeeignete Patient:innen ...