Wie lässt sich die Arzneimitteltherapiesicherheit für Patienten erhöhen?
Autorin:
Prof. Dr. Martina Hahn
Klinik für Psychiatrie, Psychosomatik und Psychotherapie
Goethe-Universität Frankfurt
Klinik für psychische Gesundheit
varisano Klinikum Frankfurt Höchst
E-Mail: martina.hahn@kgu.de
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Woran liegt es, dass Interaktionen nicht immer relevant sind, wenngleich dies in der Fachinformation so angegeben wird? Wie können wir dies besser abschätzen?
Keypoints
-
Die Pharmakokinetik eines Wirkstoffs ist von vielen Faktoren abhängig, darunter auch die Komedikation mit Inhibitoren oder Induktoren sowie die Pharmakogenetik des Patienten.
-
Durch Bestimmung des Genotyps und zusätzliche Messung der Wirkstoffkonzentration kann die Arzneimitteltherapiesicherheit des Patienten stark erhöht werden.
Arzneimittelinteraktionen können aufgrund von pharmakokinetischen und pharmakodynamischen Eigenschaften von Wirkstoffen auftreten. Sie können zu unerwünschten Arzneimittelereignissen führen und gefährden somit den Therapieerfolg, erhöhen Morbidität und Mortalität. Insbesondere bei Polypharmazie ist dies der Fall, da die Anzahl der möglichen Interaktionen exponentiell mit der Anzahl eingenommener Medikamente steigt. Pharmakokinetische Interaktionen entstehen bei der Gabe von Inhibitoren oder Induktoren (Tab. 1). Gerade in der Psychopharmakotherapie kommen sie häufig vor, da viele Psychopharmaka Inhibitoren oder Induktoren sind.1 Arzneimittelinteraktions-Datenbanken können dabei helfen, Interaktionen zu erkennen und wenn möglich zu vermeiden. Allerdings ergibt sich in der klinischen Beobachtung das Phänomen, dass selbst relevante Interaktionen nicht zwingend zu einem unerwünschten Ereignis führen. Zudem sind die Datenbanken unvollständig, was ein zusätzliches Risiko darstellt.2 Das tatsächliche Eintreten einer schweren unerwünschten Wirkung bleibt manchmal aus. Dies wiederum führt jedoch nicht selten zu Konflikten zwischen Apothekern, die auf theoretische Interaktionsrisiken hinweisen, und Ärzten, die eine andere klinische Beobachtung machen. Das führt zur «alert fatigue» – auf beiden Seiten. Der Apotheker «mag» nicht mehr anrufen – der Arzt «mag» die Hinweise des Apothekers nicht mehr hören.3 Dadurch steigt das Risiko, dass eine relevante Interaktion nicht beachtet wird und ein Patient tatsächlich zu Schaden kommt. Wie kann es erklärt werden, dass nicht alle Patienten Anzeichen für eine Interaktion zeigen, obwohl ausreichend Evidenz dafür vorliegt, dass es sich um eine durchaus relevante pharmakokinetische Interaktion handelt? Ein Erklärungsmodell ergibt sich durch das pharmakogenetische Profil des Patienten.
Arzneimittel-Gen-Interaktionen: Der Genotyp bestimmt die Abbaugeschwindigkeit
Pharmakogenetische Polymorphismen (d.h. Einzelbasenmutationen auf der DNA) können vor allem bei CYP2D6 und CYP2C19 auftreten und bestimmen die Geschwindigkeit des Abbaus von CYP2D6- und CYP2C19-Substraten. Man unterscheidet zwischen «normal» Metabolizern, «intermediate» Metabolizern, «poor» Metabolizern, «rapid» Metabolizern und «ultra-rapid» Metabolizern. Durch die Einzelbasen-Mutation (SNPs) entstehen entweder keine Enzyme, keine funktionstüchtigen Enzyme, Enzyme mit verminderter Substratspezifität, eine verminderte Anzahl an Enzymen oder eine normale Anzahl von Enzymen. Durch Duplikation eines Gens auf der DNA kann eine stark erhöhte Anzahl von Enzymen gebildet werden. Dies findet z.B. bei «ultra rapid» Metabolizern von CYP2D6 statt.4 Genetische Testungen können klären, welcher Metabolisierungstyp der Patient ist. Befunde liegen meist innerhalb von zwei Wochen (je nach Anbieter) vor. Leitlinien wie die von der niederländischen Dutch Pharmakogenetic Working Group (DPWG) liefern klinische Empfehlungen für Antidepressiva (und viele weitere Wirkstoffgruppen) in Abhängigkeit vom Genotyp.5 Zum Beispiel werden in den Leitlinien Dosisanpassungen oder die Auswahl alternativer Antidepressiva empfohlen. Auch andere Konsortien haben entsprechende Leitlinien erstellt, darunter das Clinical Pharmacogenetic Implementation Consortium (CPIC) und das Canadian Pharmacogenomics Network for Drug Safety (CPNDS) sowie das französische Netzwerk Réseau national de pharmacogénétique (RNPGx). Unberücksichtigt bleiben bei den Leitlinienempfehlungen jedoch die möglichen pharmakokinetischen Interaktionen beim Patienten.
Arzneimittel-Arzneimittel-Gen-Interaktionen: Eine Interaktion hat nur bei einem bestimmten Genotyp einen Einfluss auf die Abbaugeschwindigkeit
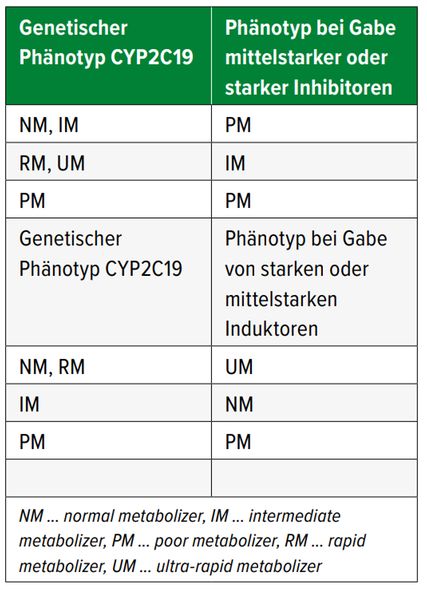
Arzneimittelinteraktionen können zu einer sogenannten Phänokonversion des Genotyps führen – der «gemessene Genotyp» wird durch die Interaktion verändert, man spricht von Arzneimittel-Arzneimittel-Gen-Interaktionen.6 Dieser Effekt ist bei Psychopharmaka, aber auch Somatika vielfach beschrieben worden.7–12
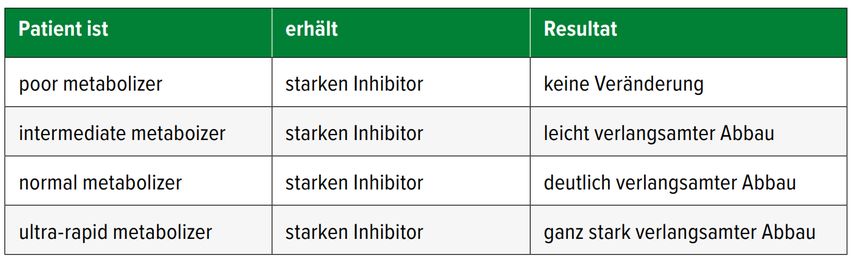
Dazu ein Beispiel: Ein Patient ist «normal metabolizer» für CYP2D6. Er erhält Metoprolol (ein CYP2D6-Substrat) und Bupropion (ein starker Inhibitor für CYP2D6) wird neu verordnet. Diese Arzneimittel-Arzneimittel-Interaktion führt in diesem Fall dazu, dass Metoprolol, obwohl der Patient «normal metabolizer» für CYP2D6 ist, nun nicht mehr abgebaut werden kann, der Wirkstoff akkumuliert. Es ist eine Phänokonversion von «normal» zu «poor metabolizer» aufgetreten. Wäre der Patient hingegen «poor metabolizer» für CYP2D6, würde sich durch die Gabe des Bupropions nichts ändern, es kommt nicht zu einer Phänokonversion (Tab. 1). Für CYP2C19 tritt dies analog auf, wie in Tabelle 2 dargestellt.
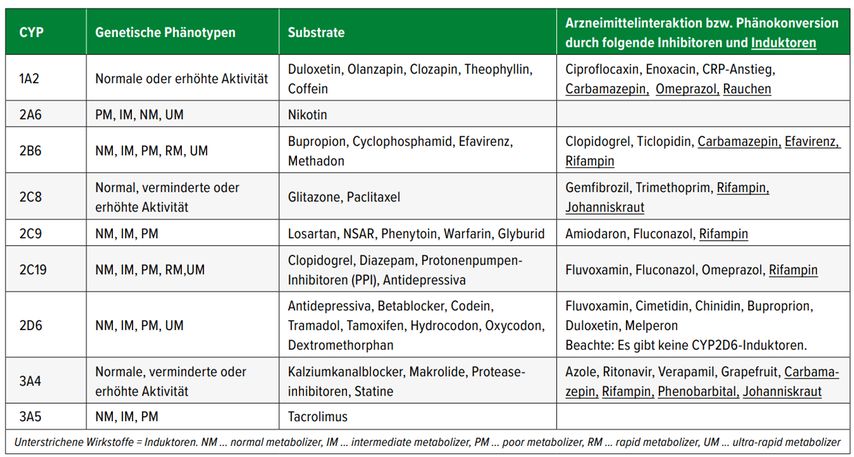
Die Kenntnis der Komedikation und somit der pharmakokinetischen Interaktionen ist daher vor der Umsetzung der Leitlinien-Empfehlungen der DWPG oder anderer Konsortien notwendig. Wichtige Inhibitoren und Induktoren für die unterschiedlichen CYP-Enzyme sind in Tabelle 3 dargestellt.
Schaut man in die Trizyklika-Leitlinie des CPIC, so fällt auf, dass hier sogar mehrere CYP-Enzyme in der Empfehlung für einen Wirkstoff berücksichtigt werden, es entsteht eine Kreuztabelle.13 Da oft mehrere Nebenwege für den Abbau zur Verfügung stehen, sind die Genotypen dieser Abbauwege auch noch zu berücksichtigen, da Arzneimittel-Gen-Gen-Interaktionen auftreten können.
Tab. 3: Beispiele für bekannte Metabolisierungstypen, Substrate, Induktoren und Inhibitoren der unterschiedlichen CYP-Enzyme
Arzneimittel-Gen-Gen-Interaktion: Der Nebenabbauweg wird relevant
Meist wird ein Arzneimittel über mehrere Abbauwege metabolisiert. Man unterscheidet zwischen Hauptweg und Nebenweg. Eine genaue Übersicht über die Haupt- und Nebenwege der Psychopharmaka finden sich in der AGNP-Leitlinie 2017.14 So wird Venlafaxin z.B. hauptsächlich durch CYP2D6 und im Nebenweg über CYP2D19 und CYP3A4 abgebaut. Der genetische Phänotyp der CYP-Enzyme verändert das Gleichgewicht der unterschiedlichen Metaboliten, die über den Haupt- oder die Nebenwege gebildet werden. Nehmen wir an, ein Patient ist «poor metabolizer» für CYP2D6 und erhält Venlafaxin. Wie stark Venlafaxin akkumuliert, hängt nun vor allem vom Genotyp der CYP-Enzyme des Nebenweges ab. Venlafaxin wird also bei z.B. «poor metabolizern» für CYP2D6 und «poor metabolizern» für CYP2C19 nur noch im geringen Masse über CYP3A4 verstoffwechselt werden können. So kann in diesem Beispiel kaum umgewandelt werden und der Metabolit-zu-Muttersubstanz-Quotient wäre <1. Die AGNP-Leitlinie 2011 enthielt Quotienten aus Muttersubstanz und Metaboliten, um indirekt den Genotyp abschätzen zu können.15 Ob der Quotient durch Interaktion, Nierenfunktionsstörung oder den Genotyp verändert wurde, lässt sich daran jedoch nicht ablesen. Das Verhältnis von Muttersubstanz zu Metabolit lässt also streng genommen nur Rückschlüsse auf den Phänotyp und nicht den Genotyp zu. Die Bildung anderer, sonst in kaum nennenswerter Konzentration auftretender Metaboliten kann zu einem veränderten Nebenwirkungsprofil führen.16 Beispiel Amitriptylin: Kreuztabelle der CPIC für Trizyklika, in der für CYP2D6 und CYP2D19 eine entsprechende Dosisempfehlung für jede mögliche Konstellation hinterlegt ist. Weitere Beispiele sind Statine und Thiopurine, bei denen es auch Kreuztabellen in den entsprechenden Leitlinien gibt, in denen die Genotypen von zwei am Abbau beteiligten Enzymen also wichtig für die Wirksamkeit und Verträglichkeit des Wirkstoffes sind.17,18 Für jede Konstellation verschiedener Phänotypen gibt die Leitlinie eine konkrete Dosierungsempfehlung bzw. eine Empfehlung zum Ausweichen auf ein anderes Arzneimittel.
Aufgrund der Komplexität empfehlen die Leitlinien das Hinzuziehen von klinischen Pharmazeuten, sobald der Genotypisierungsbefund vom «normal metabolizer» abweicht. Gerade bei der Genotypisierung erweist sich das Hinzuziehen von klinischen Pharmazeuten als wertvoll.19,20
Therapeutisches Drug-Monitoring – das Messen der Serumkonzentration des Wirkstoffs erfasst auch andere Einflussfaktoren
Durch Messung der Wirkstoffkonzentration im Serum oder Plasma kann die Arzneimitteltherapiesicherheit erhöht werden. Die AGNP-Leitlinie definiert therapeutische Bereiche für alle Psychopharmaka, an denen man sich zur Therapiesteuerung orientieren kann,14 da nicht nur die Genetik, sondern auch Entzündungen, Leber- und Nierenfunktionsstörungen, Alter, Geschlecht, Inflammation, Resorptionsstörungen etc. die Wirkstoffkonzentration beeinflussen können. Die Blutentnahme sollte dabei frühestens nach 5 Halbwertszeiten des Wirkstoffs nach Ansetzen oder Dosisänderungen erfolgen (im Steady State) und jeweils unter Talspiegelbedingungen, d.h. unmittelbar vor Gabe der nächsten Dosis. In der klinischen Praxis entstehen hier Fehler, die zu Fehlinterpretationen der Befunde führen können. Bei einer Untersuchung von 479 in der Klinik erhobenen TDM-Befunden lagen bei 4,5% (n=16) der im Verlauf gemessenen Serumkonzentrationen keine Talspiegelbedingungen, bei 17,6% (n=63) keine Steady-State-Bedingungen der Arzneistoffe vor.21 Durch das therapeutische Drug-Monitoring kann die Therapiesicherheit des Patienten – bei korrekter Durchführung – nochmals erhöht werden, da auch weitere und veränderliche Faktoren (z.B. ein akuter Harnwegsinfekt, der zu CYP1A2-Inhibition führt) abgebildet werden können. Leider können jedoch nicht alle Metaboliten gemessen werden, sodass die Kombination aus genetischem Profil vor Ansetzen des Medikamentes inklusive entsprechender Wirkstoffauswahl und zusätzlich TDM nach Eindosierung die höchste Sicherheit für den Patienten bietet.
Literatur:
1 Hefner G et al.: Prevalence and sort of pharmacokinetic drug–drug interactions in hospitalized psychiatric patients. J Neural Transm. 2020; 127: 1185-98 2 Hahn M et al.: Validierung von Interaktionsdatenbanken. Der Nervenarzt 2017; 89(3): 319-26 3 Baumann JP et al.: Psychiatrische Patienten fragen ihren Arzt und Apotheker – wie kann die Versorgung optimiert werden? Psychopharmakotherapie 2020; 27: 270-7 4 Hahn M et al.: The influence of pharmacogenetics on the clinical relevance of pharmacokinetic drug–drug interactions: drug–gene, drug–gene–gene and drug–drug–gene interactions. Pharmaceuticals 2021; 14(5): 487 5 Brouwer JMJL et al.: Dutch Pharmacogenetics Working Group (DPWG) guideline for the gene-drug interaction between CYP2C19 and CYP2D6 and SSRIs. Eur J Hum Genet 2021 Nov 16 6 Storelli F et al.: Impact of CYP2D6 functional allelic variations on phenoconversion and drug-drug interactions. Clin Pharmacol Ther 2018 Jul; 104(1): 148-57 7 Monte AA et al.: CYP2D6 genotype phenotype discordance due to drug-drug interaction. Clin Pharmacol Ther 2018; 104(5): 933-9 doi: 10.1002/cpt.1135 8 Bahar MA et al.: Impact of drug-gene-interaction, drug-drug-interaction, and drug-drug-gene-interaction on (es)citalopram therapy: The PharmLines Initiative. J Pers Med. 2020; 10(4): 256 9 Turner RM et al.: Multimorbidity, polypharmacy, and drug-drug-gene interactions following a non-ST elevation acute coronary syndrome: analysis of a multicentre observational study. BMC Med 2020; 18(1): 367 10 Verbeurgt P et al.: How common are drug and gene interactions? Prevalence in a sample of 1143 patients with CYP2C9, CYP2C19 and CYP2D6 genotyping. Pharmacogenomics 2014; 15(5): 655-5 11 Shah RR et al.: Addressing phenoconversion: the Achilles‘ heel of personalized medicine. Br J Clin Pharmacol. 2015; 79(2): 222-40 12 Klieber M et al.: CYP2C19 phenoconversion by routinely prescribed proton pump inhibitors omeprazole and esomeprazole: Clinical implications for personalized medicines. J. Pharmacol Exp. Ther. 2015, 354, 426-30 13 Hicks JK et al.: Clinical pharmacogenetics implementation consortium guideline (CPIC) for CYP2D6 and CYP2C19 genotypes and dosing of tricyclic antidepressants: 2016 update. Clin Pharmacol Ther. 2017; 102(1):37-44 14 Hiemke C et al.: Consensus Guidelines for therapeutic drug monitoring in neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51(1-02): 9-62. doi: 10.1055/s-0043-116492. Epub 2017 Sep 14. Erratum in: Pharmacopsychiatry. 2018; 51(1-02): e1 15 Hiemke C et al.: AGNP consensus guidelines for therapeutic drug monitoring in psychiatry: update 2011. Pharmacopsychiatry 2011; 44(6): 195-235 16 Steimer W et al.: Amitriptyline or not, that is the question: Pharmacogenetic testing of CYP2D6 and CYP2C19 identifies patients with low or high risk for side effects in amitriptyline therapy. Clin Chem 2005; 51(2): 376-85 17 Relling MV et al.: Clinical Pharmacogenetics Implementation Consortium Guideline for Thiopurine dosing based on TPMT and NUDT 15 genotypes: 2018 Update. Clin. Pharmacol Ther. 2019; 105: 1095-105 18 DeGorter MK et al.: Clinical and pharmacogenetic predictors of circulating atorvastatin and rosuvastatin concentrations in routine clinical care. Circ Cardiovasc Genet 2013; 6: 400-8 19 Battig VAD et al.: Pharmacogenetic testing in depressed patients and interdisciplinary exchange between a pharmacist and psychiatrists results in reduced hospitalization times. Pharmacopsychiatry 2020; 53: 185-9 20 Hahn M et al.: A new approach to pharmaceutical care: experiences with the »Eichberger” Model in a psychiatric clinic in Germany. Drug Ther Perspect 2012; 28(9): 24-6 21 Bünger M et al.: Therapeutisches Drug-Monitoring in der klinischen Praxis. Psychopharmakotherapie 2018; 25(3): 148-54
Das könnte Sie auch interessieren:
Therapeutisches Drug-Monitoring (TDM) in der Neuropsychopharmakologie: von der Theorie zur klinischen Routine
Therapeutisches Drug-Monitoring (TDM) verbindet angewandte Pharmakokinetik mit der klinischen Praxis und stellt damit ein wertvolles Instrument der Präzisionsmedizin dar. Absorption, ...
Blut-Hirn-Schranke im Fokus: neue Evidenz für ihre Durchlässigkeit bei Schizophrenie-Spektrum-Störungen
Die Blut-Hirn-Schranke (BHS) steht zunehmend im Zentrum der Forschung zu Schizophrenie-Spektrum-Störungen („schizophrenia spectrum disorders“, SSD).Eine aktuelle Studie der LMU München ...
Ketamin-augmentierte Psychotherapie
Das schnell wirksame Antidepressivum (S-)Ketamin wird bei therapieresistenten Patient:innen effektiv eingesetzt. Als zentrale Komponente eines biphasischen Wirkmechanismus wird für ...