Das Darmmikrobiom bei Anorexia nervosa
Autoren:
Dr. rer. nat. Stefanie Trinh
Lara Keller
Beate Herpertz-Dahlmann
Jochen Seitz
Institut für Neuroanatomie
Universitätsklinikum RWTH Aachen
Korrespondierende Autorin:
Dr. rer. nat. Stefanie Trinh
E-Mail: ntrinh@ukaachen.de
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die im Darm ansässigen Mikroben beeinflussen wesentlich, wie viel Energie aus der Nahrung gewonnen wird, und tragen somit zur Körpergewichtsregulierung bei. Es wurde gezeigt, dass Patient*innen mit Übergewicht ein verändertes Darmmikrobiom aufweisen, das effizienter Energie zu gewinnen scheint. Des Weiteren lieferten Stuhltransplantationen von übergewichtigen Patient*innen in keimfreie Mäuse Hinweise auf einen kausalen Zusammenhang mit der Gewichtsregulierung. Aktuelle Studien zeigen ebenfalls Veränderungen des Mikrobioms bei Anorexia nervosa.
Keypoints
-
Mehrere Studien zeigen eine Dysbiose der Darmmikrobiota bei Patientinnen mit Anorexia nervosa, sodass das Vorkommen bestimmter Bakterienstämme im Vergleich zu Kontrollprobandinnen signifikant verändert ist.
-
Obwohl die Mikrobiomforschung bei Essstörungen wie Anorexia nervosa von grossem Interesse ist, liegen bisher keine evidenzbasierten Ergebnisse für die klinische Praxis vor.
-
Der Einfluss der momentan für Anorexie nervosa üblichen Ernährungstherapie auf das Darmmikrobiom sollte dringend systematisch erforscht werden.
-
Nahrungsinterventionen, beispielsweise durch Präbiotika, Probiotika oder Omega-3-Fettsäuren, könnten sinnvolle Ergänzungen für die multimodale Therapie der Anorexia nervosa darstellen.
Anorexia nervosa
Anorexia nervosa (AN) ist eine Essstörung, die mit einer Lebenszeitprävalenz von 1–4 % bei 12- bis 18-jährigen Mädchen in Europa eine der häufigsten chronischen Erkrankungen in der Adoleszenz darstellt.2 Während in den letzten Jahren das Alter der Ersterkrankung sank,3 steigen die Zahlen der Krankenhausaufenthalte in Deutschland und Grossbritannien an.5 Die Erkrankung ist vornehmlich durch eine mangelnde Nahrungsaufnahme, die zu extremem Untergewicht führt, eine Gewichtsphobie und eine Körperschemastörung charakterisiert. Das Mortalitätsrisiko der AN stellt mit 5,9% das höchste aller psychiatrischen Erkrankungen dar, wobei ungefähr 20% der Patientinnen, die an dieser Krankheit sterben, einen Suizid begehen.6,7 Aktuelle Behandlungsansätze zielen auf eine Gewichtsrehabilitation ab. Ergänzende Psychotherapie sowie Pharmakotherapie dienen der Behandlung von häufigen psychischen Komorbiditäten wie Depressionen oder Angststörungen oder starvationsbedingten somatischen Begleiterscheinungen wie endokrinen Dysfunktionen und Osteoporose.2 Zum jetzigen Zeitpunkt sind die ursächlichen und aufrechterhaltenden Faktoren der Erkrankung nur unzureichend bekannt, sodass weniger als die Hälfte der Patientinnen vollständig genest und das Risiko für eine Chronifizierung steigt.8, 9 Immer mehr Studien weisen darauf hin, dass eine anhaltende Starvation im Zusammenhang mit AN zu deutlichen Veränderungen des Darmmikrobioms führt.10–13 Daher erscheint die Erforschung des Darmmikrobioms sowie der Interaktion mit dem Gehirn sinnvoll, um die der AN zugrunde liegende Pathophysiologie weiter zu untersuchen.
Das Mikrobiom
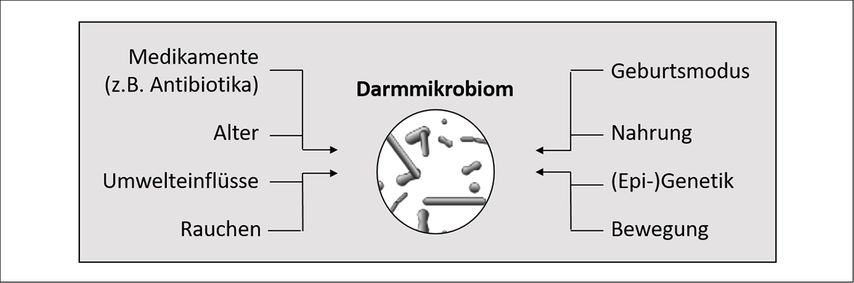
Im menschlichen Gastrointestinaltrakt sind eine Vielzahl von Mikroorganismen angesiedelt, die bei einem erwachsenen Menschen mindestens der Anzahl an eukaryotischen Zellen im Körper entsprechen.14 Obwohl zu diesen Mikroorganismen auch Pilze, Viren, Archaeen und Eukaryoten zählen, machen Bakterien mit einer geschätzten Masse von 1–2kg den überwiegenden Anteil der Mikrobiota aus. Jeder Mensch beherbergt eine individuelle Kombination aus ungefähr 500 von über 2000 verschiedenen Bakterienarten, die als einzigartiger «mikrobieller Fingerabdruck» angesehen werden kann.15, 16 Die mikrobielle Besiedelung beginnt ab dem Tag der Geburt und ist ungefähr ab dem 6. Lebensjahr ausgereift.14 Zahlreiche Faktoren können die Ansiedelung der Mikrobiota beeinflussen. Siehe hierzu Abbildung 1. Einer der relevantesten Einflussfaktoren im Zusammenhang mit Essstörungen ist die aufgenommene Nahrung, von deren nicht absorbierten Bestandteilen sich die Darmbakterien ernähren. Eine veränderte Diät führt zu kurzfristigen Veränderungen im Vorkommen einzelner Bakterienarten, da diese sich entsprechend den vorhandenen Nährstoffen effizienter oder weniger effizient vermehren können. Sowohl die Menge als auch die Zusammensetzung der Nahrung (beispielsweise vegetarische Nahrung) führen zu messbaren Unterschieden binnen weniger Tage.17
Abb. 1: Faktoren, die Einfluss nehmen auf die Entwicklung und Zusammensetzung des individuellen Darmmikrobioms (adaptiert nach Trinh S et al. 2021)1
Zur Analyse des Mikrobioms werden fäkale Proben von Proband*innen einerseits auf die Anzahl der vorhandenen Bakterienarten und andererseits auf ihre Zusammensetzung untersucht. Hierzu wird standardmässig eine sogenannte 16S-rRNA-Gen-Amplikon-Sequenzierung angewandt. Durch den Abgleich konservierter und hypervariabler Regionen im Mikrobengenom mit vorhandenen Sequenzbibliotheken werden die einzelnen Bakteriengattungen identifiziert.18, 19 Zwei häufig verwendete Parameter in der Mikrobiomforschung sind die α- und die β-Diversität. Die α-Diversität beschreibt die Anzahl unterschiedlicher Arten innerhalb einer Probe, während die β-Diversität die Unterschiedlichkeit in der Zusammensetzung zwischen verschiedenen Proben darstellt.
Die Bedeutung des Mikrobiomsbei Anorexia nervosa
In einer Reihe von Studien wurde das Darmmikrobiom in Stuhlproben von Patientinnen mit AN untersucht. Allerdings ergeben sich heterogene Studienergebnisse, die beispielsweise auf Unterschiede in der Ernährung, der geografischen Lage oder in der Methodik der Analyse zurückzuführen sind.4, 20
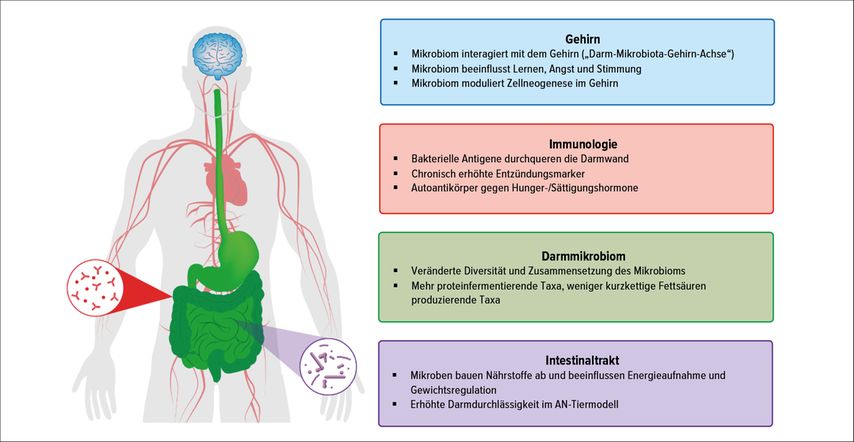
Vier Studien beobachteten eine signifikant reduzierte α-Diversität bei Patientinnen mit AN im Vergleich zu Kontrollprobandinnen.10, 12, 21, 22 Zusätzlich fanden zwei weitere Studien eine ähnliche, jedoch weniger deutliche Veränderung.11, 23 Eine Abnahme der α-Diversität wurde in zahlreichen Krankheitsbildern festgestellt und wird generell als nachteilig bewertet, da eine geringere Anzahl an Mikroorganismen weniger flexibel ist. Nach kurzfristiger Gewichtsrehabilitation wurde teilweise ein Anstieg der α-Diversität bei Patientinnen mit AN beobachtet, jedoch keine gänzliche Normalisierung.10, 11, 13 Somit ist zu vermuten, dass die Veränderung des Darmmikrobioms im Zusammenhang mit AN kein reines Epiphänomen der Gewichtsabnahme darstellt. Bezogen auf die β-Diversität wurden ebenfalls deutliche Unterschiede in der mikrobiellen Zusammensetzung zwischen Patientinnen mit AN und Kontrollen gezeigt.11,24 Die genannten Studien identifizierten oftmals einzelne Bakterienspezies, die in einer veränderten relativen Häufigkeit vorkommen. Jedoch sind die Funktionen der einzelnen Spezies häufig unbekannt, sodass es schwierig ist, kausale Rückschlüsse zu ziehen. Abbildung 2 fasst einige potenzielle Einflussebenen des Darmmikrobioms bei AN zusammen.
Eine geringe Anzahl an Studien, die das Darmmikrobiom von Nagern in einem AN-Tiermodell (aktivitätsbasierte Anorexie) untersuchte, zeigte ebenfalls signifikante Veränderungen in der α- und β-Diversität bei starvierten Tieren im Vergleich zur Kontrollgruppe.25–27 2019 wurden erstmalig Stuhlproben von Patientinnen mit AN in keimfreie Mäuse transplantiert, um den kausalen Zusammenhang zwischen der Darmmikrobiota und der Gewichtsregulierung, dem Fressverhalten und ängstlichen und zwanghaften Verhaltensweisen der Tiere zu untersuchen.28 Tatsächlich zeigten die Nachkommen der keimfreien Mäuse eine geringere Futteraufnahme und Futtereffizienz (Gewichtszunahme pro Futtermenge). Zusätzlich wurde verstärktes zwanghaftes und angstähnliches Verhalten bei den Mäusen beobachtet.
Bisher sind Daten von zwei Case-Reports zu Stuhltransplantationen bei je einer Patientin mit AN verfügbar. Es wurde Stuhl von einer verwandten und gesunden Person verwendet. Bei einer Patientin zeigte sich eine Gewichtszunahme von 6,3kg, während bei der anderen Patientin zwar keine Gewichtsveränderung, jedoch eine Normalisierung der Mikrobiomzusammensetzung zu beobachten war.29, 30 Neben Stuhltransplantationen stellen Supplementierungen mit Pro- und Präbiotika oder Nahrungsergänzungsmitteln wie ω-3-Fettsäuren Möglichkeiten dar, das Darmmikrobiom positiv zu beeinflussen. Probiotika sind lebensfähige Bakterien, die einen positiven Einfluss auf den Organismus haben, wenn sie in ausreichender Menge verabreicht werden, während Präbiotika unverdauliche Ballaststoffe sind, die von Bakterien metabolisiert werden und somit Wachstum und Aktivität der Mikrobiota fördern.31
Neben den therapeutischen Implikationen sollte die prognostische und diagnostische Bedeutung des Darmmikrobioms nicht vernachlässigt werden. So könnte das veränderte Auftreten einzelner Bakterienspezies als Biomarker oder State- und Trait-Marker für Krankheiten genutzt werden und gegebenenfalls eine individualisierte Behandlung frühzeitig ermöglichen.32
Literatur:
1 Trinh S et al.: Das Darmmikrobiom und seine klinischen Implikationen im Kontext der Anorexia nervosa. Zeitschrift für Kinder- und Jugendpsychiatrie und Psychotherapie 2021 2 Herpertz-Dahlmann B: Adolescent eating disorders: update on definitions, symptomatology, epidemiology, and comorbidity. Child and adolescent psychiatric clinics of North America 2015; 24: 177-96 3 Steinhausen HC, Jensen CM: Time trends in lifetime incidence rates of first-time diagnosed anorexia nervosa and bulimia nervosa across 16 years in a Danish nationwide psychiatric registry study. The International Journal of Eating Disorders 2015; 48: 845-50 4 Seitz J et al.: The Microbiome and Eating Disorders. The Psychiatric Clinics of North America 2019; 42: 93-103 5 Holland J et al.: Trends in hospital admission rates for anorexia nervosa in Oxford (1968-2011) and England (1990-2011): database studies. Journal of the Royal Society of Medicine 2016; 109: 59-66 6 Arcelus J et al.: Mortality rates in patients with anorexia nervosa and other eating disorders. A meta-analysis of 36 studies. Archives of General Psychiatry 2011; 68: 724-31 7 Bulik CM et al.: The genetics of anorexia nervosa. Annual Review of Nutrition 2007; 27: 263-75 8 Steinhausen HC: The outcome of anorexia nervosa in the 20th century. The American Journal of Psychiatry 2002; 159: 1284-93 9 Treasure J et al.: Has the time come for a staging model to map the course of eating disorders from high risk to severe enduring illness? An examination of the evidence. Early Interv Psychiatry 2015; 9: 173-84 10 Kleiman SC et al.: The intestinal microbiota in acute anorexia nervosa and during renourishment: relationship to depression, anxiety, and eating disorder psychopathology. Psychosomatic Medicine 2015; 77: 969-81 11 Mack I et al.: Weight gain in anorexia nervosa does not ameliorate the faecal microbiota, branched chain fatty acid profiles, and gastrointestinal complaints. Scientific Reports 2016; 6: 26752 12 Morkl S et al.: Gut microbiota and body composition in anorexia nervosa inpatients in comparison to athletes, overweight, obese, and normal weight controls. The International Journal of Eating Disorders 2017; 50: 1421-31 13 Schulz N et al.: Gut microbiota alteration in adolescent anorexia nervosa does not normalize with short-term weight restoration. The International Journal of Eating Disorders 2021; 54: 969-80 14 Sender R, Fuchs S: Revised estimates for the number of human and bacteria cells in the body. PLoS Biol 2016; 14: e1002533 15 Almeida A et al.: A new genomic blueprint of the human gut microbiota. Nature 2019; 568: 499-504 16 Clavel T et al.: Microbiome sequencing: challenges and opportunities for molecular medicine. Expert Review of Molecular Diagnostics 2016; 16: 795-805 17 David LA et al.: Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014; 505: 559-63 18 Lagkouvardos I et al.: Rhea: a transparent and modular R pipeline for microbial profiling based on 16S rRNA gene amplicons. Peer J 2017; 5: e2836 19 Lagkouvardos I et al.: IMNGS: a comprehensive open resource of processed 16S rRNA microbial profiles for ecology and diversity studies. Scientific Reports 2016; 6: 33721 20 Ruusunen A et al.: The gut microbiome in anorexia nervosa: relevance for nutritional rehabilitation. Psychopharmacology 2019; 236: 1545-58 21 Hanachi M et al.: Altered host-gut microbes symbiosis in severely malnourished anorexia nervosa (AN) patients undergoing enteral nutrition: An explicative factor of functional intestinal disorders? Clinical Nutrition 2019; 38: 2304-10 22 Monteleone AM et al.: Multi-omics data integration in anorexia nervosa patients before and after weight regain: a microbiome-metabolomics investigation. Clinical Nutrition 2021; 40: 1137-1146 23 Borgo F et al.: Microbiota in anorexia nervosa: The triangle between bacterial species, metabolites and psychological tests. PLoS One 2017; 12: e0179739 24 Kleiman SC et al.: Daily changes in composition and diversity of the intestinal microbiota in patients with anorexia nervosa: a series of three cases. European Eating Disorders Review 2017; 25: 423-7 25 Breton J et al.: Gut microbiota alteration in a mouse model of anorexia nervosa. Clinical Nutrition 2021; 40: 181-189 26 Queipo-Ortuno MI et al.: Gut microbiota composition in male rat models under different nutritional status and physical activity and its association with serum leptin and ghrelin levels. PloS One 2013; 8: e65465 27 Trinh S et al.: Gut microbiota and brain alterations in a translational anorexia nervosa rat model. Journal of Psychiatric Research 2021; 133: 156-65 28 Hata T et al.: The Gut microbiome derived from anorexia nervosa patients impairs weight gain and behavioral performance in female mice. Endocrinology 2019; 160: 2441-52 29 de Clercq NC et al.: Weight gain after fecal microbiota transplantation in a patient with recurrent underweight following clinical recovery from anorexia nervosa. Psychotherapy and Psychosomatics 2019; 88: 58-60 30 Prochazkova P et al.: Microbiota, microbial metabolites, and barrier function in a patient with anorexia nervosa after fecal microbiota transplantation. Microorganisms 2019; 7: 338 31 Illiano P et al.: The mutual interplay of gut microbiota, diet and human disease. FEBS J 2020; 287: 833-55 32 Marcos-Zambrano LJ et al.: Applications of machine learning in human microbiome studies: a review on feature selection, biomarker identification, disease prediction and treatment. Frontiers in Microbiology 2021; 12: 634511
Das könnte Sie auch interessieren:
Therapeutisches Drug-Monitoring (TDM) in der Neuropsychopharmakologie: von der Theorie zur klinischen Routine
Therapeutisches Drug-Monitoring (TDM) verbindet angewandte Pharmakokinetik mit der klinischen Praxis und stellt damit ein wertvolles Instrument der Präzisionsmedizin dar. Absorption, ...
Blut-Hirn-Schranke im Fokus: neue Evidenz für ihre Durchlässigkeit bei Schizophrenie-Spektrum-Störungen
Die Blut-Hirn-Schranke (BHS) steht zunehmend im Zentrum der Forschung zu Schizophrenie-Spektrum-Störungen („schizophrenia spectrum disorders“, SSD).Eine aktuelle Studie der LMU München ...
Ketamin-augmentierte Psychotherapie
Das schnell wirksame Antidepressivum (S-)Ketamin wird bei therapieresistenten Patient:innen effektiv eingesetzt. Als zentrale Komponente eines biphasischen Wirkmechanismus wird für ...