Zulassung als Monotherapie in der Erstlinie bei NSCLC im Stadium IV
Bericht: Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit Atezolizumab (Tecentriq®) wird das Therapiearmamentarium für die Erstlinientherapie des lokal fortgeschrittenen/metastasierten nicht kleinzelligen Bronchuskarzinoms (NSCLC) im Stadium IV maßgeblich erweitert. Basierend auf den Ergebnissen der Phase-III-Studie IMpower110 wurde dieser Immuncheckpoint-Inhibitor Anfang Mai von der EMA nun auch als Monotherapie in dieser Indikation zugelassen.
Atezolizumab ist ein humanisierter monoklonaler IgG-Antikörper, der gegen PD(„programmed death“)-L1 gerichtet ist und als Immuntherapie beim kleinzelligen Lungenkarzinom (SCLC) sowie beim nichtkleinzelligen Lungenkarzinom (NSCLC) als auch beim hepatozellulären Karzinom, Urothel- und Mammakarzinom zum Einsatz kommt. Bislang war Atezolizumab in der Erstlinientherapie des NSCLC nur in Kombination mit Chemotherapie-Regimen zugelassenbzw. als Monotherapie in der Zweitlinie nach vorangegangener Chemotherapie. In letzterem Fall sollten Patienten mit dem Nachweis von ALK- oder EGFR-Mutationen zudem noch entsprechende zielgerichtete Therapien erhalten haben.1 Für die Erstlinie war bis vor Kurzem nur Pembrolizumab – und dies nur bei Nachweis einer PD-L1-Expression von ≥50% – als immuntherapeutische Monotherapie zugelassen.2
IMpower110
In der offenen, randomisierten Phase-III-Studie IMpower1103 wurde Atezolizumab vs. eine platinbasierte CTx bei chemotherapienaiven Patienten mit lokal fortgeschrittenem/metastasiertem NSCLC und einer positiven PD-L1-Expression (TC1/2/3 oder IC1/2/3) untersucht und die signifikante Überlegenheit von Atezolizumab im primären Endpunkt, dem Gesamtüberleben (OS), nachgewiesen, was zur Zulassung von Atezolizumab in dieser Indikation geführt hat.1, 2
Studiendesign
Die Patienten (n=572) wurden im 1:1-Design zum Erhalt von Atezolizumab (1200mg intravenös) bzw. einer platinbasierten CTx (vier oder sechs Zyklen) randomisiert. Bei der Randomisierung wurde eine Stratifizierung nach
-
ECOG(„Eastern Cooperative Oncology Group“)-Performancestatus (0 vs. 1),
-
Geschlecht,
-
Histologie (Plattenepithel- vs. Nichtplattenepithelkarzinom) und
-
PD-L1-Status vorgenommen.
Das OS wurde in der ITT(Intention-to-treat)-Population bei Patienten mit Wildtyp (554 Patienten, ohne jene mit einer EGFR- oder ALK-Mutation; ITT-WT) hierarchisch gemäß der Höhe der PD-L1-Expression untersucht. Das Schlüsselkollektiv für die OS-Analyse bildete die ITT-WT-Population mit einer hohen PD-L1-Expression (TC3/IC3). Das OS sowie das progressionsfreie Überleben (PFS) wurden prospektiv nach Subgruppen gemäß der PD-L1-Expression und der Tumor-Mutationslast im Blut bestimmt. Die Sicherheit wurde bei allen Patienten unabhängig von PD-L1-Expression und Mutationen untersucht.3
Signifikante OS-Verlängerung unter Atezolizumab
Die 554 Patienten der ITT-WT-Population wurden gleichmäßig randomisiert (277 in jedem Arm). In diesem Kollektiv wurde bei 107 Patienten (36,8%) in der Atezolizumab- und bei 98 Patienten (35,4%) in der CTx-Gruppe eine hohe PD-L1-Expression gemessen, welche sich definierte als ≥50% PD-L1 auf Tumorzellen (TC3) oder ≥10% PD-L1 auf tumorinfiltrierenden Immunzellen (IC3). Insgesamt wurde bei 166 Patienten unter Atezolizumab (59,9%) und bei 162 Patienten unter CTx (58,8%) eine hohe oder intermediäre PD-L1-Expression verzeichnet.
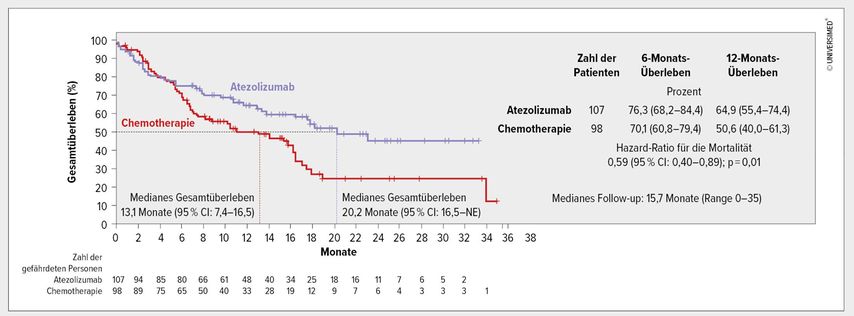
Zum Zeitpunkt der Interimsanalyse zum OS (Data Cut-off: 10. September 2018) betrug das mediane Follow-up in der Gruppe des oben beschriebenen Schlüsselkollektivs (ITT-WT, PD-L1 hoch) 15,7 Monate. Das mediane OS verlängerte sich mit 20,2 vs. 13,1 Monateunter der CTx signifikant um 7,1 Monate (HR: 0,59; p=0,01) (Abb. 1). Abgesehen von Niemalsrauchern, wurde diese Überlegenheit für alle untersuchten Subgruppen bestätigt.
Abb. 1: Medianes Gesamtüberleben im Kollektiv der Patienten mit EGFR- und ALK-Wildtyp, die eine hohe PD-L1-Expression aufwiesen (modifiziert nach Herbst RS et al. 2020)3
Im Kollektiv der Patienten mit einem EGFR- und ALK-Wildtyp, die eine hohe oder intermediäre PD-L1-Expression aufwiesen, betrug das mediane OS unter Atezolizumab vs. CTx 18,2 vs. 14,9 Monate (HR: 0,72; p=0,04). Der OS-Vorteil war statistisch nicht signifikant, daher wurden keine weiteren Analysen durchgeführt.
Ergebnisse zum PFS und zur Response
Bis zum Data Cut-off hatten 146 von 205 Patienten (71,2%) des Schlüsselkollektivs (ITT-WT, PD-L1 hoch) eine Progression entwickelt oder waren verstorben. Das PFS betrug im Atezolizumab- vs. den CTx-Arm 8,1 5,0 Monate (stratifizierte HR für Krankheitsprogression oder den Tod: 0,63). Gemäß der Beurteilung durch die Prüfärzte wurden bei 38,3% unter Atezolizumab und bei 28,6% der Patienten unter der CTx eine Response bestätigt. Zum Zeitpunkt des Data Cut-off war die bestätigte Response mit 68,3% im Atezolizumab- vs. 35,7% im CTx-Arm anhaltend und damit beinahe doppelt so hoch.
Sicherheitsdaten
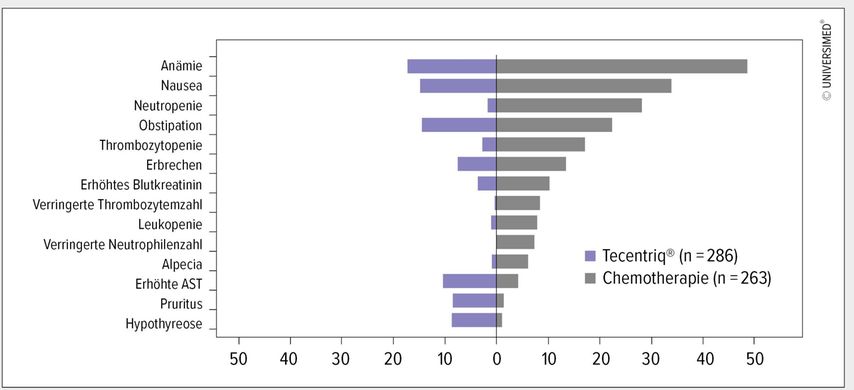
Die mediane Therapiedauer belief sich bei Atezolizumab auf 5,3 Monate und lag bei der CTx je nach Substanz zwischen 2,1 und 3,5 Monaten. Nebenwirkungen (AE) traten unter Atezolizumab bei 90,2% und unter CTx bei 94,7% der Patienten auf.3 Die Rate an AE der Grade 3 und 4 war mit 52,2% vs. 30,1% unter der CTx höher als unter Atezolizumab, wobei zu den häufigsten im CTx-Arm (≥5% als im Prüfarm) Anämie, Neutropenie und Thrombozytopenie zählten.3 Auch aus aktualisierten Daten zum AE-Profil (Data Cut-off: 20. Februar 2020) geht hervor, dass unter Atezolizumab um 68% weniger behandlungsassoziierte AE der Grade 3 und 4 verzeichnet wurden als unter der CTx. Eine Analyse zu behandlungsassoziierten AE, AE von besonderem Interesse, die den Einsatz von Kortikosteroiden erforderten, und AE, die zum Therapieabbruch geführt haben, hat ergeben, dass die Raten in allen untersuchten Parametern im CTx-Arm höher waren als unter Atezolizumab.4
Insgesamt war das unter Atezolizumab verzeichnete AE-Profil mit dem aus anderen Studien zu Atezolizumab als Monotherapie bekannten konsistent, sodass dem Immuncheckpoint-Inhibitor ein bekanntes, gut kontrollierbares Sicherheitsprofil attestiert wird (Abb. 2).3,4 Zudem war die Pneumonitisrate aller Grade mit 3,8% unter Atezolizumab und mit 0,7% bei Grad 3/4 als sehr niedrig einzustufen.3
Abb. 2: Nebenwirkungen aller Grade: Tecentriq® vs. Chemotherapie (modifiziert nach Herbst RS et al. 2020)3
Aktualisierte Ergebnisse bestätigen Benefit
Bei der World Conference on Lung Cancer 2020 wurden aktualisierte Ergebnisse zum OS präsentiert, die die signifikante Überlegenheit von Atezolizumab vs. die CTx bestätigen: Diesen zufolge belief sich das unter Atezolizumab verzeichnete OS weiter auf 20,7 und das unter der CTx verzeichnete OS auf 14,7 Monate (HR: 0,76). Dass das in der CTx-Gruppe nachgewiesene OS gegenüber der initialen Analyse um 1,6 Monate länger und die HR höher ist, kann dadurch erklärt werden, dass im Kontrollarm ca. 35% der Patienten eine immunonkologische Folgetherapie erhalten haben und die Patienten länger nachbeobachtet worden sind. Aus den aktualisierten Ergebnissen zur Response geht hervor, dass unter Atezolizumab eine Ansprechdauer (DOR) für >3 Jahre nachgewiesen wurde: Die mediane DOR lag bei 38,9 Monaten. Die objektive Responserate (ORR) betrug im Atezolizumab- gegenüber dem Kontrollarm 40,2% vs. 28,6%.4
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch Roche Austria GmbH
M-AT-00001325
FKI
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Meldung von Nebenwirkungen an: Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, 1200 Wien, Österreich, Fax: + 43 (0) 50 555 36207, Website:
http://www.basg.gv.at/
und an Roche Austria GmbH,
austria.drug_safety@roche.com
.
Tecentriq® 1.200 mg Konzentrat zur Herstellung einer Infusionslösung. Tecentriq® 840 mg Konzentrat zur Herstellung einer Infusionslösung. Qualitative und quantitative Zusammensetzung: Eine Durchstechflasche mit 20 ml Konzentrat enthält 1.200 mg Atezolizumab*. Nach Verdünnung (siehe Abschnitt 6.6 der Fachinformation) sollte die finale Konzentration der verdünnten Lösung zwischen 3,2 und 16,8 mg/ml liegen. Eine Durchstechflasche mit 14 ml Konzentrat enthält 840 mg Atezolizumab*. Nach Verdünnung (siehe Abschnitt 6.6 der Fachinformation) sollte die finale Konzentration der verdünnten Lösung zwischen 3,2 und 16,8 mg/ml liegen. *Atezolizumab ist ein im Fc-Teil modifizierter, humanisierter monoklonaler IgG1 anti-PD-L1(programmed death ligand 1)-Antikörper, der in Ovarialzellen des chinesischen Hamsters mittels rekombinanter DNA-Technologie hergestellt wird. Liste der sonstigen Bestandteile: L-Histidin, Essigsäure 99 %, Sucrose, Polysorbat 20, Wasser für Injektionszwecke. Anwendungsgebiete: Tecentriq 840 mg: Urothelkarzinom: Tecentriq als Monotherapie wird angewendet bei erwachsenen Patienten zur Behandlung des lokal fortgeschrittenen oder metastasierten Urothelkarzinoms (UC) • nach vorheriger platinhaltiger Chemotherapie oder • die für eine Behandlung mit Cisplatin als ungeeignet angesehen werden, und deren Tumoren eine PD-L1-Expression ≥ 5 % aufweisen (siehe Abschnitt 5.1). Nicht-kleinzelliges Lungenkarzinom: Tecentriq als Monotherapie wird angewendet bei erwachsenen Patienten zur Erstlinienbehandlung des metastasierten nicht-kleinzelligen Lungenkarzinoms (non-small cell lung cancer, NSCLC), deren Tumoren eine PD-L1-Expression ≥ 50 % der Tumorzellen (tumour cells, TC) oder ≥ 10 % bei tumorinfiltrierenden Immunzellen (immune cells, IC) aufweisen und die keine EGFR(epidermal growth factor receptor, epidermaler Wachstumsfaktorrezeptor)-Mutationen oder ein ALK(Anaplastische-Lymphomkinase)-positives NSCLC haben (siehe Abschnitt 5.1). Tecentriq als Monotherapie wird angewendet bei erwachsenen Patienten zur Behandlung des lokal fortgeschrittenen oder metastasierten NSCLC nach vorheriger Chemotherapie. Patienten mit EGFR-Mutationen oder ALK-positivem NSCLC sollten vor der Therapie mit Tecentriq zudem auch bereits entsprechende zielgerichtete Therapien erhalten haben (siehe Abschnitt 5.1). Metastasiertes triple-negatives Mammakarzinom: Tecentriq wird angewendet in Kombination mit nab-Paclitaxel bei erwachsenen Patienten zur Behandlung des nicht resezierbaren lokal fortgeschrittenen oder metastasierten triple-negativen Mammakarzinoms (triple-negative breast cancer, TNBC), deren Tumoren eine PD-L1-Expression ≥ 1 % aufweisen und die keine vorherige Chemotherapie zur Behandlung der metastasierten Erkrankung erhalten haben. Tecentriq 1200 mg: Urothelkarzinom: Tecentriq als Monotherapie wird angewendet bei erwachsenen Patienten zur Behandlung des lokal fortgeschrittenen oder metastasierten Urothelkarzinoms (UC) • nach vorheriger platinhaltiger Chemotherapie oder • die für eine Behandlung mit Cisplatin als ungeeignet angesehen werden, und deren Tumoren eine PD-L1-Expression ≥ 5 % aufweisen (siehe Abschnitt 5.1). Nicht-kleinzelliges Lungenkarzinom: Tecentriq wird angewendet in Kombination mit Bevacizumab, Paclitaxel und Carboplatin bei erwachsenen Patienten zur Erstlinienbehandlung des metastasierten nicht-kleinzelligen Lungenkarzinoms (non-small cell lung cancer, NSCLC) mit nicht-plattenepithelialer Histologie. Bei Patienten mit EGFR(epidermal growth factor receptor, epidermaler Wachstumsfaktorrezeptor)-Mutationen oder ALK(Anaplastische-Lymphomkinase)-positivem NSCLC ist Tecentriq in Kombination mit Bevacizumab, Paclitaxel und Carboplatin nur nach Versagen der entsprechenden zielgerichteten Therapien anzuwenden (siehe Abschnitt 5.1). Tecentriq wird angewendet in Kombination mit nab-Paclitaxel und Carboplatin zur Erstlinienbehandlung des metastasierten NSCLC mit nicht-plattenepithelialer Histologie bei erwachsenen Patienten, die keine EGFR-Mutationen und kein ALK-positives NSCLC haben (siehe Abschnitt 5.1). Tecentriq als Monotherapie wird angewendet bei erwachsenen Patienten zur Erstlinienbehandlung des metastasierten NSCLC, deren Tumoren eine PD-L1-Expression ≥ 50 % der Tumorzellen (tumour cells, TC) oder ≥ 10 % bei tumorinfiltrierenden Immunzellen (immune cells, IC) aufweisen und die keine EGFR-Mutationen oder ein ALK-positives NSCLC haben (siehe Abschnitt 5.1). Tecentriq als Monotherapie wird angewendet bei erwachsenen Patienten zur Behandlung des lokal fortgeschrittenen oder metastasierten NSCLC nach vorheriger Chemotherapie. Patienten mit EGFR-Mutationen oder ALK-positivem NSCLC sollten vor der Therapie mit Tecentriq zudem auch bereits entsprechende zielgerichtete Therapien erhalten haben (siehe Abschnitt 5.1). Kleinzelliges Lungenkarzinom:Tecentriq wird angewendet in Kombination mit Carboplatin und Etoposid bei erwachsenen Patienten zur Erstlinienbehandlung des kleinzelligen Lungenkarzinoms im fortgeschrittenen Stadium (Extensive Stage Small Cell Lung Cancer, ES-SCLC) (siehe Abschnitt 5.1). Hepatozelluläres Karzinom: Tecentriq wird angewendet in Kombination mit Bevacizumab bei erwachsenen Patienten zur Behandlung des fortgeschrittenen oder nicht resezierbaren hepatozellulären Karzinoms (hepatocellular carcinoma, HCC), die keine vorherige systemische Behandlung erhalten haben (siehe Abschnitt 5.1). Gegenanzeigen: Überempfindlichkeit gegen Atezolizumab oder einen der sonstigen Bestandteile. Inhaber der Zulassung: Roche Registration GmbH, Emil-Barell-Straße 1, 79639 Grenzach-Wyhlen, Deutschland. Verschreibungspflicht/Apothekenpflicht: rezept- und apothekenpflichtig, wiederholte Abgabe verboten Pharmakotherapeutische Gruppe: Antineoplastische Arzneimittel, monoklonale Antikörper, ATC-Code: L01XC32. Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen sowie Informationen zu Schwangerschaft und Stillzeit und zu Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen. April 2021
Literatur:
1 Fachinformation Atezolizumab, Stand: Mai2021 2 https://www.ema.europa.eu/en ; zuletzt aufgerufen am 31.5.2021 3 Herbst RS et al.: N Engl J Med 2020; 383: 1328-39 4Herbst RS et al.: WCLC 2020; featured posters session – FP13; Abstract No. FP13.03