Einfluss der Dünndarmfehlbesiedelung bei Patient:innen mit CED
Autorinnen:
Dr. med.
Agnieszka Kafel
Prof. Dr. med.
Elisabeth Schnoy
Dr. med.
Julia Wanzl
III. Medizinische Klinik
Universitätsklinikum Augsburg
Korrespondierende Autorin:
Prof. Dr. med.
Elisabeth Schnoy
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Abdominelle Beschwerden sind ein häufiges Problem, mit dem man in Klinik und Praxis konfrontiert wird. Die Differenzialdiagnosen hierzu können vielfältig sein. Eine bakterielle Fehlbesiedelung kann hinter diesen Symptomen liegen. Sie ist eine Erkrankungsentität, an die im Alltag oft nicht gedacht wird und die auch bei chronischen Erkrankungen wie den chronisch-entzündlichen Darmerkrankungen (CED) häufig auftreten kann. Dies zu erkennen und zu behandeln, ist klinisch häufig eine Herausforderung und soll nachfolgend im Detail beschrieben werden.
Keypoints
-
Bei abdominellen Beschwerden sollte auch an eine bakterielle Fehlbesiedelung (SIBO) gedacht werden.
-
Symptome einer SIBO und einer CED können sich ähneln.
-
Eine einfache Testmethode für eine SIBO ist ein Atemtest.
-
Gemäss den existierenden Leitlinien ist Rifaximin das Antibiotikum der Wahl bei SIBO.
Hinter allgemeinen und unspezifischen Symptomen wie zum Beispiel Übelkeit, Meteorismus, abdominellen Schmerzen oder Unregelmässigkeiten und Veränderung der Stuhlkonsistenz können sich mehrere Krankheitsentitäten verstecken, allem voran Erkrankungen aus dem gastroenterologischen Formenkreis. Um die zugrunde liegenden Ursachen zu detektieren, erfolgt üblicherweise eine Stufendiagnostik, beginnend mit einer klinischen Untersuchung, Labordiagnostik, Ultraschalluntersuchung des Abdomens oder, wenn diese nicht richtungsweisend sind, mit einer weiteren endoskopischen Abklärung. Die oben beschriebenen Symptome begleiten oft jahrelang auch Patient:innen mit chronisch-entzündlichen Darmerkrankungen (CED). Zu dieser Erkrankungsgruppe gehören Morbus Crohn (MC), Colitis ulcerosa (CU) und Colitis indeterminata. Alle Formen verlaufen meistens schubweise mit Phasen der Remission und aktiver Erkrankung. Die Krankheitsaktivität kann auf verschiedenen Wegen kontrolliert werden, u.a. durch gezielte Anamnese, Laboranalyse, Stuhluntersuchung (Calprotectin), endoskopische, histologische oder bildgebende Diagnostik wie Ultraschall oder eine Kernspintomografie.
Im klinischen Alltag kann jedoch Beschwerdepersistenz mit obigen Symptomen vorliegen, ohne dass ein Schub einer CED vorliegt. In solchen Fällen sollte differenzialdiagnostisch an eine Dünndarmfehlbesiedlung («small intestine bacterial overgrowth», SIBO) gedacht werden.
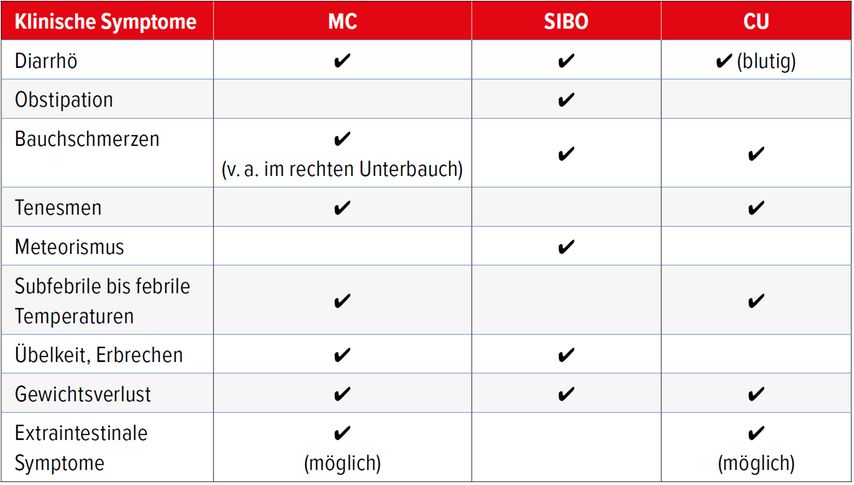
Bei Vorliegen einer SIBO beklagen Patient:innen ähnliche Symptome, wie sie CED-Betroffene mit aktiver Erkrankung angeben (Tab.1), sodass eine klinische Unterscheidung zwischen beiden Krankheitsentitäten häufig schwerfällt.
Tab. 1: Klinische Symptome bei Morbus Crohn (MC), bakterieller Dünndarmfehlbesiedlung (SIBO) und Colitis ulcerosa (CU)
Bei einer bakteriellen Fehlbesiedelung kommt es zu einer pathologischen Kolonisation des Dünndarms durch verschiedene, v.a. gramnegative Kohlenhydrat-fermentierende Bakterien. Dies führt zur Entstehung von unmässigen Mengen an Gas und der Akkumulation von verschiedenen Abbauprodukten, was die für die Patient:innen unangenehmen klinischen Symptome wie zum Beispiel Schmerzen und ausgeprägten Meteorismus verursachen kann.1 Dieser pathologische Zustand kann unter anderem durch Obstipationen verursacht werden, bei denen es zur Veränderung der Darmflora kommt. Eine hohe Prävalenz von SIBO bei Betroffenen mit Reizdarm vom Obstipations-Typ wurde bereits gezeigt.2 Allgemein kann eine SIBO durch eine Maldigestion oder eine Malabsorption verursacht werden, bedingt durch eine veränderte Anatomie (z.B. Dys- oder fehlende Funktion der Ileozökalklappe bzw. auch nach Ileozökalresektion) oder Motilität, eine gestörte Produktion von Magensäure, eine Passagestörung, z.B. postoperativ, Leber- oder Nierenerkrankungen oder eine Pankreasinsuffizienz.3,4 Bei Patient:innen mit MC kann die Entstehung einer Fehlbesiedlung durch eine chronische Inflammation im Bereich des Dünndarms begünstigt werden.2 In dieser Gruppe wird über eine Prävalenz der SIBO zwischen 25% und 88% berichtet, v.a. bei Patient:innen mit einem komplizierten Krankheitsverlauf.1 In der Normalbevölkerung liegt die Prävalenz der SIBO zwischen 2,5% und 20% und steigt mit dem Alter sowie bei Multimorbidität.5
SIBO – richtig diagnostizieren
Als Standard in der Diagnostik einer SIBO wird eine invasive Diagnostik mittels Entnahme von Flüssigkeit (ca. 3ml) aus dem Duodenum/Dünndarm und anschliessender mikrobiologischer Kultur empfohlen.1,3 Beim Nachweis von >103CFU/ml Bakterien kann die Diagnose einer SIBO gestellt werden.1 In der Realität wird jedoch dank der Non-Invasivität, der leichteren Durchführbarkeit sowie der niedrigeren Kosten eine Diagnostik mittels eines Glukose- oder Lactulose-Atemtests empfohlen.1,3 Es darf aber nicht vergessen werden, dass die Sensitivität (Glukose-Atemtest: 52–63%; Lactulose-Atemtest: 31–68%) und die Spezifität (Glucose-Atemtest: 82–86%; Lactulose-Atemtest: 44–100%) zur genaueren Beurteilung der Krankheitsausprägung eher undulierend sind.1,3
Vor der Durchführung des Atemtests werden 75g Glukose in 200ml Wasser gelöst. Die Lösung sollte von den Patient:innen ausgetrunken werden. Anschliessend erfolgt über 3 Stunden alle 15 Minuten eine Messung der Wasserstoffkonzentration in der Ausatemluft. Im Falle des Lactulose-Tests werden 15ml Lösung (inkl. 10g Substrat) getrunken und die Messungen werden über 4 Stunden durchgeführt.6 In der ausgeatmeten Luft wird die Konzentration an Wasserstoff (H2), Methan (CH4) und/oder Kohlenstoffdioxid (CO2) gemessen. Bei Vorliegen einer SIBO wird eine erhöhte Konzentration von H2/CH4 im Vergleich zu gesunden Menschen gemessen. Das Ergebnis wird als pathologisch gewertet, wenn der H2-Spiegel nach 90 Minuten um 20ppm über den Ausgangswert ansteigt und/oder der Methanspiegel während 2 Stunden nach Untersuchungsbeginn um ≥10ppm ansteigt.1
Ein zweites Kriterium zur Diagnosestellung der SIBO ist der sogenannte «double peak». Hier kommt es nach einem ersten Anstieg nach circa 90min zunächst zu einem Abfall um mehr als 5ppm in den zwei darauffolgenden Proben. Anschliessend steigen die Probenwerte erneut an und man spricht dann vom «double peak». Dieser zweite Peak spiegelt die Fermentation im Dickdarm wider.
Entscheidend für ein gutes Testergebnis ist eine adäquate Vorbereitung im Vorfeld. Eine orale oder intravenöse Antibiotikatherapie sollte 4 Wochen vor der Testung beendet sein. Zudem sollte darauf geachtet werden, dass 2 Wochen vor der Untersuchung keine Probiotika, 1 Woche vorher keine Protonenpumpen-Inhibitoren (PPI) und 48 Stunden vorher keine Prokinetika wie zum Beispiel Metoclopramid eingenommen werden,5 da andernfalls die Ergebnisse verfälscht werden könnten. Die Untersuchung wird nüchtern (8–12 Stunden ohne Kostaufnahme) durchgeführt. Nikotin- oder Alkoholkonsum und sportliche Aktivität sollten ebenfalls vermieden werden.1,5
SIBO – richtig behandeln
Zur Therapie der SIBO existiert keine eigene deutschsprachige oder europäische Leitlinie. Die S3-Leitlinie der AWMF (Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V.) zu intestinalen Motilitätsstörungen greift jedoch immer wieder das Thema der bakteriellen Fehlbesiedelung auf, gibt hierzu aber lediglich eine singuläre Therapieempfehlung.7 Ausführlichere Hilfestellung zur Therapie gibt das American College of Gastroenterology, das dem Thema SIBO eine eigene Leitlinie gewidmet hat.8 Vorab sollte entsprechend den Clinical Practice Guidelines von Quigley et al. festgehalten werden, dass, wann immer möglich, die Therapie der SIBO bei der zugrunde liegenden Pathologie begonnen werden muss, wie z.B. der Beseitigung von Strikturen des Dünndarms oder von koloenterischen Fisteln.9,10 Meist ist dies jedoch nicht möglich, weshalb dann auf weitere Therapieoptionen zurückgegriffen werden kann.
Antibiotika
Die antibiotische Therapie ist die Grundsäule in der Behandlung der SIBO, wenngleich es sich viel eher um eine empirische denn um eine evidenzbasierte Therapie handelt.8 Ziel der antibiotischen Therapie ist nicht in erster Linie die Eradikation der gesamten bakteriellen Flora, sondern vielmehr die Modifikation des Mikrobioms, die in der Folge zu einer Beschwerdebesserung führen soll .9,10
Rifaximin
Unter den verschiedenen Antibiotika ist Rifaximin das am meisten in Studien untersuchte Antibiotikum zur Therapie der SIBO. Rifaximin ist ein Breitbandantibiotikum aus der Gruppe der Rifamycine und wird enteral nur zu einem geringen Anteil resorbiert. Durch die sehr lokale, auf den Darm beschränkte Wirkung kommt es einerseits nur selten zu systemischen Nebenwirkungen und andererseits auch nur in geringem Masse zu einer Resistenzentwicklung.11,12 Die Studien zur Wirkung von Rifaximin sind sehr heterogen, was sich nicht nur in den verwendeten Dosierungen widerspiegelt, die von 600–1600mg/d variierten, sondern auch in der Anwendungsdauer, die zwischen 5 und 28 Tagen lag.13 Die gepoolte Eradikationsrate lag in der Metaanalyse von Gatta et al. bei 70,8%.13 Gemäss den existierenden Leitlinien ist Rifaximin das Antibiotikum der Wahl bei SIBO.7,8
Systemische Antibiotika
Die Datenlage zu systemisch wirkenden Antibiotika wie Amoxicillin/Clavulansäure, Ciprofloxacin, Doxyzyklin, Metronidazol oder auch Norfloxacin, Tetrazyklin und Trimethoprim-Sulfamethoxazol ist spärlich und bezieht sich lediglich auf klinische Studien mit kleiner Fallzahl.8 Auch für diese Antibiotika wird jedoch ein Ansprechen der SIBO postuliert.8
Antibiotische Behandlung bei Rückfall
Lauritano et al. konnten an einer kleinen Kohorte von 80 Patient:innen zeigen, dass die Rezidivrate der SIBO bereits nach kurzer Zeit hoch ist und im Verlauf weiter ansteigt. So wurden bereits nach 3 Monaten 12,6% der Patient:innen erneut positiv auf SIBO getestet, nach 6 Monaten 27,5% und nach 9 Monaten 43,7%. Die Testung erfolgte mittels Glukose-Atemtest.13
Eine einheitliche Empfehlung bezüglich Zweitlinientherapie bzw. Behandlung des Rezidivs gibt es nicht. Auch hier gibt es lediglich empirische Empfehlungen und Expertenmeinungen, die einen Wechsel des Antibiotikaregimes auf ein alternatives Antibiotikum vorsehen.8,9,14
Diätetische Massnahmen
Die Empfehlungen betreffend diätetische Therapie basieren insbesondere auf den Empfehlungen bei Reizdarmsyndrom, das häufig mit einer SIBO vergesellschaftet ist. Eine Beschwerdelinderung kann hier die Low-FODMAP-Diät bringen.15 Hierbei wird die Zufuhr an Nahrungsmitteln reduziert, die schnell fermentierbar sind, im Dünndarm kaum resorbiert werden und osmotisch aktiv sind. FODMAP steht dabei als Akronym für schnell fermentierbare Oligo-, Di- und Monosaccharide sowie Polyole. Konkret bedeutet dies den Verzicht z.B. auf Äpfel, Birnen, Trockenfrüchte, Zwiebeln, Knoblauch, Weizen, Roggen, Milch, Joghurt oder Süssstoffe wie Sorbit, Mannit und Xylit.
Wielgosz-Grochowska et al. kommen nach der Analyse von 12 Studien zu dem Schluss, dass eine Low-FODMAP-Diät bei Patient:innen mit gastrointestinalen Symptomen zwar die Beschwerden bessern kann, eine Langzeitdiät jedoch zu negativen Effekten i.S. eines Anstiegs an saccharolytischen Bacteroides, Porphyromonadaceae und nichtsaccharolytischen Bilophilia führen kann.15 Diesen Schluss ziehen auch Reddel et al., die den Einfluss von Low-FODMAP und anderen Diäten auf das Darmmikrobiom untersuchten.16
Insgesamt ist die Datenlage zu diätetischen Massnahmen, wie sie beim Reizdarmsyndrom empfohlen werden, bei der Behandlung der SIBO inkonklusiv und gemäss der aktuell vorhandenen Literatur eher hypothetisch.15 Diese Einschätzung wird in ähnlicher Art auch vom American College of Gastroenterology und anderen Autor:innen geteilt.9,17,18
Probiotika
Bei der Evidenz zu den Probiotika bei SIBO verhält es sich äquivalent zu den diätetischen Massnahmen: Die Datenlage ist nur spärlich und es gibt keinen klaren Konsensus zur probiotischen Therapie bei SIBO.8,5 In einer Studie zur Behandlung der SIBO mit Bifidobacterium vs. Placebo zeigte sich in der Verumgruppe ein Erfolg bei 81% der Patient:innen vs. 25,4% in der Placebogruppe.5 Zudem wurde eine signifikante Verbesserung der klinischen Symptome in der Verumgruppe berichtet.5 Kleine Studien, wie die eben erwähnte, können zwar ein Hinweis auf die Wirkung von Probiotika sein, zum aktuellen Zeitpunkt fehlt es jedoch noch an suffizienter Evidenz hierfür.5,14 Ganz generell sollte beachtet werden, dass die Wirkung von Probiotika abhängig ist vom verabreichten probiotischen Stamm und diese daher entsprechend ihrer spezifischen Eigenschaften und der gewünschten Wirkung ausgesucht werden sollten.19
Prokinetika
Obwohl Prokinetika sehr häufig als eine Therapieoption bei SIBO erwähnt werden, lassen sich keine Daten zu Prokinetika bei SIBO finden. Da die SIBO jedoch mit Motilitätsstörungen assoziiert ist, wird von einem positiven Effekt entsprechender Medikamente ausgegangen.20
Eine Untersuchung, die die These der Wirksamkeit von Prokinetika bei SIBO unterstützen könnte, ist eine Studie von 2018, in der Betroffene in zwei Gruppen aufgeteilt wurden: Eine Gruppe erhielt PPI, eine zweite Gruppe erhielt PPI + Prokinetika. Bei beiden Gruppen wurden ein Glukose- und ein Lactulose-H2-Atemtest durchgeführt und es wurde die orozökale Transitzeit erhoben. In der Gruppe, die nur PPI erhielt, wurde deutlich öfter eine SIBO diagnostiziert als in der Gruppe mit PPI + Prokinetika. Zudem war die orozökale Transitzeit länger in der Gruppe der SIBO-positiven Patient:innen als in der Gruppe ohne SIBO.21
Für eine fundierte, evidenzbasierte Aussage über die Wirkung sind jedoch weitere Studien erforderlich.
Rückfall vermeiden
Wie oben ausgeführt, ist die Rückfallquote nach initial erfolgreicher Therapie hoch.13 Um das Rückfallrisiko besser abschätzen und ggf. minimieren zu können, ist es wichtig, die Umstände und Risikofaktoren zu kennen, die zu einem Rückfall führen können. Hierzu zählen beispielsweise eine beeinträchtigte Darmmotilität, anatomische Veränderungen wie Dünndarmtumoren, Dünndarmdivertikel oder veränderte postoperative Zustände («blind loop», Ileozökalresektion etc.), aber auch systemische Erkrankungen wie Diabetes mellitus oder systemische Sklerose. Medikamente wie PPI oder Opiate können das Risiko für eine SIBO bzw. einen Rückfall ebenfalls erhöhen.8,14 Patient:innen mit CED und hier insbesondere solche mit MC, haben häufig bereits von Haus aus ein erhöhtes Risiko für das Vorliegen einer SIBO aufgrund der Inflammation und der häufig bestehenden postoperativen Zustände bei Ileozökalresektion. Daher sollte insbesondere in diesen Fällen gerade bei persistierenden Beschwerden trotz Remission an das Vorliegen einer SIBO gedacht werden.
Literatur:
1 Roszkowska P et al.: Biomedicines 2024; 12: 1030 2 Wanzl J et al.: J Clin Med 2023; 12: 935 3 Maeda Y, Murakami T: Antibiotics 2023; 12: 263 4 Avelar Rodriguez D et al.: Front Pediatr 2019. 7: 363 5 Skrzydlo-Radomanska B, Cukrowska B: J Clin Med 2022; 11: 6017 6 Ghoshal UC Srivastava D: IWorld J Gastroenterol 2014; 20: 2482-91 7 Keller J et al.: Z Gastroenterol 2022; 60: 192-218 8 Pimentel M et al.: Am J Gastroenterol 2020; 115: 165-78 9 Quigley EMM et al.: Gastroenterol 2020; 15: 1526-32 10 Scarpignato C, Gatta L: Aliment Pharmacol Ther 2013; 38: 1409-10 11 Scarpignato C, Pelosini I: Chemother 2005; 51(Suppl 1): 36-66 12 Calanni F et al.: J Antibiot 2014; 67: 667-70 13 Gatta L, Scarpignato C: Aliment Pharmacol Ther 2017; 45: 604-16 14 Silva BCD et al.: Arq Gastroenterol 2025; 62: e24107 15 Wielgosz-Grochowska JP et al.: Nutrients 2022; 14: 3382 16 Reddel S et al.: Nutrients 2019; 11: 373 17 Velasco-Aburto S et al.: Nutrients 2025; 17: 1410 18 Souza C et al.: World J Clin Cases 2022; 10: 4713-6 19 Bubnov RV et al.: EPMA J 2018; 9: 205-23 20 Ghoshal UC et al.: Gut Liver 2017; 11: 196-208 21 Revaiah PC et al.: JGH Open 2018; 2: 47-53
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...