©
Getty Images/iStockphoto
Zytologie im neuen Licht der Molekularpathologie
Jatros
30
Min. Lesezeit
12.07.2018
Weiterempfehlen
<p class="article-intro">Die klassische Zytologie hat ihren Weg in die Zukunft gefunden. Zytomorphologie und molekularpathologische Methoden sind selbstverständliche Partner in einem diagnostischen Labor geworden. Zytologische Präparate liefern – alleine für sich oder zusätzlich zu Gewebeproben – Zellmaterial, das sowohl für die Tumortypisierung als auch für molekulare Analysen sehr gut geeignet ist. Die Zahl der prädiktiven und prognostisch relevanten Marker ist in den letzten Jahren explodiert; es ist damit zu rechnen, dass die Anzahl der therapeutisch nutzbaren genetischen Veränderungen und der genetisch determinierten Resistenzmechanismen weiter steigen wird.</p>
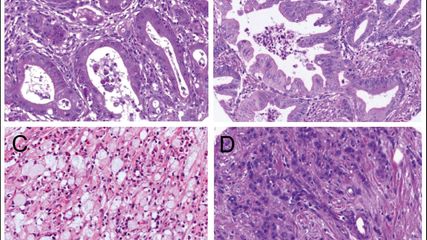
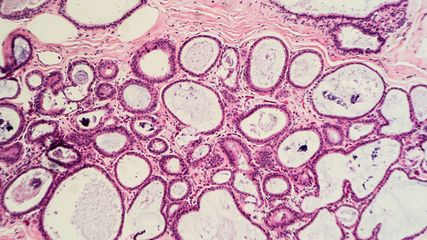
<p class="article-content"><div id="keypoints"> <h2>Keypoints</h2> <ul> <li>Zytologie und Histologie für prädiktive und prognostische Biomarkeranalysen gleich gut geeignet</li> <li>Paralleltestung statt sequenzieller Testung</li> <li>Zeitgewinn durch sorgfältiges Probenmanagement</li> <li>Möglichkeit der Reduktion von wiederholten diagnostischen Eingriffen wegen Mangel an Tumorzellen durch die Berücksichtigung von zytologischen Präparaten</li> </ul> </div> <p>Pathologen sind daher mehr denn je gefordert, sich den Herausforderungen der modernen Diagnostik zu stellen. Aus gleichbleibend kleinen Probenmengen sind neben der morphologischen Tumorklassifizierung immer mehr Biomarker zu analysieren. Die Tumordiagnostik und -typisierung sind der erste entscheidende Schritt im komplexen Ablauf der histo- wie auch zytopathologischen Diagnostik. Die Tumorsubtypisierung ist prädiktiv für die Auswahl der Biomarkeruntersuchungen.<sup>1</sup><br /> Die Erfolgsgeschichte der personalisierten Medizin bei verschiedenen Tumorentitäten wie dem Lungenkarzinom, dem malignen Melanom und anderen haben die Arbeitsweise der Pathologen grundlegend geändert. Zytologische Präparate unterschiedlichster Art haben sich als wichtige Quelle für einen Zugewinn an verfügbaren Tumorzellen für morphologische und molekulare Diagnostik erwiesen. Zytologische Präparate in Verbindung mit simultan gewonnenen Gewebeproben können darüber hinaus einen zeitlichen Vorteil in der Diagnostik bedeuten. Unter der Voraussetzung, dass zeitnah gewonnene histologische und zytologische Proben von demselben Pathologen beurteilt werden, können Biomarkeruntersuchungen priorisiert werden, indem von einer sequenziellen Diagnostik zu einer Paralleltestung gewechselt werden kann. Durch dieses geänderte Probenmanagement können unter Umständen zeitliche Verzögerungen für den Therapiebeginn verhindert werden.</p> <h2>Zytologische Präparate für Biomarkeranalysen in der Praxis</h2> <p>Als Untersuchungsmaterialien für molekulare Diagnostik eignen sich alle Arten von Ausstrich- und Abstrich- sowie Abklatschpräparaten, sowohl luftgetrocknet als auch alkoholfixiert. Auch bereits immunzytochemisch gefärbte Präparate sind geeignet für weitere Untersuchungen wie Fluoreszenz-in-situ-Hybridisierung (FISH) sowie DNA-Extraktion und Mutationsanalysen (Tab. 1). Ebenso geeignet sind Dünnschichtpräparate. Nicht formalinfixierte Präparate bieten den Vorteil, dass die DNAQualität nicht durch formalinbedingte Artefakte beeinträchtigt wird. Zytologische Ausstrichpräparate liefern intakte Zellkerne und sind nicht – wie in histologischen Präparaten – teilweise angeschnitten, was für die Beurteilung von FISH-Untersuchungen von Vorteil ist. In Zusammenhang damit soll darauf hingewiesen werden, dass zeitaufwendiges Ablösen von Deckgläsern in Xylol durch Einfrieren von Objektträgern stark verkürzt werden kann.<sup>2</sup> Voraussetzung sind jedoch standardisierte Protokolle für Immunhistochemie, und FISH explizit für zytologische Präparate.<br /> Zytologische Präparate sind zumindest sechs Monate nach ihrer Anfertigung für genetische Analysen geeignet, danach muss mit einer Beeinträchtigung der Epitope und der DNA gerechnet werden.<sup>2, 3</sup> Nach unterschiedlichen Erfahrungen dürfte die DNA von luftgetrockneten, May- Grünwald-Giemsa(MGG)-gefärbten Präparaten länger erhalten bleiben als die von alkoholfixierten, PAP-gefärbten Ausstrichpräparaten.<br /> Die Präparation von Zellblöcken als formalinfixiertes, paraffineingebettetes (FFPE) Material bietet hingegen eine hervorragende Möglichkeit, Protokolle, die für die Histologie entwickelt worden sind, an „zytologischem“ Material anzuwenden, verknüpft mit den Vor- und Nachteilen der Formalinfixierung. Zellblöcke können aus unterschiedlichsten Zellsuspensionen wie Körperflüssigkeiten, Punktaten, Bürstenoder Nadelauswaschungen sowie Dünnschichtpräparaten gewonnen werden.<sup>4</sup><br /> Zytologische Präparate sind im Gegensatz zu früheren Einschätzungen für Biomarkeruntersuchungen genauso gut geeignet wie histologische Präparate. In internationalen Richtlinien ist dieser Umstand auch explizit angeführt.<sup>5</sup><br /> Aus praktischen Überlegungen heraus bewährt es sich, beim Vorhandensein von reichlich Tumorzellmaterial sowohl in Biopsie und Zytologie, bevorzugt die Zytologiepräparate für molekularpathologische (NGS-)Untersuchungen zu verwenden, um das FFPE-Biopsiematerial für allfällige zukünftige Untersuchungen zu archivieren.<sup>3</sup></p> <h2>Methoden für Biomarkeranalysen</h2> <p>Immunzytochemische Untersuchungen und FISH-Untersuchungen können – unter der Voraussetzung, dass standardisierte Verfahren angewandt werden – für Biomarkeranalysen wie z.B. ALK- oder ROS1- Rearrangements zuverlässig eingesetzt werden. Durch Abkratzen von Tumorzellen von Objektträgern können Tumorzellen für molekulare Biomarkeranalysen wie Polymerase-Kettenreaktion (PCR) bzw. Next Generation Sequencing (NGS) gewonnen werden. Mikro- (Lasermikrodissektion) und Makrodissektionsverfahren können eingesetzt werden, um einen tiefen Tumorzellanteil eines Präparates zu verbessern und so die Materialmenge zu optimieren.<br /> Um die morphologischen Informationen eines Ausstrichpräparates zu archivieren bzw. zu dokumentieren, kann man die Möglichkeit in Betracht ziehen, Präparate vor einer etwaigen Weiterbearbeitung zu fotografieren oder einzuscannen.<br /> Aus dem DNA-Gehalt einer Tumorzelle von 7pg ergibt sich eine Tumorzellzahl von gewöhnlich >100 Tumorzellen für eine Analyse; die Zahl ist niedriger als bei Biopsien, was durch die fehlende formalinbedingte DNA-Fragmentierung und intakte Zellkerne im zytologischen Präparat zu erklären ist.<br /> Mittels Sequenzierverfahren erreicht man im Idealfall, dass die therapierelevanten genomischen Aberrationen einschließlich Amplifikationen und Genfusionen in einem Ansatz an einer einzigen Probe detektiert werden können. Das bedeutet, dass zusätzliche FISH-Untersuchungen wegfallen können. Das bedeutet außerdem, dass neu identifizierte, klinisch relevante Genveränderungen weitgehend kostenneutral in die Testung inkludiert werden können, ohne die Turnaround- Zeit zu verlängern.</p> <h2>Mutationsrate von zytologischen Präparaten</h2> <p>Wir konnten am Institut für Klinische Pathologie, so wie in verschiedenen Studien, beispielsweise bei <em>EGFR</em>-Mutationsanalysen eine nahezu idente Mutationsrate an zytologischen Untersuchungsmaterialien wie an Biopsiematerial zeigen.<sup>3</sup></p> <h2>Zytologie und die Grundsätze der molekularpathologischen Diagnostik</h2> <p>Die Beurteilung von zytologischen Präparaten sowie der Einsatz für Biomarkeranalysen verlangen analog zur histopathologischen Untersuchung die Expertise eines erfahrenen Pathologen, der neben der Beurteilung der Morphologie die Zahl der zur Verfügung stehenden Tumorzellen bestimmt und den Tumorzellanteil in Relation zu normalen Zellen einschätzt (Abb. 2). Grundsätzlich ist ein hoher Tumorzellanteil anzustreben, Methoden mit hoher Sensitivität sind verfügbar. Die Anwendung von Untersuchungsmethoden, die niedrigsensitiv sind und eventuell invasive und wiederholte diagnostische Eingriffe erfordern, ist nicht vertretbar.<sup>5</sup></p> <div id="fazit"> <h2>Fazit</h2> <p>Bei sequenziellem Vorgehen hinsichtlich Tumordiagnostik und -klassifikation sowie molekularpathologischer Tumorcharakterisierung reicht in vielen Fällen das Material von Gewebeproben nicht aus, um eine umfassende Diagnostik zu gewährleisten, unter Umständen ergibt sich daraus ein Anlass für wiederholte diagnostische Eingriffe. Zeitnah oder simultan gewonnene zytologische Präparate können diesen Mangel oft ausgleichen. Die Berücksichtigung von verfügbaren zytologischen Präparaten kann auch den Zeitaufwand einer sequenziellen Analytik deutlich reduzieren.<br /> Überlegtes Proben- und Methodenmanagement durch uns Pathologinnen und Pathologen bildet die Voraussetzung dafür, dass für Tumorpatientinnen und -patienten ohne Zeitverzögerung eine vollumfängliche Analytik umgesetzt werden kann.</p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2018_Jatros_Onko_1804_Weblinks_jatros_onko_1804_s50_tab1.jpg" alt="" width="2151" height="911" /></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2018_Jatros_Onko_1804_Weblinks_jatros_onko_1804_s51_abb1.jpg" alt="" width="1422" height="919" /></p> <p><img src="/custom/img/files/files_datafiles_data_Zeitungen_2018_Jatros_Onko_1804_Weblinks_jatros_onko_1804_s52_abb2.jpg" alt="" width="1417" height="820" /></p> </div></p>
<p class="article-footer">
<a class="literatur" data-toggle="collapse" href="#collapseLiteratur" aria-expanded="false" aria-controls="collapseLiteratur" >Literatur</a>
<div class="collapse" id="collapseLiteratur">
<p><strong>1</strong> Fischer AH et al.: Five top stories in cytopathology. Arch Pathol Lab Med 2013; 137(7): 894-906 <strong>2</strong> Heukamp LC, Bubendorf L: Zytologie als Material für die Molekularpathologie. Pathologe 2015; 36(6): 566-71 <strong>3</strong> Savic S et al.: Nichtkleinzellige Lungenkarzinome. Subklassifikation und prädiktive molekulare Markeruntersuchungen in der Zytologie. Pathologe 2012; 33(4): 301-7 <strong>4</strong> Jain D et al.: C ell blocks in cytopathology: a review of preparative methods, utility in diagnosis and role in ancillary studies. Cytopathology 2014; 25(6): 356-71 <strong>5</strong> Lindeman NI et al.: Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: guideline from the College of American Pathologists, the International Association for the Study of Lung Cancer, and the Association for Molecular Pathology. Arch Pathol Lab Med 2018; 142(3): 321</p>
</div>
</p>
Das könnte Sie auch interessieren:
Die Pathologie des Magenkarzinoms
Weltweit ist das Magenkarzinom der am fünfthäufigsten diagnostizierte maligne Tumor, mit einer verhältnismäßig hohen Sterblichkeit, bedingt vor allem durch das weit fortgeschrittene ...
Das Grading des Urothelkarzinoms
Das Grading des Urothelkarzinoms (UK) ist immer wieder ein Thema, das Pathologen und Urologen beschäftigt. Das Bestimmen eines Grades erlaubt die Differenzierung eines UK zu bewerten und ...
The impact of inherited mutations in oncohaematology
Acquired mutations detection by the use of next-generation sequencing (NGS) is largely used in oncohaematology. Germline mutations have also shown to play a major role in this context ...