Venen-Muskel-Interponate zur Nervenrekonstruktion
Autoren:
Dr. Johannes Heinzel 1,2,3
Mag. David Hercher 2,3
PD Dr. Jonas Kolbenschlag 1
1 Klinik für Hand-, Plastische, Rekonstruktive und Verbrennungschirurgie, BG Klinik Tübingen
2 Ludwig Boltzmann Institut für Experimentelle und Klinische Traumatologie, Wien
3 Austrian Cluster for Tissue Regeneration, Wien
Korrespondierender Autor:
Dr. Johannes Heinzel
E-Mail: hannes.heinzel@gmx.de
Der Goldstandard für die Rekonstruktion segmentaler Nervendefekte, das autologe Nerventransplantat (ANT), steht unter anderem aufgrund limitierter Verfügbarkeit und resultierender Hebemorbidität nicht immer zur Verfügung. Zahlreiche wissenschaftliche Unternehmungen zielen daher darauf ab, vergleichbare Alternativen zum ANT zu entwickeln. Eine solche Alternative stellen die sogenannten Venen-Muskel-Interponate (VMI) dar, die sich technisch einfach durch das Inserieren einiger Muskelfasern in eine autologe Vene herstellen lassen und klinisch bereits vielversprechende Ergebnisse nach der Rekonstruktion kurzstreckiger Defekte zeigten.
Keypoints
-
Während die klinischen Ergebnisse nach der Nervenrekonstruktion mittels Venen-Muskel-Interponats (VMI) vielversprechend sind, deuten präklinische Studien auf eine Unterlegenheit dieses Rekonstruktionsverfahrens hin.
-
Das Rattenmodell birgt für die translationale Forschung jedoch deutliche Limitationen, bedingt durch große Differenzen zwischen den Spezies bezüglich der Neurobiologie und aufgrund diverser methodologischer Hürden hinsichtlich der Erforschung artifizieller Nervenleitschienen.
-
Weitere, groß angelegte Studien, insbesondere hinsichtlich der Verwendbarkeit der VMI zur Rekonstruktion längerer Nervendefekte, sind nötig. Untersuchungen im Großtier (Schaf- oder Schweinemodell) scheinen empfehlenswert.
Hintergrund
Die Anfang der 1990er-Jahre von Brunelli entwickelten VMI1 wurden bereits in mehreren klinischen Arbeiten2–4 als vielversprechende Alternative zum autologen Nerventransplantat beschrieben. Zum einen lassen sich entsprechende Segmente autologer Venen und einige Muskelfasern ohne relevante Hebemorbidität fast in jeder Körperregion problemlos gewinnen, zum anderen können diese mit minimalem technischem Aufwand zu einer autologen Nervenleitschiene kombiniert werden.
Dazu wird das entnommene Venensegment über eine mikrochirurgische Pinzette oder einen Nadelhalter gestülpt, dann werden die entnommenen Muskelfasern in die Vene hineingezogen. Anschließend wird das VMI zwischen die Nervenstümpfe eingebracht und die Venenwand wird mit dem Epineurium vernäht. Hierbei sollte darauf geachtet werden, die Nervenstümpfe in das Lumen der Vene hineinzuziehen, um das Einsprossen aller Axone in das Interponat zu ermöglichen.
Die Vene dient den regenerierenden Nervenfasern hierbei als mechanische Barriere nach außen hin und verhindert Verwachsungen mit dem umliegenden Gewebe. Die inserierten Muskelfasern verhindern das Kollabieren der Vene und dienen zudem durch die Struktur des Endomysiums als natürliche Leitschiene für regenerierende Axone und einwandernde Schwann-Zellen.
Klinische Untersuchungen der Regeneration nach Rekonstruktion kurzstreckiger Nervendefekte mittels VMI lieferten vielversprechende Ergebnisse,5 jedoch zeigten einige in den letzten Jahren publizierte präklinische Studien6,7 unterlegene Resultate der VMI im Vergleich mit der autologen Nerventransplantation. Nach wie vor existiert bisher keine Arbeit, welche die Ergebnisse der präklinischen und klinischen Studien systematisch aufgearbeitet hat.
Von Interesse sind in diesem Kontext auch die möglichen Gründe für die beobachtete Diskrepanz der Resultate im Vergleich tierexperimenteller und humaner Studien. Die vorliegende Arbeit hatte daher zum Ziel, die zum Thema publizierte Literatur systematisch zu analysieren und zu diskutieren.
Methodik
Anhand einer detaillierten Literaturrecherche innerhalb der Datenbanken „PubMed“ und „Web of Science“ versuchten wir alle präklinischen und klinischen Studien zu ermitteln, bei denen VMI zur Rekonstruktion eines segmentalen Nervendefekts verwendet wurden. Dabei wurden nur solche Studien inkludiert, bei denen gleichzeitig eine Kontrollgruppe, welche mit autologem Nerventransplantat versorgt wurde, zum Einsatz gekommen war. Anschließend wurde jede Studie daraufhin analysiert, inwieweit statistisch signifikante Unterschiede hinsichtlich der histologischen und funktionellen Ergebnisse im Vergleich zur Nervenrekonstruktion mit ANT bestanden. Mittels Metaanalyse erfolgte der systematische Vergleich beider Rekonstruktionsverfahren.
Ergebnisse der Literaturrecherche
Wir konnten 31 Studien identifizieren; bei 10 dieser Studien (2 klinische und 8 präklinische) war eine mittels ANT versorgte Kontrollgruppe enthalten.
Die klinischen Studien5,8 umfassten insgesamt 49 Patienten mit Verletzungen des Nervus medianus und Nervus ulnaris distal des Ellenbogens, inklusive der Fingernerven. Die Nervendefekte waren zwischen 10mm und 60mm lang. Bei 26 Patienten erfolgte die Nervenrekonstruktion mit einem autologen Nerventransplantat, entweder dem Nervus suralis oder dem Nervus cutaneus antebrachii medialis, bei 23 Patienten mittels eines VMI. Das Alter der eingeschlossenen Patienten in der einen Studie betrug zwischen 11 und 72 Jahren; sie wurden zwischen 12 und 58 Monaten nachbeobachtet. Das durchschnittliche Alter der Patienten in der anderen Studie betrug 27 Jahre, die Dauer des Beobachtungszeitraums wurde nicht angegeben.
Die 8 eingeschlossenen präklinischen Studien1,6,7,9–13 evaluierten in insgesamt 245 Ratten die Nervenregeneration nach Durchtrennung und Rekonstruktion des Nervus medianus (n=88) und Nervus ischiadicus (n=157). Die kleinste experimentelle Gruppe bestand hierbei aus 3 Tieren, die größte Gruppe aus 14. Die durchschnittliche Länge des rekonstruierten Nervendefekts betrug 13mm, die durchschnittliche Nachbeobachtungszeit 20 Wochen.
Ergebnisse der Metaanalyse
Der Vergleich der Resultate der beiden eingeschlossenen klinischen Studien ergab keine signifikanten Effekte (p=0,22) bezogen auf das gewählte Rekonstruktionsverfahren, gemessen an der statischen 2-Punkte-Diskrimination.
Im Gegensatz dazu zeigten die präklinischen Studien zu späteren Zeitpunkten des Beobachtungszeitraums einen signifikant (p<0,01) nachteiligen Effekt der Nervenrekonstruktion mittels VMI in Bezug auf die funktionelle Regeneration. Hinsichtlich der histologischen Ergebnisse zeigten sich im Tiermodell zwar auf der einen Seite signifikant höhere Axonzahlen nach Nervenrekonstruktion mittels VMI (p<0,01), jedoch zeigte sich gleichzeitig auch ein signifikant (p<0,01) geringerer Myelinisierungsgrad dieser Axone.
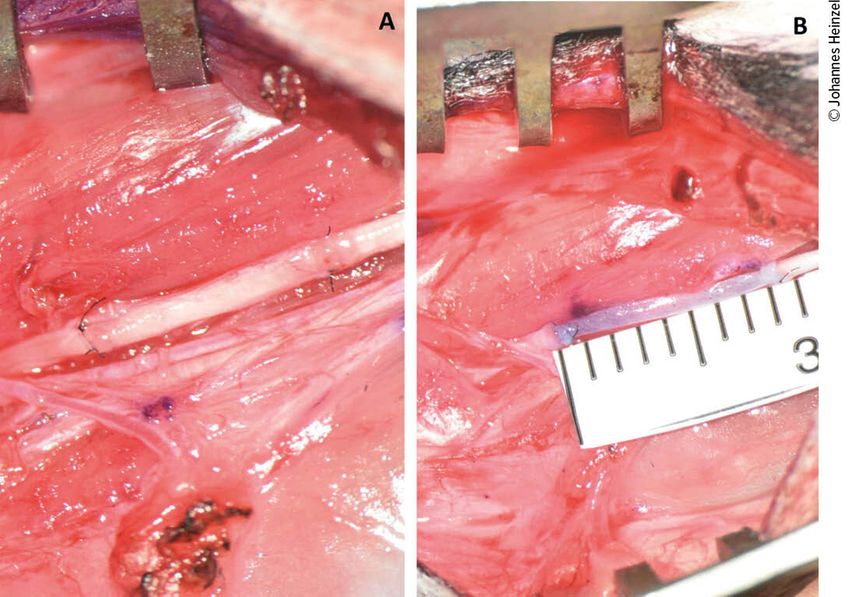
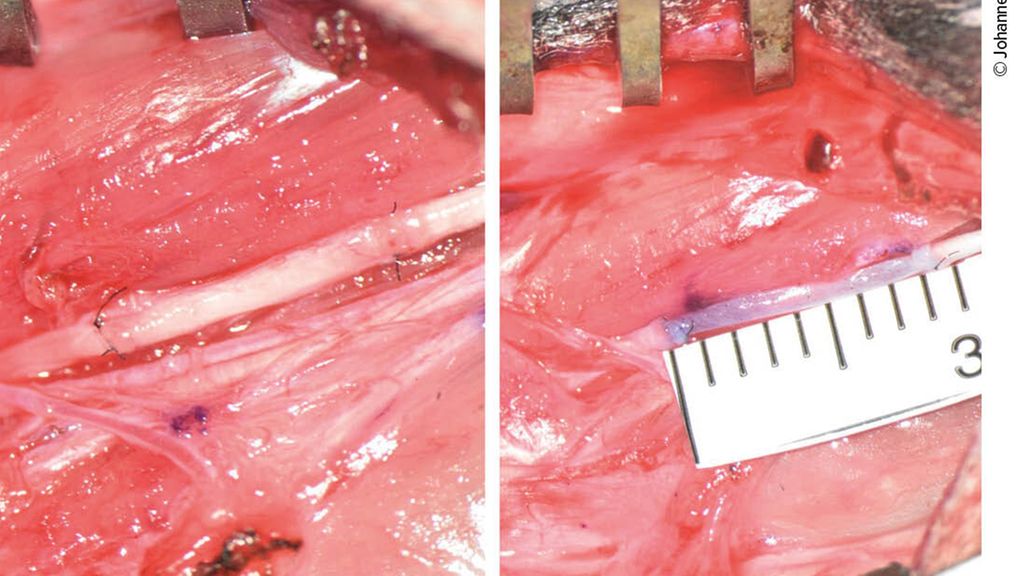
Abb. 1: Rekonstruktion des murinen Nervus medianus mit autologem Nerventransplantat (A) oder Venen-Muskel-Interponat (B)
Diskussion und Schlussfolgerung
Trotz vielversprechender Ergebnisse der Nervenrekonstruktion mittels VMI in klinischen Studien bleiben die Resultate im Tiermodell teils weit hinter denen nach Rekonstruktion mittels ANT zurück. Unseres Erachtens könnte dies zum einen darin begründet sein, dass der im Vergleich zum Menschen deutlich schneller ablaufende Proteinabbau im Nager14 für eine schnellere Auflösung der Muskelfasern im VMI sorgt. Zum anderen bildet sich auch die initial nach der Verletzung zwischen den Nervenstümpfen ausgebildete Fibrinbrücke, die als natürliche Leitstruktur für die regenerierenden Axone dient, in der Ratte bereits nach 2 Wochen zurück, wohingegen sie beim Menschen bis zu 4 Wochen erhalten bleibt.15 Dadurch bedingt könnte es frühzeitig zum Kollabieren des VMI mit dadurch eingeschränkter bis komplett verhinderter axonaler Regeneration kommen. Dies kommt unserer Meinung nach insbesondere bei der Rekonstruktion längerer Nervendefekte (>60mm) zum Tragen.16
Schlussendlich bedarf es weiterer Studien, um das Potenzial der VMI näher zu untersuchen, insbesondere hinsichtlich der Rekonstruktion langstreckiger Nervendefekte. Das Rattenmodell scheint hier jedoch nur bedingt geeignet zu sein, eine Aufarbeitung in anderen Tiermodellen, wie dem Schaf oder Schwein, scheint daher unsererseits empfehlenswert.
Literatur:
1 Brunelli G et al.: Bridging nerve defects with combined skeletal muscle and vein conduits. Microsurgery 1993; 14: 247-51 2 Battiston B et al.: Nerve repair by means of vein filled with muscle grafts I. Microsurgery 2000; 20: 32-6 3 Marcoccio I et al.: Muscle-in-vein nerve guide for secondary reconstruction in digital nerve lesions. J Hand Surg Am 2010; 35: 1418-26 4 Schiefer J et al.: Comparison of short- with long-term regeneration results after digital nerve reconstruction with muscle-in-vein conduits. Neural Regen Res 2015; 10: 1674-7 5 Manoli T et al.: Evaluation of sensory recovery after reconstruction of digital nerves of the hand using muscle-in-vein conduits in comparison to nerve suture or nerve autografting. Microsurgery 2014; 34: 608-15 6 Stößel M et al.: Comparative evaluation of chitosan nerve guides with regular or increased bendability for acute and delayed peripheral nerve repair. Anat Rec 2018; 301: 1697-713 7 Stößel M et al.: Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-the 7-mm rat median nerve gap repair model revisited. Brain Behav 2017; 7: e00813 8 Ahmad I et al.: An evaluation of different bridging techniques for short nerve gaps. Ann Plast Surg 2017; 79: 482-5 9 Geuna S et al.: Bridging peripheral nerve defects with muscle-vein combined guides. Neurol Res 2004; 26: 139-44 10 Geuna S et al.: Functional, morphological and biomolecular assessment of posttraumatic neuro-muscular recovery in the rat forelimb model. Acta Neurochir Suppl 2007; 100: 173-7 11 Papalia I et al.: Repairing nerve gaps by vein conduits filled with lipoaspirate-derived entire adipose tissue hinders nerve regeneration. Ann Anat 2013; 195: 225-30 12 Ulkür E et al.: Comparison of functional results of nerve graft, vein graft, and vein filled with muscle graft in end-to-side neurorrhaphy. Microsurgery 2003; 23: 40-8 13 Ramli K et al.: Efficacy of human cell-seeded muscle-stuffed vein conduit in rat sciatic nerve repair. Tissue Eng Part A 2019; 25: 1438-55 14 Swovick K et al.: Cross-species comparison of proteome turnover kinetics. Mol Cell Proteomics 2018; 17: 580-91 15 Kaplan H et al.: The overwhelming use of rat models in nerve regeneration research may compromise designs of nerve guidance conduits for humans. J Mater Sci Mater Med 2015; 26: 226 16 Lohmeyer J: Venen-Muskel-Interponate bei monofaszikulären Nervendefekten. Handchirurgie Scan 2015; 04: 13-4
Das könnte Sie auch interessieren:
«Auch Patienten mit Demenz profitieren von einer chirurgischen Stabilisierung»
Patienten mit Hüftfraktur und einer leichten, mittelschweren oder schweren Demenz haben ein geringeres Risiko zu sterben, wenn sie operiert werden – vor allem wenn es sich um Kopf-Hals- ...
Stellenwert des individuellen Alignments in der Knieendoprothetik
Dieser Artikel erläutert die unterschiedlichen Alignmentkonzepte in der Knieendoprothetik und deren Stellenwert. Es ist davon auszugehen, dass die Rekonstruktion der individuellen ...
Patientenoptimierung in der orthopädischen Chirurgie
Die Patientenoptimierung vor orthopädischen Eingriffen, insbesondere in der Endoprothetik, spielt eine entscheidende Rolle für den Erfolg der Operation und die Zufriedenheit der ...