Management der intraoperativen Diagnostik bei periprothetischen Gelenksinfektionen
Autoren:
Dr. Irene K. Sigmund
Univ.-Prof. Dr.Reinhard Windhager
Universitätsklinik für Orthopädie und Unfallchirurgie,
Medizinische Universität Wien
Korrespondierende Autorin:
Dr. Irene K. Sigmund
E-Mail: irene.sigmund@meduniwien.ac.at
Die Diagnostik von periprothetischen Gelenksinfektionen, verursacht durch niedrig virulente Mikroorganismen, stellt weiterhin eine Herausforderung dar. Die akkurate intraoperative Probengewinnung ist für eine optimale Diagnostik und Therapie essenziell.
Keypoints
Die Probengewinnung wird am Beginn der Operation und vor dem ausgedehnten Débridement empfohlen.
Mindestens zwei Gewebeproben sollten histopathologisch evaluiert werden.
Zur mikrobiologischen Analyse werden 4–6 Gewebeproben und die Sonifikation empfohlen.
Zur mikrobiologischen Analyse werden 4–6 Gewebeproben und die Sonifikation empfohlen.
Eine akkurate Diagnostik zum Ausschluss oder zur Bestätigung einer periprothetischen Gelenksinfektion (PPI) ist für die Planung der Revisionsoperation (septisch [DAIR, einzeitiger Wechsel, zweizeitiger Wechsel] vs. aseptisch [einzeitiger Wechsel]) essenziell, kann jedoch eine Herausforderung für Orthopäden, Unfallchirurgen, Infektiologen und Mikrobiologen, vor allem bei Low-Grade-Infektionen, verursacht durch Biofilm-produzierende Mikroorganismen, darstellen. Ein standardisiertes, evidenzbasiertes und akkurates Work-up ist notwendig, um für den Patienten die bestmögliche chirurgische als auch antimikrobielle Therapie zu gewährleisten oder um eventuell unnötige zweizeitige Wechsel und prolongierte antibiotische Therapien zu vermeiden.
Präoperativ steht neben der Anamnese, der klinischen Untersuchung und der Bildgebung die Evaluation der Serumparameter (CRP, BSG, D-Dimer etc.) zur Diagnostik von PPI zur Verfügung. Aufgrund der in der Literatur dargestellten niedrigen Spezifitäten (71–88%)1–4 von vor allem CRP und BSG konnten die Serumparameter nicht als infektionsbestätigende Testmethoden definiert werden und müssen durch spezifischere präoperative Testmethoden komplementiert werden. Die Bestimmung der Leukozytenzahl (Sensitivität: 91–98%; Spezifität: 88–100%) und der Prozentsatz der polymorphkernigen neutrophilen Granulozyten (Sensitivität: 93–98%; Spezifität: 83–98%) in der Synovialflüssigkeit nach Aspiration des betroffenen Gelenkes unter sterilen Kautelen sind derzeit die sichersten präoperativen Testmethoden zur Beurteilung von PPI.5–8 Die Ergebnisse dieser Methoden können jedoch schwer zu interpretieren sein: Die Leukozytenzahl und der Prozentsatz der neutrophilen Granulozyten können durch Kristallarthropathien, periprothetische Frakturen und/oder rheumatoide Arthritiden beeinflusst werden und falsch positive Resultate aufweisen. Bei Blutkontamination ist die Zellzahl ebenfalls erhöht und kann nicht fehlerfrei beurteilt werden. Ebenso kann die Synovialfüssigkeit bei zu hoher Viskosität (bei Pus oder zu hoher Zellzahl) verklumpen. In diesen Fällen ist eine automatische Zellzahlanalyse trotz Zusatz von Hyaluronidase meist nicht mehr möglich. Ein weiterer Baustein in der präoperativen Diagnostik ist die mikrobiologische Analyse der Synovialflüssigkeit mittels Kultur, die in der Literatur jedoch aufgrund der niedrigen Sensitivitäten (44–71%) bei hohen Spezifitäten (94–97%) kontrovers diskutiert wird.9–12
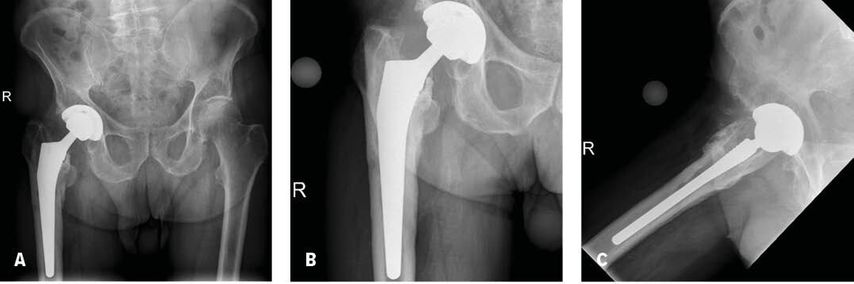
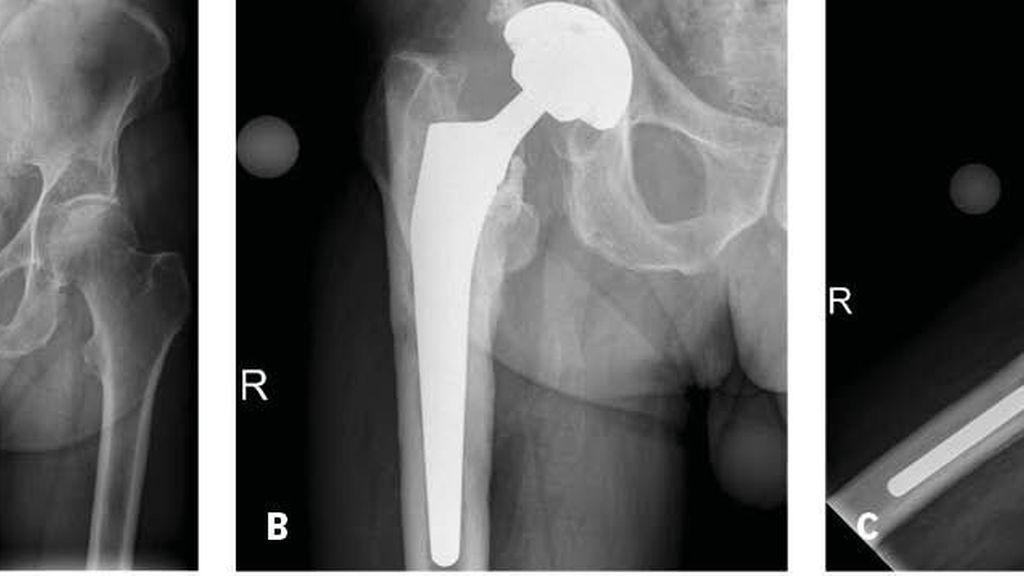
Abb. 1: Röntgenbilder (a.p. [A, B]und axial [C]) eines 76-jährigen Mannes 2,5 Jahre nach Primärimplantation einer Hüfttotalendoprothese rechts. Der Patient berichtete über Schmerzen im Bereich des rechten proximalen Oberschenkels seit ca. 1 Jahr. Die Röntgenbilder zeigen eine Sinterung des Schaftes mit Schaftlockerung. Präoperativ konnte bei einem Serum-CRP von 0,58mg/dL, einer Leukozytenzahl in der Synovialflüssigkeit von 1253 G/L und einem Prozentsatz der polymorphkernigen Neutrophilen von 62% ohne Nachweis eines Mikroorganismus in der Synovialflüssigkeit eine Infektion nicht bestätigt werden. Der intraoperativ durchgeführte Gefrierschnitt zeigte jedoch eine Infektion. Der qualitative alpha-Defensin Test („Lateral flow“ Test) war ebenso positiv. Die definitive Histologie bestätigte eine periprothetische Hüftgelenksinfektion. In der Gewebekultur sowie in der Kultur der Sonikationsflüssigkeit konnte Finegoldia magna nachgewiesen werden
Intraoperative Testmethoden
Bei nicht verfügbaren bzw. nicht interpretierbaren präoperativen Ergebnissen ist der Operateur von den Resultaten der intraoperativen Testmethoden abhängig. Intraoperative Analysen zeigen die sicherste Performance aller derzeit verfügbaren Testmethoden. Die präzise und vor allem sterile Probengewinnung ist daher essenziell: Zu Beginn der Operation – vor dem ausgedehnten Débridement und vor zu starker Kontamination des chirurgischen Situs durch die Diathermie und Absaugvorrichtung – werden die Gewebeproben für die mikrobiologischen und histopathologischen Analysen gewonnen.
Mikrobiologische Evaluierung
Für die mikrobiologische Evaluierung werden 4–6 Gewebeproben empfohlen,13,14 wobei der Einsatz von neuen sterilen Instrumenten (Pinzette, Skalpell) für jede einzelne Probe zur Vermeidung von Kreuzkontaminationen angeraten wird.15 Die Proben sollen dabei direkt, ohne jegliche Kontamination in einen sterilen Behälter, der auch für den Transport zur Mikrobiologie geeignet ist, überführt werden. Eine Langzeitbebrütung von 14 Tagen wird zur Kultivierung von niedrig virulenten Keimen, wie zum Beispiel koagulase-negative Staphylokken oder Cutibacterium spp. (vormals Propionibacterium spp.), empfohlen.
Die phänotypische Evaluierung mittels konventioneller Kultur von intraoperativ gewonnenem Gewebe ist der derzeitige Goldstandard, um den verursachenden Keim zu identifizieren. Sie zeigt eine höhere Sensitivität (61–71%) und ebenso gute Spezifität (95–99%) im Vergleich zu mikrobiologischen Untersuchungen der Synovialflüssigkeit.11,13,16,17
Die Einführung der Sonikation führte zu einer weiteren Erhöhung der Detektionsrate von niedrig virulenten Keimen.7,16 Hierbei werden die nur gering aktiven Mikroorganismen („persister cells“) aus dem Biofilm auf Metall-, Keramik- oder Polyethylenimplantaten durch Ultraschall in die Sonikationsflüssigkeit freigesetzt. Die Sonikationsflüssigkeit kann anschließend mikrobiologisch analysiert werden. Es wurden Sensitivitäten von 71–83% und Spezifitäten von 95–100% beschrieben.7,11,16,17 Die Inokulation der Sonikationsflüssigkeit in Blutkulturflaschen zeigte eine weitere Verbesserung der Sensitivität auf 89% mit zusätzlich reduzierter Detektionszeit, vor allem in Bezug auf niedrig virulente Keime.18 Bei der kombinierten mikrobiologischen Evaluierung von Gewebeproben und der Sonikationsflüssigkeit wurde eine zusätzliche Erhöhung der Identifikationsrate von Bakterien beschrieben.14
Um die Detektionsrate von Mikroorganismen weiter zu optimieren, sollte eine antimikrobielle Therapie für mindestens 14 Tage präoperativ abgesetzt werden. Abstriche jeglicher Art sind aufgrund der hohen Kontaminationsrate bzw. Ungenauigkeit obsolet.
Histopathologische Evaluierung
Die Histopathologie zeigte in der Literatur Sensitivitäten von 81–100% und Spezifitäten von 96–100% in der Diagnostik von PPI.2,5,19,20 Aufgrund der sehr hohen Genauigkeit sollten mindestens zwei Gewebeproben, am besten Teile der periprothetischen Membran und der Pseudokapsel,21 histopathologisch durch einen auf muskuloskelettale Infektionen spezialisierten Pathologen analysiert werden.22 Dieser kann vergleichsweise nicht nur zwischen septisch und aseptisch differenzieren, sondern kann zum Beispiel anhand der Krenn- und Morawietz-Kriterien ebenso zwischen einem Abriebtyp (Typ1), infektiösen Typ (Typ 2), Mischtyp (Typ 3) und Indifferenztyp (Typ 4) unterscheiden.19 Einen entscheidenden Diskussionspunkt stellen jedoch die eingesetzten Grenzwerte der neutrophilen Granulozyten per High-Power-Field der einzelnen Studien dar. Ein internationaler Konsensus konnte bislang nicht gefunden werden.
Ein großer Nachteil der Kultur (1–14 Tage) und der Histopathologie (1–5 Tage) ist die prolongierte Zeitspanne bis zum Erlangen der Ergebnisse. Sind die Ergebnisse der präoperativen Tests nicht eindeutig interpretierbar bzw. kann präoperativ eine PPI nicht eindeutig bestätigt oder ausgeschlossen werden, ist der Operateur von den intraoperativ schnell verfügbaren Testmethoden, wie zum Beispiel dem Gefrierschnitt oder dem qualitativen alpha-DefensinTest, abhängig. Der Gefrierschnitt zeigte in den Händen eines erfahrenen Pathologen eine beinahe perfekte Übereinstimmung (99%, Cohen’s Kappa 0,97) mit der definitiven Histologie und kann daher ebenso als infektionsbestätigender Test empfohlen werden.22 Erneut kann hier die Gewinnung von mindestens zwei Gewebeproben angeraten werden.
Alpha-DefensinTest
Verschiedenen Kliniken steht die intraoperative Gefrierschnittdiagnostik jedoch nicht zur Verfügung. In diesen Fällen kann der qualitative alpha-DefensinTest („Lateral flow“Test) durchgeführt werden. Obwohl im Vergleich zum Gefrierschnitt (86%) eine niedrigere Sensitivität beobachtet wurde (69%), punktet der alpha-DefensinTest mit einer hohen Spezifität (93%) und einer schnellen Durchlaufzeit (10 Minuten), was eine rasche intraoperative Entscheidungsfindung (septische vs. aseptische Chirurgie) in Kliniken ohne Gefrierschnittdiagnostik ermöglicht.
Dennoch wird darauf hingewiesen, dass keine der genannten Methoden eine 100%ige Genauigkeit respektive Sensitivität und Spezifität aufweist, weshalb die Ergebnisse immer in Zusammenschau mit den restlichen durchgeführten Testmethoden beurteilt werden sollten. Aus diesem Grund wurden durch anerkannte orthopädische und infektiologische Gesellschaften (Musculoskeletal Infection Society [MSIS]23, Infectious Disease Society of America [IDSA]24, European Bone and Joint Infection Society [EBJIS]25) Kriterien zur Infektionsdiagnostik definiert.
Fazit
Zusammenfassend kann gesagt werden, dass die akkurate Probengewinnung für eine optimale Diagnostik und Therapie essenziell ist und eine unsachgemäße Durchführung zu falsch positiven Ergebnissen mit unnötigen Operationen oder zu falsch negativen Ergebnissen mit inadäquatem Débridement und neuerlichen Operationen führen kann.
Literatur:
1 Klim SM et al.: Fibrinogen - A practical and cost efficient biomarker for detecting periprosthetic joint infection. Sci Rep 2018; 8(1): 8802 2 Nilsdotter-Augustinsson A et al.: Inflammatory response in 85 patients with loosened hip prostheses: a prospective study comparing inflammatory markers in patients with aseptic and septic prosthetic loosening. Acta Orthop 2007; 78(5): 629-39 3 Paziuk T et al.: A novel adjunct indicator of periprosthetic joint infection: platelet count and mean platelet volume. J Arthroplasty 2020; 35(3): 836-9 4 Shahi A et al.: Serum d-dimer test is promising for the diagnosis of periprosthetic joint infection and timing of reimplantation. J Bone Joint Surg Am 2017; 99(17): 1419-27 5 Della Valle CJ et al.: Preoperative testing for sepsis before revision total knee arthroplasty. J Arthroplasty 2007; 22(6 Suppl 2): 90-3 6 Ghanem E et al.: Cell count and differential of aspirated fluid in the diagnosis of infection at the site of total knee arthroplasty. J Bone Joint Surg Am 2008; 90(8): 1637-43 7 Trampuz A et al.: Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med 2007; 357(7): 654-63 8 Zmistowski B et al.: Periprosthetic joint infection diagnosis: a complete understanding of white blood cell count and differential. J Arthroplasty 2012; 27(9): 1589-93 9 Bare J et al.: Preoperative evaluations in revision total knee arthroplasty. Clin Orthop Relat Res 2006; 446: 40-4 10 Gallo J et al.: Culture and PCR analysis of joint fluid in the diagnosis of prosthetic joint infection. New Microbiol 2008; 31(1): 97-104 11 Gomez E et al.: Prosthetic joint infection diagnosis using broad-range PCR of biofilms dislodged from knee and hip arthroplasty surfaces using sonication. J Clin Microbiol 2012; 50(11): 3501-8 12 Spangehl MJ et al.: Prospective analysis of preoperative and intraoperative investigations for the diagnosis of infection at the sites of two hundred and two revision total hip arthroplasties. J Bone Joint Surg Am 1999; 81(5): 672-83 13 Atkins BL et al.: Prospective evaluation of criteria for microbiological diagnosis of prosthetic-joint infection at revision arthroplasty. The OSIRIS Collaborative Study Group. J Clin Microbiol 1998; 36(10): 2932-9 14 Dudareva M et al.: Sonication versus tissue sampling for diagnosis of prosthetic joint and other orthopaedic device-related infections. J Clin Microbiol 2018; 56(12): e00688-18 15 Sigmund IK, McNally MA: Diagnosis of bone and joint infections. Orthop Trauma 2019; 33(3): 144-52 16 Holinka J et al.: Sonication cultures of explanted components as an add-on test to routinely conducted microbiological diagnostics improve pathogen detection. J Orthop Res 2011; 29(4): 617-22 17 Portillo ME et al.: Multiplex PCR of sonication fluid accurately differentiates between prosthetic joint infection and aseptic failure. J Infect 2012; 65(6): 541-8 18 Janz V et al.: Improvement in the detection rate of PJI in total hip arthroplasty through multiple sonicate fluid cultures. J Orthop Res 2013; 31(12): 2021-4 19 Krenn V et al.: Revised histopathological consensus classification of joint implant related pathology. Pathol Res Pract 2014; 210(12): 779-86 20 Pons M et al.: Infected total hip arthroplasty--the value of intraoperative histology. Int Orthop 1999; 23(1): 34-6 21 Bori G et al.: Interface membrane is the best sample for histological study to diagnose prosthetic joint infection. Mod Pathol 2011; 24(4): 579-84 22 Sigmund IK et al.: A comparative study of intraoperative frozen section and alpha defensin lateral flow test in the diagnosis of periprosthetic joint infection. Acta Orthop 2019: 1-11 23 Parvizi J, Gehrke T: Definition of periprosthetic joint infection. J Arthroplasty 2014; 29(7): 1331 24 Osmon DR et al.: Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2013; 56(1): e1-e25 25 McNally MA et al.: The EBJIS definition of prosthetic joint infection: a practical guide for clinicians. Bone Joint J 2020; in press
Das könnte Sie auch interessieren:
«Auch Patienten mit Demenz profitieren von einer chirurgischen Stabilisierung»
Patienten mit Hüftfraktur und einer leichten, mittelschweren oder schweren Demenz haben ein geringeres Risiko zu sterben, wenn sie operiert werden – vor allem wenn es sich um Kopf-Hals- ...
Stellenwert des individuellen Alignments in der Knieendoprothetik
Dieser Artikel erläutert die unterschiedlichen Alignmentkonzepte in der Knieendoprothetik und deren Stellenwert. Es ist davon auszugehen, dass die Rekonstruktion der individuellen ...
Patientenoptimierung in der orthopädischen Chirurgie
Die Patientenoptimierung vor orthopädischen Eingriffen, insbesondere in der Endoprothetik, spielt eine entscheidende Rolle für den Erfolg der Operation und die Zufriedenheit der ...