Lungenembolie: Engramme für den Behandlungspfad
Autor: Prof. Dr. med.
Lars C. Huber
Leiter Departement Innere Medizin
Stadtspital Zürich
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Lungenembolie ist ein häufiges und potenziell lebensbedrohliches Krankheitsbild. Die Diagnose bleibt herausfordernd – immer noch zählt die Lungenembolie zu den Diagnosen, die am häufigsten verpasst werden. In dieser Übersicht werden klinische Engramme vermittelt, die im Behandlungspfad – vom Verdacht zur Diagnose und Therapie – hilfreich sein können.
Keypoints
-
Die Inzidenz der Lungenembolie hat in den letzten Jahren stetig zugenommen. Gleichzeitig ist die Mortalität rückläufig.
-
Zur Diagnosestellung, für die Risikostratifizierung und zur Abschätzung der Therapiedauer existieren gut validierte klinische Scores. Diese können hilfreich sein, sie ersetzen aber nicht die individualisierte klinische Beurteilung.
-
Bei der hämodynamisch stabilen Lungenembolie mit niedrigem Risiko wird der Nutzen von apparativen Zusatzuntersuchungen (insbesondere die routinemässige Echokardiografie) überschätzt. Auch der Stellenwert von Gerinnungsabklärungen ist gering.
-
Die Therapie erfolgt heute meistens mit einem direkten oralen Antikoagulans (DOAK) – häufig mit Rivaroxaban oder Apixaban.
Epidemiologie
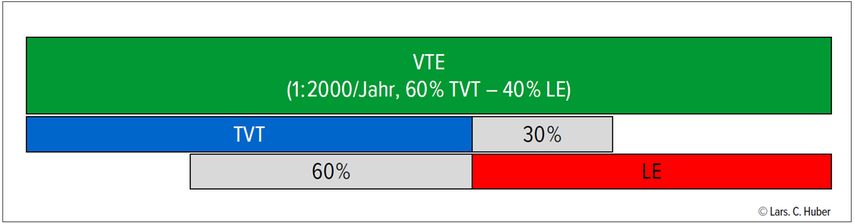
Die Lungenembolie gehört zusammen mit der tiefen Beinvenenthrombose zum Spektrum der venösen Thromboembolie (VTE). Beide Manifestationsformen treten etwa gleich häufig auf, mit leichter Dominanz der TVT (Abb.1). Inzidenzstudien zeigen ein altersabhängiges Risiko: je älter, desto häufiger, mit etwas steilerem Anstieg bei Männern. Insgesamt tritt die VTE mit einer jährlichen Inzidenz von rund 1:2000 auf. In der Schweiz entspricht dies 8000–10000 Lungenembolien jährlich. Interessanterweise ist die Mortalität der Lungenembolie trotz steigender Inzidenz in den letzten Jahren rückläufig – ein Indikator für mögliche Überdiagnostik. Die Mortalität von Hochrisiko-Lungenembolien mit hämodynamischer Instabilität hat in den letzten Jahren allerdings zugenommen. Die Ursache dafür ist unklar.
Abb. 1: Spektrum der venösen Thromboembolie. Die venöse Thromboembolie (VTE, grüner Balken) umfasst die tiefe Beinvenenthrombose (TVT, blauer Balken) und die Lungenembolie (LE, roter Balken). Bis zu 30% der Patient:innen mit TVT haben gleichzeitig eine meist asymptomatische LE. Umgekehrt findet sich bei der LE in bis zu 60% eine ebenfalls häufig asymptomatische TVT. Der wechselseitige Ausschluss ist im klinischen Alltag unnötig, es handelt sich in beiden Fällen um dieselbe klinische Entität mit identischer Behandlung
Symptomatik, Basisabklärung und kognitive Verzerrung
Leitsymptome einer akuten Lungenembolie sind akute Dyspnoe, pleuritischer Thoraxschmerz und Synkope. Letztere tritt bei etwa 10–15% der Fälle auf. Eine unilaterale Beinschwellung in der klinischen Untersuchung ist suggestiv für das Vorliegen einer Lungenembolie, wenn sich Patient:innen mit den oben erwähnten Leitsymptomen präsentieren. Umgekehrt ist wichtig zu erwähnen, dass in den meisten Fällen von akuter Dyspnoe keine Lungenembolie vorliegt, das Gleiche gilt für die synkopalen Ereignisse. Beides sind häufige Gründe für eine Vorstellung auf der Notfallstation. Die initiale Basisabklärung umfasst in der Regel Thoraxröntgen, EKG und arterielle Blutgasanalyse. Diese Modalitäten dienen allerdings weniger der Bestätigung bzw. dem Ausschluss einer Lungenembolie: Sensitivität und Spezifität sind bei allen Untersuchungen niedrig. Das Röntgenbild dient primär der Suche anderer erklärender Ursachen wie Pneumonie, Herzinsuffizienz, Pneumothorax. Pleuraständige Infiltrate können allerdings auch hämorrhagischen Lungeninfarkten als Folge kleiner, peripherer Lungenembolien entsprechen («Hampton’s hump»). Das EKG liefert ein breites Spektrum unspezifischer Befunde wie Tachykardie, Rechtsschenkelblock oder S1Q3T3-Zeichen («McGinn-White sign»). Bei Patient:innen mit akuter Dyspnoe und S1Q3T3-EKG findet sich in nur der Hälfte aller Fälle eine Lungenembolie. Arterielle Blutgasanalysen zeigen häufig Hypoxämie, Hypokapnie und einen erhöhten alveolo-arteriellen Gradienten. Normale Befunde schliessen das Vorliegen einer Lungenembolie aber keineswegs aus.
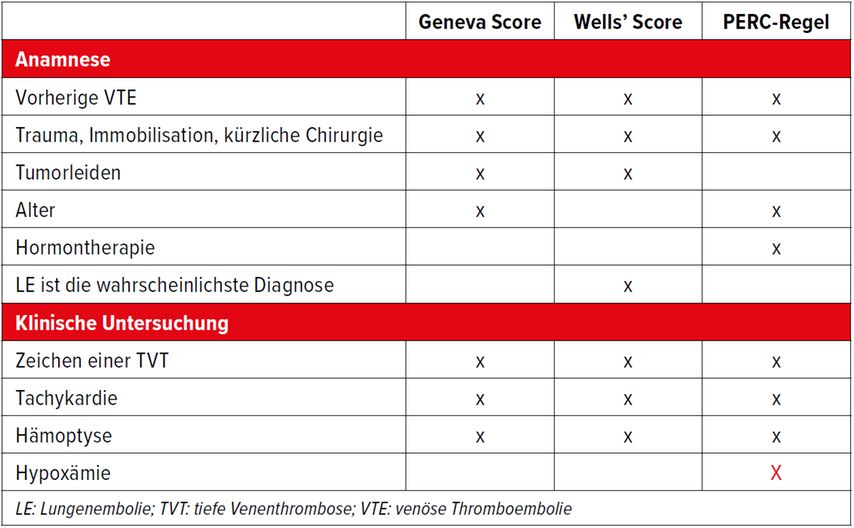
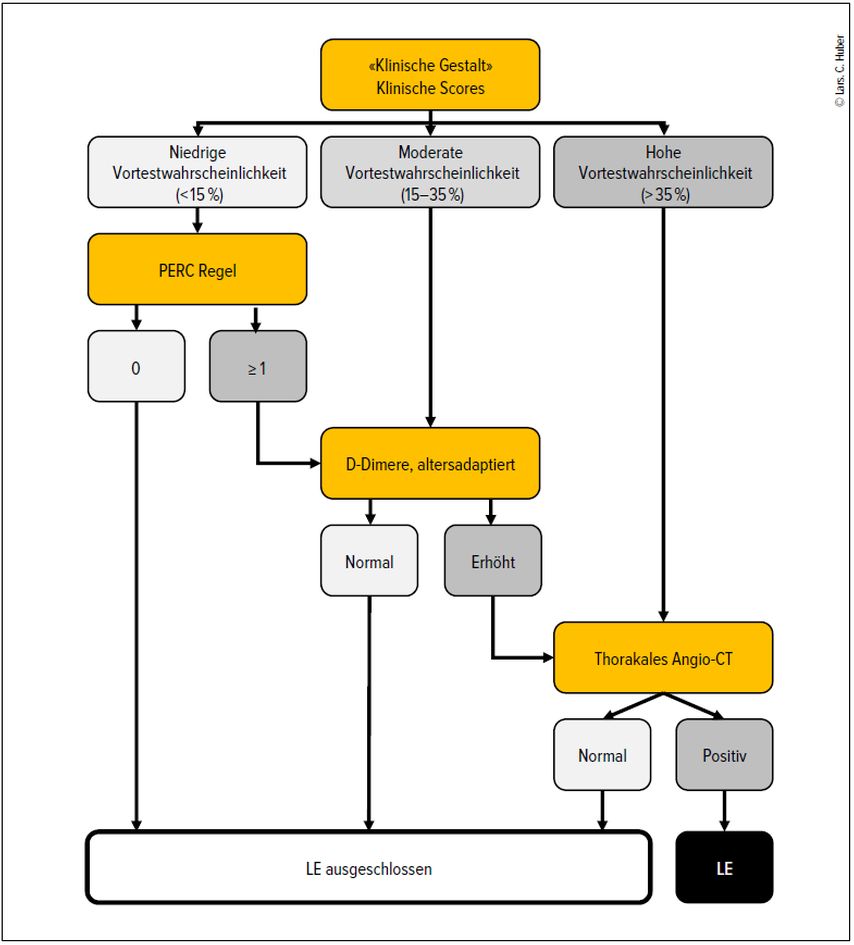
Die Bestimmung der Vortestwahrscheinlichkeit kann durch klinische Scores (z.B. Wells-, Geneva-, YEARS-Kriterien; Tab.1) oder durch die ärztliche Einschätzung («klinische Gestalt») erfolgen. Die Scores sind gut validiert und können im Alltag hilfreich sein. Bei erfahrenen Ärzt:innen ist die klinische Gestalt den Scores ebenbürtig. Ich persönlich verwende immer die klinische Gestalt – sie erlaubt mir die Formulierung einer Vortestwahrscheinlichkeit unter Berücksichtigung aller zur Verfügung stehenden Informationen. Der Abklärungsgang ist in Abbildung 2 dargestellt.
Abb. 2: Abklärungsalgorithmus bei Verdacht auf Lungenembolie. Die Einschätzung der Vortestwahrscheinlichkeit erfolgt durch die ärztliche Einschätzung («klinische Gestalt») oder durch die etablierten klinischen Scores. Bei niedriger Vortestwahrscheinlichkeit kann die PERC-Regel zur Ausschlussdiagnostik verwendet werden, bei mittlerer werden D-Dimere bestimmt. Eine hohe Vortestwahrscheinlichkeit für das Vorliegen einer Lungenembolie erfordert direkt eine bildgebende Diagnostik mit CT-Angiografie
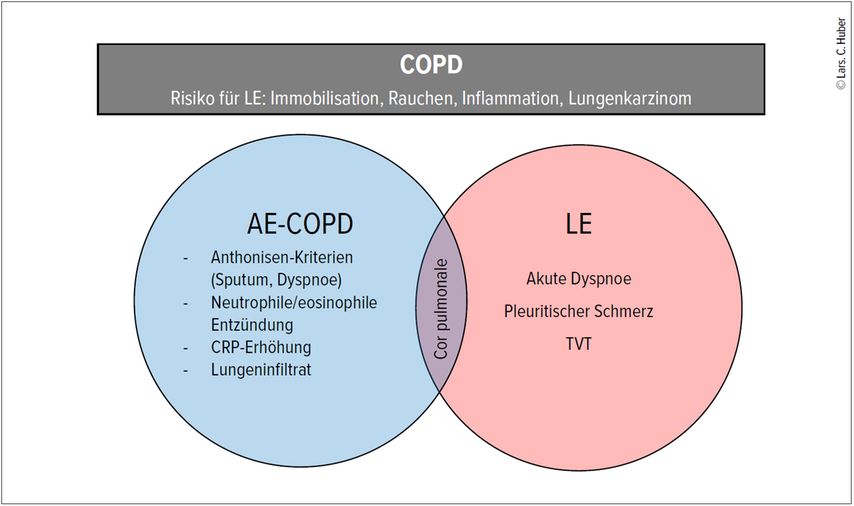
Kognitive Verzerrungen («Biases») sind ein zentrales Problem bei der Diagnosestellung: Die Ankerheuristik bei Patient:innen mit bereits etablierten Diagnosen wie Herzinsuffizienz oder COPD (Abb.3) lässt die Wahrscheinlichkeit einer Lungenembolie vermeintlich niedriger erscheinen, obwohl diese selbst Risikofaktoren für eine VTE darstellen. Auch der subjektive Eindruck der Ärzt:innen kann zu Fehleinschätzungen führen. Bei lächelnden Patient:innen mit akuter Dyspnoe zum Beispiel wird das Vorliegen einer alternativen Diagnose als wahrscheinlicher angenommen.
Risikostratifizierung
Die Einteilung in Risikokategorien hat direkte therapeutische Konsequenzen. Der PESI-Score dient zur Identifikation von Low-Risk-Patient:innen, die ambulant behandelt werden können – eine Option, die immer noch zu selten genutzt wird. Der Einsatz der Echokardiografie zur zusätzlichen Risikoeinschätzung ist umstritten. Studien zeigen keinen Überlebensvorteil, aber höhere Folgekosten, wenn die Echokardiografie routinemässig bei hämodynamisch stabilen Low-Risk-Patient:innen eingesetzt wird. Eine wichtige Indikation für die Echokardiografie ist die Abklärung von Patient:innen mit Post-Lungenembolie-Syndrom. Diese schlecht definierte Entität betrifft rund 10% der Patient:innen nach akuter Lungenembolie. Bei persistierender Symptomatik trotz adäquater Therapie >3 Monate nach der Akutphase muss eine chronische thromboembolische pulmonale Hypertonie (CTEPH) ausgeschlossen werden. Dabei handelt es sich um eine potenziell kurative Form der pulmonalen Hypertonie.
Abb. 3: Ankerheuristik und klinisches «Silo-Denken». Patient:innen mit COPD weisen relevante Risikofaktoren für die Entwicklung einer venösen Thromboembolie auf. Bei hospitalisierten Patient:innen mit der Diagnose akut exazerbierte COPD (AE-COPD) findet sich entsprechend in bis zu 30% eine Lungenembolie (LE). Warnzeichen sind Zunahme der Dyspnoe als alleinig erfülltes Anthonisen-Kriterium ohne wesentliche Veränderung der Sputummenge und -qualität bei insgesamt geringer systemischer Entzündungsaktivität
Behandlung: womit, wie lange, welche Dosis?
Die Therapie orientiert sich an drei zentralen Fragen:
Welches Medikament? In der Regel werden DOAK verwendet. Apixaban scheint ein günstigeres Sicherheitsprofil als Rivaroxaban zu haben (v.a. bei älteren Patient:innen mit gastrointestinalen Blutungen). Apixaban zeigt auch bei inadäquater Einnahme (z.B. eine zusätzliche Dosis oder eine ausgelassene Dosis) stabile Spiegel im therapeutischen Zielbereich und darf unabhängig von den Mahlzeiten eingenommen werden.
Wie lange? Die Therapiedauer richtet sich nach der Ursache. Bei grossen reversiblen Risikofaktoren (z.B. grosser chirurgischer Eingriff) kann die Therapie nach 3 Monaten gestoppt werden. Bei grossen persistierenden Risikofaktoren (z.B. Malignom) muss sie ohne definiertes Stoppdatum als Dauertherapie fortgeführt werden. Bei kleinen Risikofaktoren oder unprovozierten Ereignissen können Scores (z.B. VTE-PREDICT) helfen, das Rezidivrisiko und damit die Therapiedauer abzuschätzen.
Welche Dosis in der prolongierten Therapiephase (>6 Monate)? Eine reduzierte prophylaktische Dosis (z.B. Apixaban 2x2,5mg) ist gemäss API-CAT-Studie bei Tumorpatient:innen wirksam und sicher
Gerinnungsabklärung
Die Thrombophiliediagnostik hat nur eine begrenzte Bedeutung im Management der Lungenembolie. Die wichtigsten Hinweise auf eine hereditäre Thrombophilie liefert die Anamnese: junges Alter bei Erstereignis (<50 Jahre), positive Familienanamnese bei Verwandten ersten Grades, ungewöhnliche Lokalisation der VTE oder arterielle Thrombosen, rezidivierende Ereignisse. Labortests beeinflussen in den meisten Fällen weder die Therapieentscheidung noch die Dauer. Eine wichtige Ausnahme bildet das Antiphospholipid-Syndrom, bei dem Vitamin-K-Antagonisten empfohlen werden. Thrombophilietests sollten entsprechend gezielt und mit Zurückhaltung eingesetzt werden.
Literatur:
● Arrigo M, Huber LC: Pulmonary Embolism and heart failure: A reappraisal. Card Fail Rev 2021; 7: e03 ● Arrigo M et al.: Diagnosis and treatment of right ventricular failure secondary to acutely increased right ventricular afterload (acute cor pulmonale). A Clinical Consensus Statement of the Association for Acute CardioVascular Care (ACVC) of the ESC. Eur Heart J Acute Cardiovasc Care 2023; 13: 304-12 ● Arrigo M, Huber LC: [Vaskuläre Dyspnoe: Lungenembolie]. Ther Umsch 2023; 80: 265-70 ● Stüssi-Helbling M et al.: Pearls and myths in the evaluation of patients with suspected acute pulmonary embolism. Am J Medicine 2019; 132: 685-91
Weiterführende Literatur beim Verfasser
Das könnte Sie auch interessieren:
Die Mykobakterien-Challenge – welches TBC-Medikament wirkt wo warum?
Abgesehen von der langen Therapiedauer sieht man sich in der Behandlung der Tuberkulose mit drei großen Herausforderungen konfrontiert: den für dieses Bakterium typischen Eigenschaften, ...
Best of DGP: Kongress-Highlights für die Praxis
Dr. Sabine Lampert, niedergelassene Pneumologin in Erlangen, fasste die Erkenntnisse vom DGP-Kongress 2025 für die tägliche Praxis zusammen. Sie konzentrierte sich bei ihrem „Best of DGP ...