Grundlagen und Evidenz von PRP & Co.
Autor*innen:
Univ.-Prof. Dr. Stefan Nehrer, MSc
Alexander Otahal, PhD, MSc
Ass. Prof. Mag. Andrea De Luna, PhD
Zentrum für Regenerative Medizin
Universität für Weiterbildung Krems
Korrespondierender Autor:
Univ.-Prof. Dr. Stefan Nehrer, MSc
E-Mail: stefan.nehrer@donau-uni.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die therapeutische Anwendung von Blutbestandteilen hat eine lange Geschichte und wurde durch die Entwicklung von ambulanten Verfahren verbreitet (Point of Care). Dadurch sind besonders Thrombozytenkonzentrate wie PRP in den Fokus des Interesses gekommen. Durch die Vielzahl der Gewinnungs- und Anwendungstechnologien und der individuell unterschiedlichen Zusammensetzungen dieser Blutderivate ist es schwierig, Generelles zur Wirksamkeit und zu Indikationen zu postulieren. Neue Forschungsergebnisse zeigen, dass neben den schon bekannten Wachstumsfaktoren auch nachhaltige Veränderungen durch extrazelluläre Vesikel als Botenstoffe eine Rolle spielen. Das Ziel wäre, durch standardisierte Herstellungsverfahren zu einer besseren Wirksamkeitsdarstellung zu kommen und den klinischen Einsatz evident abzusichern.
Wie wirken Blutderivate ?
Die Geschichte von Blut in der Medizin geht weit zurück und hat in der modernen Medizin mit dem Einsatz von Fibrin als Hämostyptikum und Klebesubstanz um 1905 eine erste spezifische Anwendung erfahren. Kingsley hat 1954 den Begriff „platelet-rich plasma“ im Zusammenhang mit Gerinnungsexperimenten geprägt und Marx berichtete PRP als regenerative Therapie bei der Knochenbildung, was dann zu verschiedenen Anwendungen von Fibrin und Thrombozytenkonzentraten als Gel, Membran oder Lysat vor allem bei Wundheilungsstörungen führte.
Die breite klinische Einführung von PRP erfolgte in den späten 1990er-Jahren, als es für klinische Interventionen in der Mund-, Kiefer- und Gesichtschirurgie eingesetzt wurde. Im Jahr 2010 gewann die Anwendung in der Sportmedizin zur Heilung von Sportverletzungen an Popularität, wohl ausgelöst durch einen Bericht der New York Times über die erfolgreiche Anwendung bei einem Footballspieler beim Superbowl, was den endgültigen Durchbruch brachte – so viel zur Frage der Wissenschaftlichkeit, warum sich medizinische Errungenschaften manchmal durchsetzen.
Plättchenreiches Plasma (PRP) ist ein Produkt, welches Blutplättchen konzentriert in einer Plasma- oder Serumsuspension enthält. Die Gewinnung von PRP erfolgt aus dem Vollblut einer Person durch Zentrifugation, um eine Trennung der Bestandteile des Blutes zu erreichen. Die meisten Präparationen umfassen die Entnahme von autologem Vollblut mit Citrat als Antikoagulans, bevor das Blut zentrifugiert wird. Typischerweise verwendete Antikoagulanzien sind Citratdextrose oder Heparin, wobei diese dazu beitragen, dass die Trennung der Blutplättchen erleichtert wird, ohne dass dabei ihre granulären Moleküle zerstört werden. Einige Systeme enthalten kein Antikoagulans, jedoch das zellfreie Plasma, welches die Gerinnungsfaktoren enthält, wobei es ohne Zugabe von Antikoagulanzien zur Gerinnung von PRP kommen kann, wenn dieses verabreicht wird.
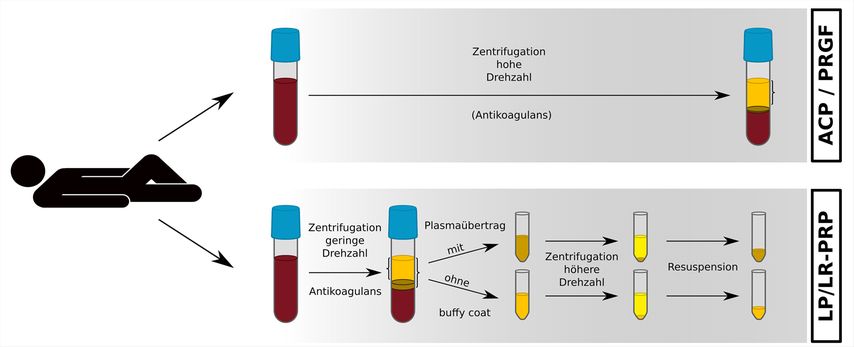
Entsprechend dem Zentrifugationsgradienten trennt sich die flüssige Phase (das Plasma/Serum) von korpuskulären Anteilen, wie Thrombozyten und Erythrozyten. Dazwischen liegt eine unscharfe Übergangszone, der „buffy coat“, in dem sich auch Leukozyten und Proteinfraktionen sammeln. So werden dann entweder die Plasma-/Serumfraktion allein oder/und der „buffy coat“, der gegebenenfalls auch ein zweites Mal zentrifugiert wird, für die Applikation verwendet. Dies macht einen großen Unterschied hinsichtlich der Konzentration von Zellanteilen und Proteinen, wie Wachstumsfaktoren und Zytokinen. Die häufigsten von PRP freigesetzten Wachstumsfaktoren sind TGF-β, IGF-1, FGF-2, PDGF-BB und VEGF. Allerdings unterscheidet sich die Thrombozytenkonzentration in PRP von Spender zu Spender in Abhängigkeit vom Ausgangswert im Vollblut sowie von der Technologie und Dauer der Zentrifugation. Durch die Zentrifugation sind Thrombozyten im PRP 4- bis 8-mal konzentrierter als im Vollblut vorhanden. Neue Trennungszentrifugen können verschiedene PRP-Variationen in einer Zentrifuge herstellen und sind geschlossene Systeme, was die Infektionssicherheit deutlich erhöht (Abb. 1).
Abb. 1: Verschiedene Möglichkeiten der Techniken zur Zentrifugation des Vollblutes mit oder ohne Antikoagulans zur Herstellung von Blutderivaten
Das Zentrum für Regenerative Medizin befasst sich in der Erforschung der Wirksamkeiten von Blutderivaten mit extrazellulären Vesikeln (EV), die als Messenger zwischen den einzelnen Zellpopulationen fungieren, verschiedene Prozesse in den Heilungskaskaden beeinflussen können und ihre Wirkung durch langfristige Genaktivierung entfalten. EV sind nanogroße Membranvesikel, die Mikro-RNA (mi-RNA) und Wachstumsfaktoren im Vesikel, aber auch auf der Membran (Protein-Corona) enthalten. Mi-RNA kann in den Zellen eine Änderung der Genexpression und Proteintranslation steuern und so nachhaltig inflammatorische, regenerative (anabol/katabol) sowie immunmodulatorische Prozesse beeinflussen. Das Repertoire dieser mi-RNA in den Vesikeln ist komplex: Es konnten antiinflammatorische und regenerativ wirkende Fraktionen isoliert werden, die hypothetisch den komplexen Krankheitsprozess der Osteoarthritis wieder ins Gleichgewicht bringen und somit eine nachhaltige und auch langfristige Wirkung erzielen. Das erklärt, warum solche Blutderivate über Zytokine und Wachstumsfaktoren sofort Wirkungen haben, welche aber aufgrund der kurzen Halbwertszeit vor Ort und der Instabilität der Proteine nur sehr kurzfristig sein können. Die mi-RNA der EV verändert aber nachhaltig das Zellverhalten und führt zu langfristigen Effekten.4 In experimentellen Anwendungen von EV konnten solche nachhaltigen antiinflammatorischen und regenerativen Effekte gezeigt werden, wobei sie verschiedene inflammatorische Aktivierungswege (IL1, TNF-alpha, NF-kappaB) beeinflussen. Derzeit werden verschiedene Herstellungstechnologien daraufhin untersucht, inwieweit eine Standardisierung der Wirksamkeit der Blutprodukte möglich ist, wobei die Zusammensetzung der Faktoren von Patient zu Patient sehr unterschiedlich ist, aber die Muster der Zusammensetzung an Wachstumsfaktoren und das Repertoire an EV entscheidend für langfristige Therapieerfolge sind.
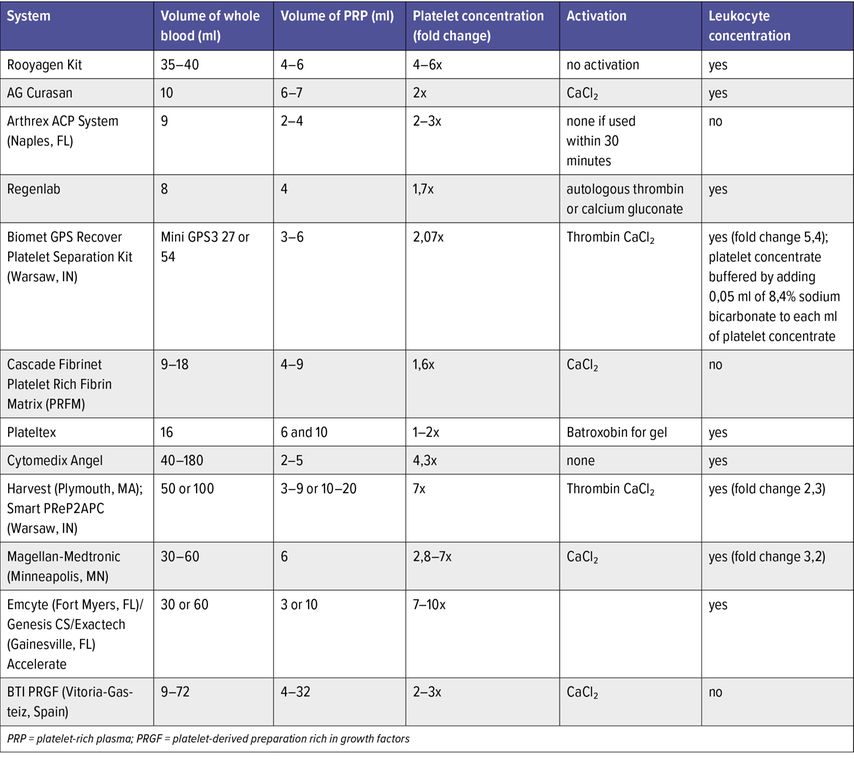
Die Aktivierung von Blutplättchen wird oft als ein Aufbrechen der Blutplättchen fehlinterpretiert. Thrombozyten werden während des Gerinnungsprozesses des Blutes aktiviert und beginnen in der Regel innerhalb von 10 Minuten nach dem Gerin-nungsprozess Wachstumsfaktoren zu sekretieren. Etwa 95% dieser Faktoren werden 1 Stunde nach der Aktivierung freigesetzt. Einige Techniken zur Präparation des PRP verwenden Thrombin, um die Blutplättchen zu aktivieren, einen Clot zu bilden und eine Lösung freizusetzen, die alle Wachstumsfaktoren enthält (Tab. 1). Andere Techniken verwenden Antikoagulanzien wie Heparin, Natriumcitrat oder Citratdextrose, um die Gerinnung zu verhindern und die wachstumsfaktorenreiche Serumlösung zu gewinnen.
Zusammenfassend lässt sich sagen, dass die Heterogenität der verschiedenen verwendeten Technologien und der damit verbundenen unterschiedlichen Zusammensetzung der Blutderivate in den Studien viele Fragen in der Beurteilung des Behandlungsprinzips an sich offenlassen. PRP ist ein gängiger Begriff geworden, der vielfältig in der Literatur beschrieben wird, jedoch verwenden kommerzielle Systeme oft unterschiedliche Terminologien, wie: autologes konditioniertes Plasma, plättchenangereichertes Plasma, plättchenreiches Konzentrat, Plättchenlysat und andere mehr. Kritische Faktoren sind dabei das unterschiedliche Volumen des entnommenen Vollblutes, die Geschwindigkeit und Spinzeit der Zentrifugation, die Zugabe eines Antikoagulans oder eines Aktivators sowie die Konzentration der Leukozyten im PRP. Die Funktionalität von EV spielt hier sicher eine große Rolle und muss im Zusammenspiel mit dem Freiwerden von Proteinen aus den Granula der Thrombozyten gesehen werden.
Letztendlich ergeben sich auch in der Beurteilung der Wirksamkeit neue Aspekte für die differenzierte Anwendung. So könnten aktivierte Arthrosen mit Erguss und sogenannte trockene Arthrosen ohne synovialen Reizzustand therapeutisch unterschiedliche PRP bekommen. Weiters können auch Rückschlüsse auf die inkonstante Effizienz in der Behandlung von degenerativen Gelenkerkrankungen gezogen werden und damit könnte erklärt werden, warum solche regenerative Verfahren bei sogenannten Non-Respondern gar nicht wirken.
Die Komposition antiinflammatorischer oder regenerativer kataboler Faktoren wird durch die Zusammensetzung maßgeblich beeinflusst und bewirkt komplexe Reaktionen. Sieht man aber auf die komplexen Zusammenhänge inflammatorischer, degenerativer kataboler Prozesse, wie sie bei der Osteoarthritis vorkommen, so erscheint es sinnvoll, hier nicht mit Monosubstanzen, sondern mit dynamischen reaktiven Therapiekonzepten wie Blutderivaten erfolgreich eine Gelenkshomöostase herzustellen. Da der phasenhafte Verlauf der Arthrose solche passageren Aktivierungszustände kennt, die auch oft ohne Therapie wieder symptomarm werden, erscheint es ein therapeutisches Ziel, diesen Mechanismus zu unterstützen.
PRP für intraartikuläre Anwendungen bei degenerativer Gelenkerkrankung
Die evidenzbasierte Betrachtung der Anwendung von Blutderivaten ist kontrovers und erst vor Kurzem hat eine in JAMA publizierte RCT-Studie die Wirksamkeit von PRP bei Gonarthrose kritisch hinterfragt, wobei keine verbesserte Wirkung gegenüber Placebo gezeigt werden konnte.1 Im selben Zeitraum erschienen aber zwei RCT-Studien, die eine signifikante Wirksamkeit von PRP gegenüber Placebo bei Arthrosepatienten zeigen konnten.2,8
Wem also glauben? Die Gründe für die hohe Variabilität liegen einerseits darin, dass die Studien oft keine ausreichende Stratifikation der Arthrosepatienten beinhalten, wobei der Arthrosegrad hier nur eine mögliche Differenzierung neben vielen anderen Faktoren, wie BMI, Lebensgewohnheiten, Ernährung, Sport sowie Belastungs- und Schmerzanamnese und Krankheitsdauer, wäre. Weiters geht man zurzeit von zumindest vier Aktivierungsmechanismen der inflammatorisch-degenerativen Kaskaden bei Arthrose aus, sodass hier Synoviaanalysen gemacht werden müssten, um den Typ der Arthrose festzulegen.
Arthrosepatient ist also nicht gleich Arthrosepatient. Somit gibt es gemischte Kohorten, bei denen Effekte nicht eindeutig zugeordnet werden können.
Insgesamt bleiben in fast jeder Studie 20–30 % der Patienten Non-Responder, die aus den genannten Gründen nicht auf die Therapie ansprechen, und um die 30% der Fälle werden im Beobachtungszeitraum von allein besser oder schlechter, was am phasenhaften Verlauf der Arthrose liegt. Daher finden wir eine hohe Variabilität des Krankheitsverlaufs per se und eine Placebowirksamkeit, wie sie von schmerzdominierten Erkrankungen insgesamt bekannt ist.
Es ist also ein schwieriges Forschungsfeld, in dem eindeutige Biomarker, um die Wirksamkeiten dingfest machen zu können, fehlen.
Evidenz in der PRP-Forschung
Schauen wir auf eine der letzten Metaanalysen über PRP (34 RCT mit insgesamt 1403 PRP-behandelten versus 1426 Kontroll-Kniegelenken),5 so sehen wir, dass PRP im Vergleich zu Placebo im WOMAC-Score besser abschneidet, weiters auch gegenüber anderen Injektionsmethoden mit Hyaluronsäure und Cortison, wobei aber nicht in allen Parametern eine relevante therapeutische Wirksamkeit erreicht wurde („minimal clinical relevance“). Das heißt, die angestrebte Zielgröße in der Wirksamkeit von klinischer Verbesserung wird nicht immer erreicht. Berücksichtigen wir aber dann die Nebenwirkungen von medikamentöser NSAR-Therapie oder reiner Schmerztherapie, ist die Anwendung von Blutderivaten deutlich positiver zu beurteilen. Filardo et al. konnten in ihrer Metanalyse zeigen, dass es relevante Effektgrößen in kurzfristigen Studien gibt, aber noch signifikant bessere in Langzeitstudien gegenüber Placebo, wobei Wirksamkeiten über ein Jahr gezeigt werden konnten.6 Eine krankheitsmodifizierende Wirkung mit einer Verbesserung des Arthrosegrades gibt es in keiner der Studien, nur die Verlangsamung des Verlaufs und die Reduzierung der Symptomatik sind offenbar möglich. Das Nebenwirkungsprofil der Anwendung ist sehr gering und beinhaltet fast ausschließlich die mit der Infiltration verbundene Infektionsgefahr, die aber bei Verwendung von geschlossenen Herstellungstechnologien und sterilem Applikationsverfahren sehr gering ist.
Augrund der teilweise kontroversen Studienlage hat man sich im Sinne der evidenzbasierten Medizin unter Berücksichtigung der besten Evidenz, der besten verfügbaren Therapie und des Bedarfs des Patienten im Rahmen eines sehr aufwendigen Delphi-Prozesses zu einem Exper-tenkonsensus der ESSKA entschlossen, der unter dem Namen ORBIT („Orthobiologic Initiative“) publiziert ist.3 Hier werden Fragen beantwortet und Empfehlungen gegeben, wobei der Übereinstimmungsprozentsatz (0–9) der Experten und die wissenschaftliche Absicherung (A–D) angegeben werden. Hier nur auszugsweise einige Fragen:
Unterstützt die derzeitige Evidenz die Anwendung von PRP bei Kniearthrose?
„Die klinische Evidenz unterstützt die Anwendung von PRP bei Kniearthrose, da sowohl in Vergleich mit Placebo als auch anderen Therapieformen (Hyaluronat, Cortison) bessere Ergebnisse erzielt werden konnten, was auch durch präklinische Studien unterstützt wird.“ (A8)3
Für welchen Grad von Arthrose eignet sich PRP?
„Die beste klinische Wirksamkeit wurde für milde und moderate Arthroseformen gefunden und sollte für diese indiziert werden (Kellgren-Lawrence <3).“ (A8,1)3
In welcher Altersgruppe soll PRP verwendet werden?
„Die Mehrzahl der Studien inkludiert Patienten zwischen 55 und 65 Jahren, wobei kein generelles Statement, sondern die Berücksichtigung des biologischen Alters wichtig erscheint.“ (D8,4)3
Ist die Anwendung bei schweren Arthrosegraden gerechtfertigt?
„Im Einzelfall kann PRP auch bei schweren Arthrosen angewendet werden, wenn zB eine Kontraindikation gegen den Gelenkersatz besteht.“ (C8,1)3
Conclusio
PRP bietet Patienten in der frühen Phase einer degenerativen Knieveränderung (Kellgren-Lawrence 1–3) eine symptomatische Schmerzlinderung und die Verwendung sollte bei Patienten mit moderater Knie-Osteoarthrose in Betracht gezogen werden, nicht jedoch bei Patienten mit Osteoarthrose in einem fortgeschrittenen Stadium (Kellgren-Lawrence 4). Leukozytenarmes PRP scheint aufgrund der genannten klinischen Studien eine bessere PRP-Präparationsmethode für Osteoarthritis darzustellen. Zukünftige Forschungen sollten sich auf eine standardisierte Herstellung von Blutderivaten konzentrieren und differenzierte Anwendungsprofile erarbeiten.
Abschließend gelten natürlich die international publizierten Behandlungsrichtlinien, in denen Injektionstherapien nicht als Ersttherapien angesehen werden und konservative Therapien sowie vor allem auch Lebensstiländerungen und Ernährungsumstellung im Vordergrund stehen, um Arthrosepatient*innen nachhaltig zu behandeln.
Literatur:
1 Bennell KL et al.: Effect of intra-articular platelet-rich plasma vs placebo injection on pain and medial tibial car-tilage volume in patients with knee osteoarthritis: the RESTORE randomized clinical trial. JAMA 2021; 326(20): 2021-30 2 Chu J et al: Intra-articular injections of plate-let-rich plasma decrease pain and improve functional outcomes than sham saline in patients with knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc 2022; 30(12): 4063-71 3 De Girolamo L et al.: ESSKA Orthobiologic Initiative (ORBIT): Consensus process on blood derived products. 20th ESSKA Congress 2022, Paris 4 De Luna A et al.: Mesenchymal stromal cell-derived extracellular vesicles - silver linings for cartilage regeneration? Front Cell Dev Biol 2020; 8: 593386 5 Filardo G et al.: PRP injections for the treatment of knee osteoarthritis: a meta-analysis of randomized controlled trials. Cartilage 2021; 13(1 Suppl): 364S-375S 6 Kon E et al.: Autologous protein solution injections for the treatment of knee osteoarthritis: 3-year results. Am J Sports Med 2020; 48(11): 2703-10 7 Laver L et al.: PRP for degenerative cartilage disease: a systematic review of clinical studies. Cartilage 2017; 8(4): 341-64 8 Yurtbay A et al.: Multiple platelet-rich plasma injections are superior to single PRP injections or saline in osteoarthritis of the knee: the 2-year results of a random-ized, double-blind, placebo-controlled clinical trial. Arch Orthop Trauma Surg 2022; 142(10): 2755-68 9 Zhou Y et al.: The differential effects of leukocyte-containing and pure platelet-rich plasma (PRP) on tendon stem/progenitor cells - implicaions of PRP application for the clinical treatment of tendon injuries. Stem Cell Res Ther 2015; 6(1): 173
Das könnte Sie auch interessieren:
Periphere Nervenkompressionssyndrome der oberen Extremität
Periphere Nervenkompressionssysteme der oberen Extremitäten sind verhältnismäßig häufig, insbesondere der Nervus medianus und der Nervus ulnaris sind oft im Bereich des Hand- bzw. ...
Konservative Behandlungsmöglichkeiten bei peripheren Nervenläsionen
Eine periphere Nervenläsion erfordert nicht nur eine Dekompression, Naht oder Rekonstruktion. Um Gelenke beweglich zu erhalten, eine Atrophie der Muskulatur zu verhindern und die ...
Bildgebende Diagnostik des peripheren Nervensystems
Die komplexen Nerventopografien machen die Nervenbildgebung zu einer fordernden Aufgabe, die allerdings eine wichtige Rolle dabei spielt, eine funktionelle Wiederherstellung der ...