Die septische Prothese: ein Kurzüberblick
Autoren:
Dr.Thomas Hofstädter, MBA
Prof. Dr. Thomas Freude
Universitätsklinik für Orthopädie und Traumatologie, PMU Salzburg
E-Mail: t.hofstaedter@salk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Endoprothesenassoziierte Infektionen bleiben trotz fortgeschrittenen Wissens über Prävention, Diagnostik und Therapie gefürchtete Komplikationen und stellen Behandler und Patienten vor herausfordernde Aufgaben. Oft steht den Patienten ein mühevoller Leidensweg mit mehreren Operationen und langen Krankenhausaufenthalten bevor. Sollte eine Infektion eintreten, sind eine rasche und sichere Diagnose sowie eine adäquate Therapie entscheidend.
Keypoints
Die Unterscheidung zwischen akutem und chronischem Infekt führt zu unmittelbaren therapeutisch-chirurgischen Konsequenzen bzgl. der Behandlungsstrategie.
Die Diagnostik muss akkurat einem genauen Abklärungsalgorithmus folgen, um einerseits den Infekt zu bestätigen und andererseits den Keim detektieren zu können.
Das DAIR-Konzept und der einzeitige Wechsel haben in den letzten Jahren gegenüber dem zweizeitigen Wechsel deutlich an Bedeutung gewonnen. Bei Letzterem geht der Trend zu sehr kurzen Intervallzeiten bis zum Wiedereinbau.
Eine (postoperative) Fokussuche nach der Quelle der Infektion ist für den weiteren Verlauf der Infektion zwingend notwendig, um einer Reinfektion vorzubeugen.
Im Folgenden wird ein kurzer Überblick über Einteilung, Diagnostik und Therapie von periprothetischen Infektionen (PPI) entsprechend dem neuesten Stand der Wissenschaft gegeben.
Definition
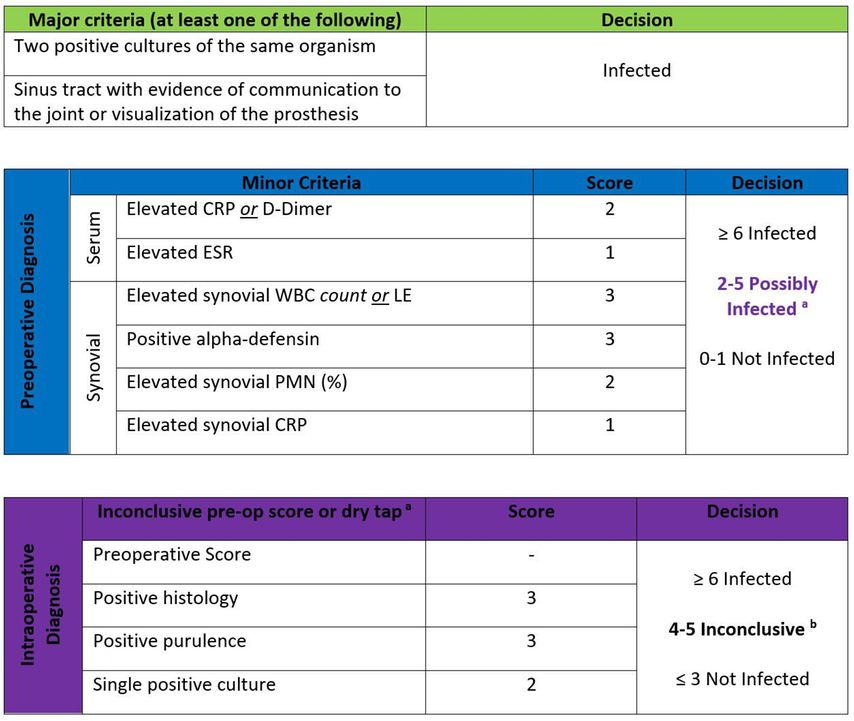
War die Definition der PPI bis vor einigen Jahren sehr uneinheitlich, so wird sie heute mehrheitlich entsprechend den Kriterien der Musculoskeletal Infection Society (MSIS) definiert. Hierbei wurden Major- und Minor-Kriterien definiert, die für das Vorliegen einer PPI beweisend sind (Tab.1).
Einteilung und therapeutische Konsequenz
Eine rasche PPI-Diagnostik mit hoher Sensitivität und Spezifität ist für den weiteren Behandlungserfolg entscheidend. Ein diagnostischer Algorithmus sollte dabei befolgt werden.
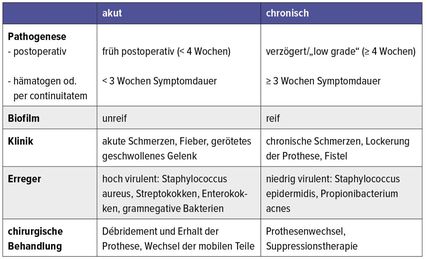
Tab. 2: PPI-Einteilung akut vs. chronisch (Quelle: Pro-Implant Foundation: Pocket Guide to Diagnosis & Treatment of Periprosthetic Joint Infection)
Die allgemein gebräuchliche Einteilung in 3 Zeitperioden (Frühinfekt bis ca. 8–12 Wochen postoperativ; verzögerter Low-grade-Infekt 3–24 Monate postoperativ; hämatogener Spätinfekt) ist zur weiteren Abklärung und Therapie hilfreich, da sowohl Rückschlüsse auf die Entstehungsursache der Infektion als auch das vermutete Keimspektrum gezogen werden können. Die therapeutische Relevanz dieser Einteilung ist dagegen oft nicht gegeben, da der alles entscheidende Faktor die Biofilmbildung auf der Prothese ist. Deshalb ist die Unterscheidung zwischen akutem und chronischem Infekt – abhängig vom Beginn der Symptome – klinisch interessanter, da sich daraus unmittelbare therapeutisch-chirurgische Konsequenzen ergeben.
Tabelle 2 (aus dem Pocket Guide der Pro-Implant Foundation) gibt einen schönen Überblick über den Unterschied bei Klinik, Erreger und Therapie zwischen akutem und chronischem Protheseninfekt abhängig von der Pathogenese.
Perioperativer Frühinfekt
Diese Infektion stellt sowohl in Diagnostik als auch Therapie die mitunter herausforderndste Form des PPI dar. Ein entscheidender Risikofaktor ist der Chirurg selbst, der oft noch nicht wahrhaben möchte, dass persistierende Sekretion, Rötung und Wundheilungsstörung auf einen Frühinfekt hinweisen. Oft wird mehrere Tage lang antibiotisch behandelt, bevor man sich zu einem radikaleren Vorgehen („débridement, antibiotics and implant retention“, DAIR) entschließt. Diese Verzögerung führt allerdings häufig zur Bildung des Biofilms, weshalb ein DAIR-Konzept oft nicht mehr ausreichend ist. Die Strategie zur Behandlung dieses Infektes muss ein frühzeitiges DAIR-Konzept ohne Verzögerung sein. Nur so kann dem Biofilm rechtzeitig vorgebeugt und ein späterer Prothesenwechsel vermieden werden!
Chronischer Low-grade-Infekt
Zumeist handelt es sich um Infektionen mit wenig virulenten Keimen, typischerweise Propionibacterium acnes oder koagulasenegative Staphylokokken (mitunter in einer multiresistenten Form). Die Patienten haben typischerweise häufig schon monatelang, mitunter seit der Operation, Schmerzen. Diese Infektionen sind in der Diagnostik am schwierigsten zu erfassen, da die Keime durch Gelenkspunktionen oft nicht gefunden werden können. Hier muss eine konsequente diagnostische Abklärung erfolgen, wobei die laborchemischen Infektparameter meist negativ sind, im Röntgen oft keine Lockerungszeichen sichtbar sind und lediglich die Synovialanalyse mit erhöhter Zellzahlbestimmung hinweisend auf eine Infektion ist, häufig einhergehend mit einem positiven Alpha-Defensin-Test.
Mitunter zeigt sich präoperativ keinerlei Hinweis auf einen Low-grade-Infekt, weshalb immer behandelt werden sollte, als ob es ein Infekt wäre. Intraoperativ ist deshalb die Abnahme mehrerer Gewebeproben unterschiedlicher Lokalisation zur Kulturgewinnung bzw. PCR-Testung notwendig. Das Einsenden der entfernten Implantate zur Sonikation ist essenziell.
Hämatogener akuter (Spät)infekt
Akute hämatogene Infektionen, die praktisch zu jedem Zeitpunkt auftreten können und klinisch fulminant verlaufen, lassen sich in der Regel einfach diagnostizieren. Die klassischen Entzündungszeichen einer Rötung, Schwellung, Überwärmung und schmerzhafter Bewegungseinschränkung, verbunden mit deutlich erhöhten Entzündungslaborwerten, führen zur Diagnose. Abgesichert werden muss dies zwingend mit einer Gelenkspunktion zur Zellzahlbestimmung und mikrobiologischen Aufarbeitung zwecks Erregernachweis und Resistenzbestimmung sowie, wenn vorhanden, molekularbiologischer PCR-Bestimmung.
Diagnose
Generell sollte die Diagnostik klaren algorithmischen Abklärungsschritten folgen. Die Basisuntersuchung besteht aus Anamnese, klinischer Untersuchung und Bildgebung mittels Röntgen. Aus einer umfassenden Anamnese können bereits häufig Rückschlüsse gezogen werden. Persistierende Schmerzen seit der Implantation, postoperative Wundheilungsstörungen oder Serombildungen, eitrige Zähne, rezidivierende Harnwegsinfekte, Prostatitiden, Pneumonien oder chronische Darmentzündungen sind zu erfragen. Auch allgemeine Risikofaktoren, wie Diabetes mellitus, Immunsuppressionstherapien oder eine rheumatoide Arthritis, können Hinweise geben.
Daneben ist die Klinik sehr aufschlussreich. Ein überwärmtes, gerötetes, schmerzhaftes und bewegungseingeschränktes Gelenk gehört abgeklärt. Wundheilungsstörungen, offene Wunden oder Interdigitalmykosen sind risikobehaftet. Eine Fistel bedeutet immer: Infekt!
Sehr häufig stellt sich eine vermeintlich aseptische Prothesenlockerung schlussendlich als Infekt dar und die Behandlungsstrategie war eine falsche. Es gilt, diejenigen Fälle herauszufiltern, bei denen durch klinische, radiologische und laborchemische Parameter nicht klar zwischen aseptisch und septisch unterschieden werden kann, da sich der infektauslösende Keim in sessiler Form im Biofilm befindet. Zumeist sind die Infektlaborparameter unauffällig und die Synovialanalyse sowie die bakteriologischen Befunde der Gelenkspunktion negativ. Diese Infektionen können sehr häufig nur aus den intraoperativen Gewebeproben und der Sonikation mit hoher Wahrscheinlichkeit erkannt werden.
Im Folgenden nun die weiteren Abklärungsschritte nach ihrer Wichtigkeit bzw. ihrer vorwiegenden Chronologie.
Präoperative Abklärungsschritte
Laborparameter
Neben dem Blutbild mit Leukozytenerhöhung ist das CRP als wichtigster Infektlaborparameter zu sehen. Leider sind sowohl Spezifität als auch Sensitivität relativ niedrig. Vor allem bei Low-grade-Infekten ist der CRP-Wert sehr häufig falsch negativ. Zusätzlich hat sich das Interleukin 6 (IL-6) aufgrund der hohen Sensitivität als bedeutsamer Parameter erwiesen.
Gelenkspunktion
Die präoperative Gelenkspunktion ist zur Diagnostik und Keimsicherung essenziell! Die Punktion hat unter sterilen Bedingungen zu erfolgen und wenn möglich nach zumindest zweiwöchiger Antibiotikumkarenz. Eine Hüftpunktion sollte röntgengezielt durchgeführt werden, da hiermit eine Punctio sicca so gut wie ausgeschlossen ist. Oft kann bereits das Aussehen der Flüssigkeit hinweisgebend auf die Differenzialdiagnose sein. Die Flüssigkeit muss zur Synovialanalyse und mikrobiologischen sowie, wenn vorhanden, molekularbiologischen Aufarbeitung versandt werden.
Synovialanalyse: Hierbei sind als wichtigste Analysewerte die Leukozyten-Zellzahl sowie der Anteil der Granulozyten zu bestimmen. Als Differenzialdiagnose und Zusatzinformation kommen ein evtl. Nachweis von Harnsäurekristallen bzw. Pseudoharnsäure sowie von Abriebpartikeln und eine Gramfärbung bei hoher Zellzahl infrage. Zusätzlich ist in den letzten Jahren der leicht anwendbare Alpha-Defensin-Test als Abklärungsparameter hinzugekommen. Obwohl die Sensitivität deutlich unter 100% liegt, ist dieser Test aufgrund seiner einfachen Handhabung aus der Diagnostik der PPI nicht mehr wegzudenken.
Mikrobiologie und Molekurlabiologie: Die mikrobiologische Aufarbeitung in Kultur und (bei Vorhandensein) mittels PCR stellt wohl den wichtigsten diagnostischen Abklärungsschritt dar, um Keime identifizieren zu können. Erst wenn man den Keim mit seiner Resistenzbestimmung kennt, kann man gezielt antibiotisch dagegen vorgehen und erhöht die Heilungswahrscheinlichkeit deutlich.
Bildgebung
Das konventionelle Röntgen gehört zu jeder Abklärung und ist nach wie vor eine wichtige Hilfe. Hierbei kann man eine Prothesenlockerung, die immer Hinweis auf einen Infekt sein kann, zumeist gut erkennen. Eine radiologische Unterscheidung zwischen aseptisch und septisch ist kaum möglich, wobei man bei Kenntnis der radiologischen Eigenschaften diverser Prothesen/Gleitpaarungsvarianten oft bereits von einer wahrscheinlichen aseptischen Lockerung (z.B. bei Metallosen oder Polyethylen-Abrieb) ausgehen kann. Wolkige, blasige Aufhellungssäume um die Prothese sind oft hinweisgebend auf ein septisches Geschehen.
Auch die CT-Untersuchung und das MRI spielen in der PPI-Diagnose eine gewisse Rolle. Das CT detektiert Eiterherde und ist zum Ausschluss und zur Differenzialdiagnostik anderer Schmerzursachen (z.B. Metallosen, PE-Abrieb oder Prothesenlockerungen) hilfreich, vor allem im Hüftgelenksbereich.
„Metal artifact reduction sequence“ (MARS)-MRI-Untersuchungen haben in den letzten Jahren an Bedeutung gewonnen. Einige Autoren berichten über hohe Übereinstimmungen von gefundenen Phänomenen (Periostreaktion, intramuskuläre und periartikuläre Ödemen etc.) und PPI.
Nuklearmedizinische Verfahren
Sämtliche Techniken (Skelettszintigrafie, Granulozytenszintigrafie sowie PET-CT) können vor allem bei unklaren chronischen Infektionen zur Anwendung kommen. Alle Methoden gelten im Allgemeinen als sehr unspezifisch bei jedoch hoher Sensitivität und können in Zusammenschau der Befunde den entscheidenden Hinweis auf eine Infektion geben, spielen aber eine eher untergeordnete Rolle in der Diagnostik der PPI.
Intraoperative Abklärungsschritte
Histologie/Schnellschnitthistologie
Eine intraoperative Histologie ist bei jeder Revisionsoperation durchzuführen und eine positive Histologie ist nach wie vor als sicheres Zeichen des Infektnachweises anzusehen. Sollte präoperativ Unklarheit herrschen, ob ein aseptisches oder septisches Geschehen vorliegt, so ist eine Schnellschnitthistologie hilfreich, um intraoperativ noch rechtzeitig die Operationsstrategie ändern zu können.
Mikrobiologie und Molekularbiologie (Kultur und PCR)
Neben der präoperativen Gelenkspunktion sind mehrere intraoperative Proben aus verschiedenen (zumindest 4) Gewebestrukturen abzunehmen. Die PCR bringt vor allem einen Mehrwert bei antibiotisch vorbehandelten Patienten, hat eine höhere Sensitivität und bringt ein schnelleres Ergebnis. Wichtig ist eine mindestens 14-tägige Bebrütung der Kultur!
Sonikation
Die Sonikation ist aus der PPI-Diagnostik und vor allem zum Keimnachweis nicht mehr wegzudenken. Sämtlich explantierten Prothesenanteile sollen zur Sonikation versandt werden. Low-grade-Infekte können dadurch mit einer deutlich höheren Wahrscheinlichkeit diagnostiziert und die Keime identifiziert werden.
Häufige Fehler
-
zu wenig Material in der Punktion (Punctio sicca)
-
zu wenig Gewebematerial für die Kultur
-
mit Breitbandantibiotikum zu früh anbehandelt (dadurch kein Keimnachweis)
keine Sonikation
Therapie
Prinzipiell muss jeder Infekt individuell gesehen und behandelt werden. Sehr wohl gibt es aber Behandlungskonzepte, die je nach Infekteinteilung (siehe oben) und je nach Kenntnis des Keimes zur Anwendung kommen sollten. Jedes Behandlungskonzept ist trotz allem patientenspezifisch individuell festzulegen. Patientenspezifisch bedeutet, dass man in Zusammenschau von (biologischem) Alter, Vorerkrankungen und Voroperationen, dem Wunsch des Patienten und nicht zuletzt dem kurativen oder palliativen Ansatz der Behandlung die operative/konservative Therapie festlegen muss. Im Folgenden die wichtigsten operativen Behandlungsstrategien.
DAIR
Das DAIR-Konzept ist ein lange erprobtes Therapiekonzept und hat in den letzten Jahren wieder an Zuspruch gewonnen – und das sehr berechtigt. Zur Anwendung kommen kann es bei postoperativen Frühinfekten und bei akuten Spätinfekten. Die definierten Zeiträume sind in der Literatur sehr unterschiedlich beschrieben, allerdings sollte vor allem bei akuten Spätinfekten die Schmerzanamnese nicht viel länger als eine Woche andauern, da sich der Biofilm sehr rasch ausbildet und eventuell schon das Interface Knochen/Implantat betroffen ist. Entscheidend sind in jedem Fall die Radikalität des Débridements und die ausgiebige Lavage. Zusätzlich müssen die mobilen Komponenten zwingend getauscht werden! Mehrere Studien belegen eine erhöhte Versagensquote, wenn auf den Wechsel der mobilen Komponenten verzichtet wird.
Sollte das DAIR-Konzept initial nicht den gewünschten Erfolg bringen, ist ein neuerliches Vorgehen nach diesem Konzeptzwar grundsätzlich möglich, es empfiehlt sich allerdings ein Strategiewechsel auf den ein- oder zweizeitigen Prothesenwechsel.
Einzeitiger Prothesenwechsel
Der einzeitige Prothesenwechsel war bis vor wenigen Jahren in den meisten vergleichenden Publikationen dem zweizeitigen Wechsel bzgl. der Infektausheilungsrate um einige Prozentpunkte unterlegen. Heute ist der einzeitige Wechsel aufgrund der besseren Kenntnis über die Pathogenese der Infektion eine neue Erfolg versprechende Alternative zum zweizeitigen Wechsel geworden, jedoch müssen gewisse Voraussetzungen gegeben sein. Dazu gehören die Kenntnis des Keimes und ein gutes Ansprechen des Keimes auf antibiotische Behandlung. Klassische Anwendung findet dieses Vorgehen bei Frühinfekten sowie bei akuten Spätinfekten mit guten Weichteil- und Knochenverhältnissen. Auszuschließen ist dieses Vorgehen bei „Difficult to treat“(DDT)-Keimen, Fistelbildungen und fulminantem Infekt.
Zweizeitiger Prothesenwechsel
Der zweizeitige Wechsel galt bis vor wenigen Jahren als Goldstandard in der Therapie der septischen Prothese und wird auch heute noch flächendeckend als die erfolgreichste Therapieoption angesehen. Tatsächlich kann mit diesem Therapieregime der Infekt mit der höchsten Wahrscheinlichkeit ausgeheilt werden, allerdings gibt es auch erhebliche Nachteile! Neben den allgemein deutlich erhöhten Kosten der Therapie sind hier die verlängerte Hospitalisierungszeit, der Nachteil von zumindest zwei Operationen, die für die Patienten oft mühsame Intervallzeit zwischen den Operationen mit Spacer- Platzhalterprothesen oder Girdlestone-Zustand sowie auch die nicht unerheblichen Komplikationen mit den Spacern selbst zu nennen.
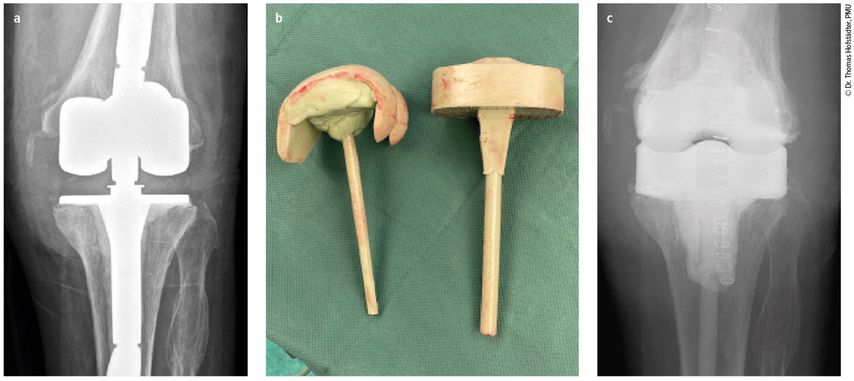
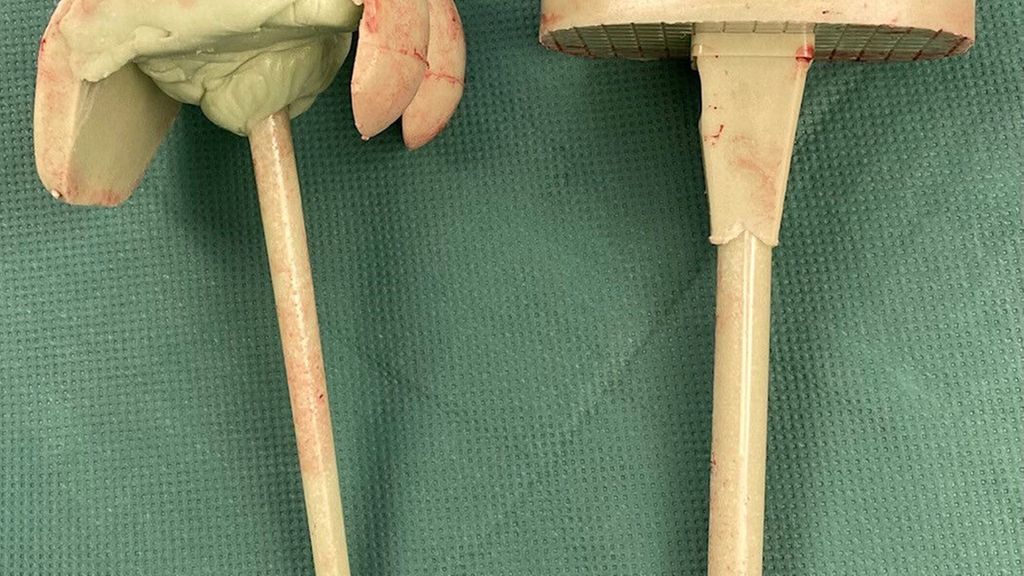
Die Vorteile der Spacer oder Zementplomben im zweizeitigen Intervall liegen klar in der kontinuierlichen Abgabe von Antibiotika, die zum Teil auch individuell beigemischt werden können. Zusätzlich können mobile Spacer auch nach mehreren Revisionen dem Knochendefekt individuell angepasst werden, wodurch sich die Mobilität in der Intervallzeit erhöht (Abb.1). Die Weichteile und das Knochengewebe können sich in der Intervallzeit erholen und so sieht man beim geplanten Wiedereinbau zumeist ein infektfreies, unauffälliges Gewebe.
Klassische Anwendung findet der zweizeitige Wechsel beim Low-grade-Infekt, bei Spätinfekten ohne Keimkenntnis, bei DTT-Keimen, bei fulminanten Infekten, bei vorhandenen Fistelbildungen und bei unklarem Infektgeschehen ohne Keimnachweis.
In jedem Fall hat sich die Intervallzeit in den letzten Jahren deutlich reduziert. Waren es vor wenigen Jahren noch ca. 3 Monate bis zum Wiedereinbau, so hat sich in den letzten Jahren eine Intervallzeit von ca. 2–6 Wochen etabliert. Hierbei sollte die antibiotische Therapie bis zum und über den Wiedereinbau hinweg weitergehen; eine antibiotische Pause ist nicht vorgesehen. In diesem Zusammenhang wird auf die Empfehlung zum chirurgischen Vorgehen der Pro-Implant Foundation verwiesen, wobei immer auf die klinikinternen Richtlinien und Erfahrungen Rücksicht genommen werden sollte. Oft ist es schlicht aus organisatorischen Gründen nicht möglich, ein kurzes Intervall zu implementieren bzw. sind den Patienten zwei Operationen in kurzem Abstand nicht zumutbar. Allzulange darf allerdings nicht zugewartet werden, da sich einerseits die Komplikationen mit den Spacern häufen und andererseits diese auch als biofilmbildende Fremdkörper gesehen werden.
Antibiose
Die gezielte antibiotische Behandlung ist für die erfolgreiche Ausheilung der Infektion genauso entscheidend wie das chirurgische Vorgehen. Wichtig sind die Kenntnis des Keimes und die dazugehörige Resistenzbestimmung. Welches Antibiotikum wie lange und wie (p.o. oder i.v.) gegeben werden soll, ist individuell festzulegen. Allerdings gibt es auch hier ganz klare Behandlungsempfehlungen der verschiedenen infektiologischen Gesellschaften. Dringend zu empfehlen ist die interdisziplinäre Behandlung zusammen mit Infektiologen, idealerweise im Rahmen eines Infektboards.
Häufige Fehler
-
falsche operative Strategie
-
arthroskopische Spülung
-
inadäquates Débridement und Lavage
falsche antibiotische Behandlung
Anmerkung
In jedem Fall sollte bei jeder Infektion eine Fokussuche zwingend durchgeführt werden! Woher kann die Infektion stammen, wo liegt die potenzielle Infektionsquelle? Zur Abklärung gehören u.a. Erhebung des Zahnstatus, Harnuntersuchung, HNO-Untersuchung sowie Herz- und Abdomen-Ultraschall und Thoraxröntgen.
Unsere Klinik arbeitet gerade an der Implementierung einer Infektionskarte, die sämtliche relevante Daten eines Infektpatienten enthält (hierbei werden alle Infekte eingeschlossen, ob Protheseninfekt, septisch diabetischer Fuß, Weichteilinfekt etc.) und die übersichtlich im medizinischen Programm abgerufen werden kann. Dies soll die qualitative Behandlung der Patienten weiter verbessern, da man einen raschen und übersichtlichen Blick über die wichtigsten Parameter des zu behandelnden Patienten hat. Gerne stellen wir dieses Konzept im Rahmen einer der nächsten Ausgaben vor.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Periphere Nervenkompressionssyndrome der oberen Extremität
Periphere Nervenkompressionssysteme der oberen Extremitäten sind verhältnismäßig häufig, insbesondere der Nervus medianus und der Nervus ulnaris sind oft im Bereich des Hand- bzw. ...
Konservative Behandlungsmöglichkeiten bei peripheren Nervenläsionen
Eine periphere Nervenläsion erfordert nicht nur eine Dekompression, Naht oder Rekonstruktion. Um Gelenke beweglich zu erhalten, eine Atrophie der Muskulatur zu verhindern und die ...
Bildgebende Diagnostik des peripheren Nervensystems
Die komplexen Nerventopografien machen die Nervenbildgebung zu einer fordernden Aufgabe, die allerdings eine wichtige Rolle dabei spielt, eine funktionelle Wiederherstellung der ...