Behandlung implantatbezogener Infekte an der Schulter
E-Mail: markus.wambacher@tirol-kliniken.at
Universitätsklinik für Unfallchirurgie und Sporttraumatologie, Innsbruck
Universitätsklinik für Unfallchirurgie, <br>Medizinische Universität Innsbruck
Postoperative Infekte an der Schulter mit Biofilmbildung auf Implantaten oder Prothesen sind schwerwiegende Komplikationen. Daher ist das Wissen, wie diese zu vermeiden, zu erkennen und zu behandeln sind, von großer Wichtigkeit.
Keypoints
-
Patientenselektion und Prophylaxe bei Implantaten oder Prothesen an der Schulter und das Wissen um die Biofilmbildung sind wichtig.
-
Unterscheidung und Erkennen von akuten und Low-grade-Infektionen und das Wissen um die Diagnostik (Gewebeproben, Langzeitbebrütung, Sonikation) sind erforderlich.
-
Die Behandlung ist immer chirurgisch und antibiotisch und in Zusammenarbeit mit Hygiene und Infektiologie durchzuführen.
In der Literatur wird bei Verwendung von Implantaten und Prothesen eine Infektrate von 1–10% beschrieben. Viele Bakterien bilden im Fall einer Infektion einen sogenannten Biofilm auf Implantaten, der den Erreger dann gegen Antibiotika und die körpereigene Abwehr unempfindlich macht.1,2 Um die Infektion zu beherrschen, müssen Implantat oder Prothese entfernt oder ausgebaut werden.
Patientenselektion
Bei geplanten Operationen, wie der Implantation einer Schulterprothese, muss der Patientenstatus evaluiert werden. So haben Patienten mit Alkohol- und Nikotinabusus ein höheres Risiko für eine Infektion, ebenso Patienten mit Stoffwechselerkrankungen wie Diabetes mellitus oder koexistierenden Infekten oder einer Schwäche des Immunsystems. Weiters sind ein MRSA-Screening sowie eine Überprüfung und gegebenenfalls Sanierung des Zahnstatus vor der Schulteroperation sinnvoll.
Prophylaxe
Vorrangiges Ziel bei der Implantation ist es, die Kontamination mit Biofilmbildnern durch eine effiziente Prophylaxe zu verhindern und im Falle eines Verdachtes auf eine früh oder meist verzögert auftretende Infektion dem folgenden standardisierten Protokoll zu folgen:
-
Gabe eines Cephalosporins der 2. Generation, z.B. Cefuroxim 1,5g einmal 30–60 Minuten vor OP-Beginn (nicht später!). Der Zeitpunkt ist wichtig, da bei einer späteren Gabe das Implantat nur ungenügend vor einer Kontamination geschützt wird.
-
Dauert die Operation länger als 2 Stunden,soll eine nochmalige intraoperative (i.v.) Gabe erfolgen.
-
Postoperative AB-Gabe: Bei Standardoperation unter Verwendung von Implantaten soll nur eine Single-Shot-Gabe erfolgen; bei offenen Verletzungen Antibiotikagabe bis zum Vorliegen des Ergebnisses der intraoperativ genommenen Gewebeproben. Beim Einsetzen einer Schulterprothese wird neuerdings nur noch eine Prophylaxe von 24 Stunden empfohlen.3 Bei Vorliegen einer MRSA-Infektion/Besiedelung soll Vancomycin, bei einer Betalactamallergie Vancomycin oder Clindamycin gegeben werden. Im Falle einer Revision muss das Antibiotikum bis zum Einlangen der Ergebnisse der Gewebeproben gegeben werden, bei positivem Befund in Absprache mit der Infektiologie Beginn einer dem Antibiogramm entsprechenden Antibiotikatherapie.
Hautdesinfektion: Vor der eigentlichen Hautdesinfektion soll eine Vorreinigung mit Alkohol erfolgen, anschließend Verwendung eines Chlorhexitingluconat-(CHG)-hältigen Desinfektionsmittels. Besonders wirksam gegen eine Kontamination mit Cutibacterium (früher Proprionibacterium) acne hat sich in einer Studie die Verwendung von Benzylperoxiden (BPO) erwiesen.4 Hingegen hat die Verwendung von Plastikfolien keinen signifikanten Effekt zur Verhinderung einer Kontamination. Trotzdem bietet unserer Ansicht nach die Verwendung zusätzlicher Folienstreifen einen Schutz vor dem Ablösen der Abdeckung.
Pathogenese1,2
Eine Biofilmbildung auf dem Implantat entsteht innerhalb von Stunden. Im Biofilm kommt es zur ungehinderten Vermehrung des Bakteriums, das dann aus dem Biofilm freigesetzt wird und die Entzündung in Gang hält.Ein Aufbrechen und Beseitigen des Biofilms ist nur in den ersten Tagen bis Wochen (Grenze ca. 3 Wochen) nach der Operation – das heißt bei akut postoperativ auftretenden Infekten– möglich. Bei Low-grade-Infektionen ist dies in aller Regel nicht möglich. Der Nachweis von Erregern gelingt mit der Sonikation der Implantate.
Klassifikation von Infekten5,6
Frühinfekt
<3 Monate postoperativ; verursacht durch Kontamination während der Operation; typische Infektzeichen wie Fieber, Rötung, Schwellung, Schmerz, gestörte Wundheilung, Fistel (Abb.1). Im Labor sind Leukos und CRP erhöht. Die verursachenden Keime sind hoch virulent: Staph. aureus, Streptokokken, gramnegative Keime.
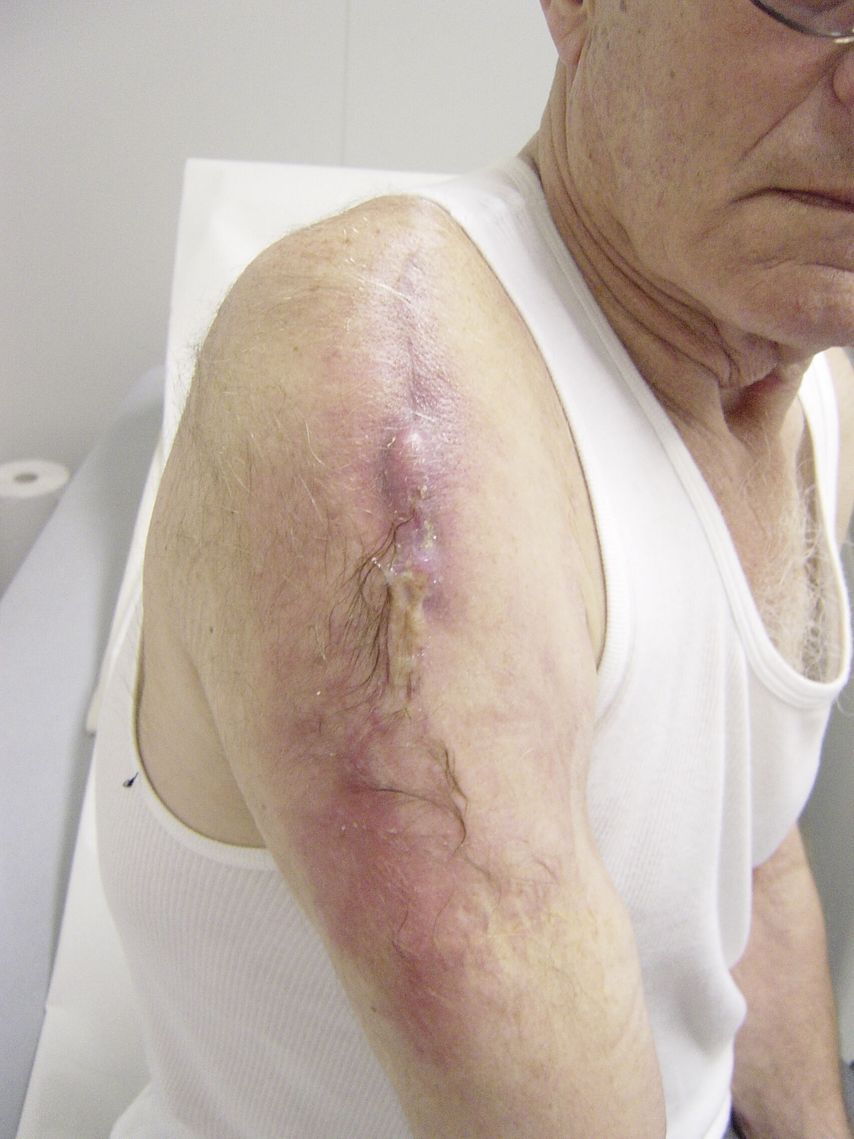
Abb. 1:Fistelbildung bei akutem, aber verzögert diagnostiziertem Schultergelenksinfekt nach Implantation einer inversen Prothese
Verzögerter (Low-grade-)Infekt
3–24 Monate postoperativ, teilweise auch später; verursacht durch Kontamination während OP; geringe klinische Zeichen (persistierender Schmerz, Lyse um Implantate/Prothesen); Differenzialdiagnose: aseptische Lockerung. Die Keime sind gering virulent: koagulasenegative Staphylokokken, Cutibacterium acne.
Spätinfekt
>24 Monate postoperativ; verursacht durch hämatogene Streuung; akute oder subakuteInfektzeichennach einer Bakteriämie; ist zu behandeln wie ein Frühinfekt!
Kontamination ohne Zeichen einer Infektion
Z.B. Keimnachweis bei Revision.
Diagnostik und Therapie bei Verdacht auf implantatbezogene Infektion
Vor der Aspiration oder Revision keine Antibiotikagabe, bei Verdacht auf Low-grade-Infektion 2 Wochen vor der Revision keine Antibiotikagabe. Ansonsten könnte der Keimnachweis in der Gewebeprobe bei der Revision falsch negativ sein!
Beim Aspirationsversuch (Sensitivität 45–100%) sollte das Punktat zügig an die Hygiene geschickt und aufgearbeitet werden: Gramfärbung und Kulturen (aerob, anaerob) mit Langzeitbebrütung (1–2 Wochen).Mittels PCR (Polymerasekettenreaktion) gelingt der Nachweis der DNA von Bakterien innerhalb von Stunden, allerdings lässt sich dabei bis dato kein Antibiogramm erstellen.
Das Labor (BB, CRP) ist nur im Verlauf und bei Frühinfekten aussagekräftig, beim Low-grade-Infekt sind die Werte meist im Normbereich oder minimal erhöht, die Leukozytenzahl ist teilweise sogar erniedrigt. Einen Hinweis auf eine bakterielle Infektion kann die Erhöhung des Procalcitonin geben.
Röntgenbilder und die CT können eine Implantatlockerung („radiolucent lines“) zeigen, differenzialdiagnostisch muss man auch an eine aseptische Lockerung denken. Periostale Reaktionen, Retentionen und/oder Gaseinschlüsse können ein Hinweis auf eine Infektion sein. Im Ultraschall lassen sich Retentionen nachweisen, außerdem bietet der Ultraschall die Möglichkeit, als Guide für Punktionen und Aspirationen zu dienen. Szintigrafie, MRT und PET-CT haben zwar eine hohe Sensitivität, aber nur eine niedrige Spezifizität.
Die Untersuchung von Gewebeproben aus den Weichteilen um Implantate oder Prothesen ist beim Infektverdacht das Nachweisverfahren der Wahl (60–94% positiv)! Es sollen 3–6 Gewebeproben aus verschiedenen Kompartimenten gewonnen werden. Die Gewebeproben werden steril in NaCl-Flüssigkeit (kein Blut – antibakteriell) verpackt (Eprouvetten) und unmittelbar zur Hygiene zur Anlage einer Kultur gebracht.Auf den Überweisungsscheinen (einem pro Probe) werden die Gewebeproben nummeriert und bezeichnet (z.B. Gewebe 1: Subcutis, Gewebe 2: Kapsel usw.). Auf der Rückseite der Zuweisung werden „Untersuchung auf pathogene Keime“ und „Langzeitbebrütung“ angekreuzt. Wichtig ist, dass vor Gewebeentnahme keine Antibiotika gegeben werden: bei geplanten Revisionen kein Antibiotikum 14 Tage vor der OP.
Abstriche sind wegen der geringen Sensitivität obsolet, insbesondere Abstriche oder Proben von oberflächigen Wunden oder Fisteln, da diese durch Kontamination mit Hautkeimen falsch positiv sein könnten.
Abfragen der Befunde nach 48 Stunden (nach 24 Stunden Vorbefund bei dringenden Therapieentscheidungen, evtl. PCR).Nach 7 Tagen liegt das Ergebnis der Langzeitinkubation vor. Zusätzlich zu den Gewebeproben soll eineSonikation der entnommenen Implantate durchgeführt werden.3 Der bei der Sonikation verwendete Ultraschall bricht den Biofilm auf dem Implantat auf. Oft wird es erst damit möglich, schwer nachweisbare Keime zu detektieren.
Behandlungsalgorithmus nach Trampuz/Zimmerli5,6
Die Behandlung implantatbezogener Infekte muss immer chirurgisch und mit einer gezielten Antibiotikatherapie erfolgen. Ziele sind die Elimination (Eradikation) des Infektes und möglichst die Wiederherstellung einer schmerzfreien Funktion! Ein alleiniges Débridement mit Belassung des Implantates oder der Prothese ist evtl.beim Frühinfekt möglich.Der Biofilm lässt sich in diesem Zeitraum noch vom Implantat entfernen, allerdings: Je früher die Revision erfolgt, desto erfolgreicher ist die Bekämpfung des Infektes ohne Implantatausbau. Bei Platten mechanisches Reinigen mit Bürste, bei Prothesen Spülung – hier keine mechanische Reinigung (die Oberfläche würde dabei zerstört werden!). Immer Débridement des Gewebes um das Implantat oder die Prothese. In allen anderen Fällen sind das Débridement und der Implantatausbau notwendig! Ein alleiniges Débridement mit Belassung des Implantates oder der Prothese ist auch beim Spätinfekt (hämatogene Streuung) mit stabilem Implantat ohne Fistel möglich.
Prinzipiell kann bei infizierter Prothese ein einzeitiger Wechsel durchgeführt werden. Dies wird auch teilweise empfohlen.3 An unserer Abteilung werden die Wechsel allerdings fast immer zweizeitig durchgeführt. Unserer Meinung nach hat der zweizeitige Wechsel den Vorteil einer kürzeren Operationszeit pro Operation. Ist präoperativ noch kein Keimnachweis erfolgt, bleibt der Verdacht eines Low-grade-Infekten mit dem Risiko einer Keimbesiedelung der neu implantieren Prothese.Muss ein zementierter Schaft ausgebaut werden, sollte immer ein Split des Humerus durchgeführt7 und anschließend die Prothese mit dem gesamten Zement (Fremdkörper) entfernt werden. Ein unkontrolliertes Herausschlagen des Schaftes birgt die Gefahr multipler iatrogener Schaftfrakturen. Bei schonendem Vorgehen mit Humerussplit wird der Schaft anschließend cercliert und der Spacer eingesetzt. Bei zweizeitigem Vorgehen kann die neue Schaftkomponente meist zementfrei eingesetzt werden.Beieinzeitigem Wechsel muss neuerlich zementiert werden, dabei besteht vor allem bei iatroger Schaftsprengung trotz Cerclagen die Gefahr des Zementaustrittes.
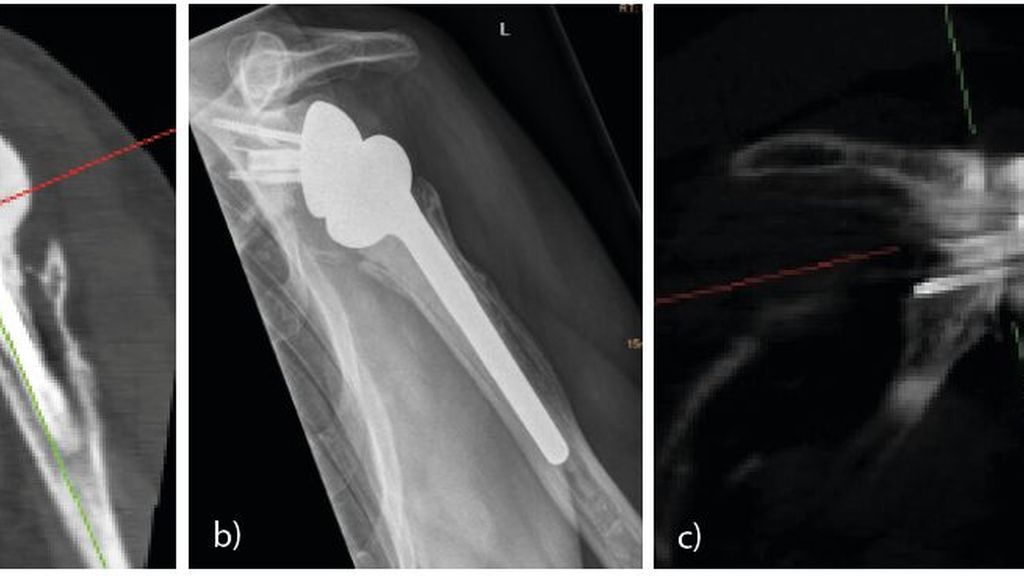
Beim Ausbau der Glenoidkomponente entstehen oft beträchtliche Glenoiddefekte (Abb.2a). Hier hat der zweizeitige Wechsel den Vorteil, dass der Wiederaufbau des Glenoides mittels CT exakt am 2D- oder 3D-Modell geplant werden kann (Abb.2a–c).Mit einer speziellen Software können der Pfannenaufbau geplant und Implatation-Schablonen und -Guides produziert werden.
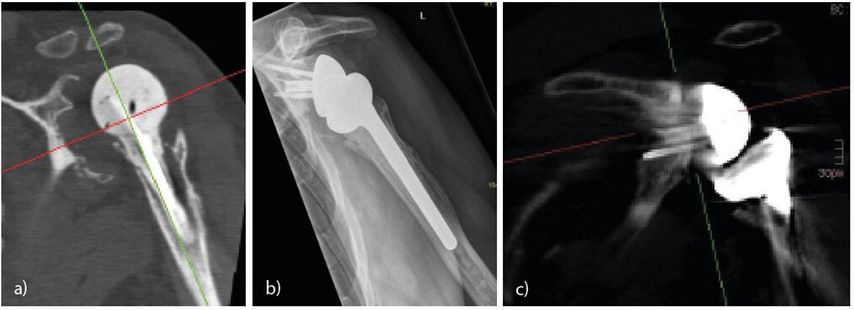
Abb. 2: a) 2D-Rekonstruktion nach Ausbau einer infizierten Inversprothese mit massivem Glenoiddefekt; b) Röntgen nach Wiedereinbau der inversen Prothese und Glenoidaufbau (Allograft); c) 2D-Rekonstruktion nach Glenoidaufbau mit eingeheiltem Allograft 3 Jahre postoperativ
Beim zweizeitigen Wechsel gibt es die Möglichkeit, den Wechsel mit kurzem Intervall (2–4 Wochen) durchzuführen, wenn ein Keim vorliegt, der gut mit Rifampicin oder einem ähnlichen Antibiotikum behandelt werden kann, womit die neu eingesetzte Prothese vor Keim und Biofilmbildung geschützt ist. Es wird bei der Erstoperation nach dem Ausbau und dem gründlichen Débridement ein antibiotikabeladener Spacer eingesetzt. Anschließend wird postoperativ und nach Keimnachweis eine gezielte Antibiotikatherapie gestartet. Die Reimplantation wird wie oben angegeben unter Antibiotikaschutz durchgeführt.
Bei Problemkeimen, die unempfindlich gegenüber Rifampicin sind, oder bei chinolonresistenten, grampositiven Bakterien oder Enterokokken ist ein zweizeitiger Wechsel mit langem Intervall (mindestens 8 Wochen) indiziert (Osteomyelitisbehandlung). Wie beim einzeitigen Wechsel wird ein Spacereingesetzt und eine mindestens 6-wöchige Antibiose verabreicht. Vor der Reimplantation muss mit dem Antibiotikum 2 Wochen pausiert werden und erst nach Entnahme von Gewebeproben und Spacer (Sonikation) wird die Antibiotikatherapie fortgesetzt.
Die Planung der Antibiotikatherapie, vor allem der Langzeittherapie, sollte unbedingt in Zusammenarbeit mit den Ärzten der Infektiologie erfolgen. Eine Standardantibiotikatherapie (z.B. Monotherapie mit Cefuroxim) ist beim implantatbezogenen Infekt zu wenig! Meist ist eine Kombinationstherapie mit Rifampicin, Chinolonen, Fucidin (Fusidinsäure) oder Linezolid (Zyvoxid) notwendig.5,6
Literatur:
1 Costerton JW et al.: Bacterial biofilms: a common cause ofpersistent infections. Science 1999; 284: 1318-22 2 TrampuzA et al.: Sonication of removed hip and knee prostheses for diagnosis of infection. N Engl J Med 2007;357(7): 654-63 3 Garrigues GE et al.: Proceedings from the 2018 International Consensus Meeting on Orthopedic Infections: evaluation of periprosthetic shoulder infection. J Shoulder Elbow Surg 2019; 28(6S): S32-S66 4 Kolakowski L et al.: Neer Award 2018: Benzoyl peroxide effectively decreases preoperative Cutibacterium acnes shoulder burden: a prospective randomized controlled trial. J Shoulder Elbow Surg 2018; 27(9): 1539-44 5 Zimmerli W et al.: Prosthetic-joint infections. N Engl J Med 2004; 351(16): 1645-54 6 Trampuz A, Zimmerli W: Diagnosis and treatment of infections associated with fracture-fixation devices. Injury 2006; 37(Suppl 2): S59-66 7 Gohlke F, Rolf O: Wechsel fehlgeschlagener Frakturprothesen auf inverse Revisionsimplantate über den transhumeralen Zugang. Orthop Traumatol 2007; 19: 185-208
Das könnte Sie auch interessieren:
Mehr kardiovaskuläre Ereignisse und Malignome?
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...