Multiples Myelom: Daratumumab in Tripelkombination verlängert Gesamtüberleben1
Bericht: Dr. Ine Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine der wichtigsten Studien, die beim diesjährigen Kongress der European Society of Hematology (EHA) in der Präsidentensitzung präsentiert wurden, ist die Phase-III-Studie MAIA. Die MAIA-Studie zeigte die Überlegenheit der Tripeltherapie mit Daratumumab, Lenalidomid und Dexamethason gegenüber der Therapie-Dublette Lenalidomid und Dexamethason bei transplantationsungeeigneten Patienten mit neu diagnostiziertem multiplem Myelom (NDMM). Beim diesjährigen EHA-Kongress wurden nun erstmals Ergebnisse der MAIA-Studie zum Gesamtüberleben präsentiert, die den Stellenwert des D-Rd-Regimes in der Behandlung des NDMM stützen.1
Die multizentrische, offene Phase-III-Studie MAIA verglich randomisiert Daratumumab zusätzlich zu Lenalidomid plus Dexamethason (D-Rd vs. Rd) bei insgesamt 737 Patienten mit NDMM, die für eine Transplantation ungeeignet waren.2 Die Patienten waren im Median 73 bzw. 74 Jahre alt und 43 bzw. 44% der Patienten waren bereits 75 Jahre oder älter. Die Mehrheit der Patienten (85–86%) wies ein normales und 15 bzw. 14% wiesen ein zytogenetisches Hochrisiko auf. Der primäre Studienendpunkt war das progressionsfreie Überleben (PFS). An sekundären Endpunkten wurde u.a. das Gesamtüberleben (OS) untersucht. Beim diesjährigen EHA-Kongress wurden aktualisierte Daten der MAIA-Studie, einschließlich der Ergebnisse zum OS, mit einer medianen Nachbeobachtungszeit von 56,2 Monaten gezeigt.1
Vertiefte Remissionen nach längerer Nachbeobachtungszeit
Zum Zeitpunkt der präsentierten Interimsanalyse waren noch 42% der Patienten im Daratumumab-haltigen und 18% der Patienten im Kontrollarm unter Studienmedikation.1 Der Hauptgrund für das Abbrechen der Therapie war bei 27 versus 34% der Patienten ein Krankheitsprogress und bei 13 versus 23% der Patienten das Auftreten nicht akzeptabler Nebenwirkungen. Durch Daratumumab zusätzlich zu Lenalidomid und Dexamethason wurden tiefere Remissionen mit höheren Raten an Komplettremissionen (≥CR) und mindestens sehr guten partiellen Remissionen (≥VGPR) im Vergleich zum Rd-Regime erreicht. Innerhalb der um 28 Monate verlängerten Nachbeobachtungszeit seit der vorangegangenen Interimsanalyse wurde eine Vertiefung des Ansprechens in beiden Studienarmen gesehen.1
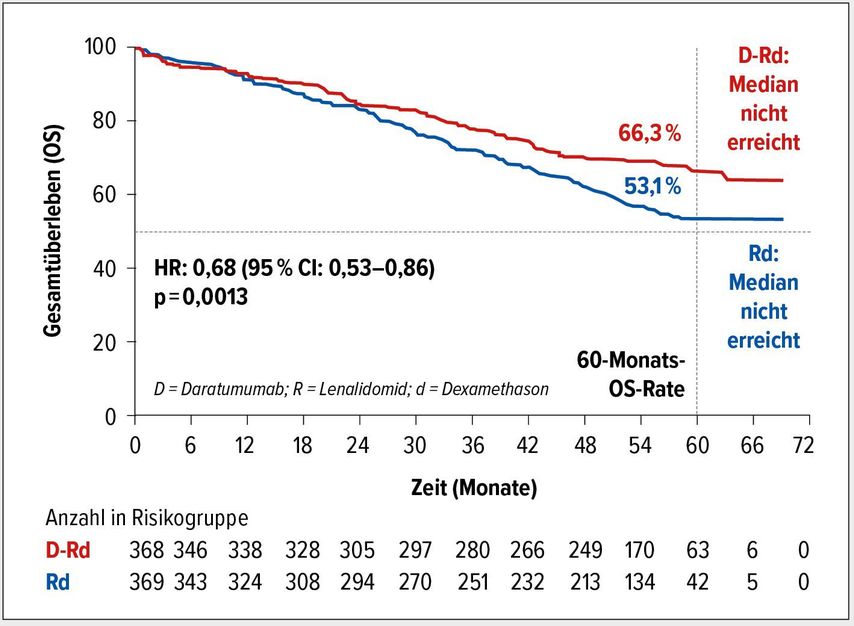
Progressionsfreies Überleben und Gesamtüberleben verlängert
Die aktualisierten PFS-Ergebnisse bestätigen den Vorteil durch die zusätzliche Daratumumab-Gabe. Nach 60 Monaten waren 52,5% der Patienten im D-Rd-Arm versus 28,7% im Rd-Arm ohne Progress. Der Median im D-Rd-Arm war noch nicht erreicht und betrug 34,4 Monate unter Rd (HR: 0,53; 95% CI: 0,43–0,66; p<0,0001). Mit der verlängerten Nachbeobachtungszeit trennen sich nun auch die Kaplan-Meier-Kurven bezüglich des Gesamtüberlebens (Abb. 1). Das Risiko, zu versterben, wurde durch Daratumumab um 32% reduziert (HR: 0,68; 95% CI: 0,53–0,86; p=0,0013). Die 60-Monats-OS-Rate lag bei 66,3 versus 53,1%. Der OS-Vorteil war im Wesentlichen über alle untersuchten Subgruppen konsistent.1
114 Patienten des D-Rd-Arms versus 186 Patienten des Rd-Arms erhielten nach der Studienmedikation eine weitere Therapielinie. Dabei wurden 46% der Patienten des Rd-Arms in einer der nachfolgenden Therapielinien ebenfalls mit Daratumumab behandelt. Etwa die Hälfte der nachfolgenden Therapien für Patienten beider Therapiearme bestand aus einem Proteasominhibitor-haltigen Regime. Es wurden mit der längeren Nachbeobachtungszeit keine neuen Sicherheitssignale beobachtet.1
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch Janssen-Cilag AG
AT_ CP-251679_4Aug2021
Quelle:
Jahrestagung der European Hematology Association (EHA Virtual Convention 2021), 9.–12. Juni 2021
Literatur:
1 Facon T et al.: Overall survival results with daratumumab, lenalidomide, and dexamethasone versus lenalidomide and dexamethasone in transplant-ineligible newly diagnosed multiple myeloma: phase 3 MAIA study. EHA Virtual Convention 2021, Abstr. #LB1901r 2 Facon T et al.: Daratumumab plus lenalidomide and dexamethasone for untreated myeloma. N Engl J Med 2019; 380: 2104-15
FKI
FACHKURZINFORMATION DARZALEX®
Bezeichnung des Arzneimittels: DARZALEX 1.800 mg Injektionslösung.
Qualitative und quantitative Zusammensetzung: Jede 15 ml-Durchstechflasche mit Injektionslösung enthält 1.800 mg Daratumumab (120 mg Daratumumab pro ml). Daratumumab ist ein humaner monoklonaler IgG1κ Antikörper gegen das CD38-Antigen, hergestellt in einer Säugetier-Zelllinie (Ovarzellen des chinesischen Hamsters [CHO]) durch rekombinante DNA Technologie. Sonstige Bestandteile: Jede 15 ml-Durchstechflasche mit Injektionslösung enthält 735,1 mg Sorbitol (E420), rekombinante humane Hyaluronidase (rHuPH20), Histidin, Histidinhydrochlorid-Monohydrat, Methionin, Polysorbat 20, Sorbitol (Ph.Eur.) (E420), Wasser für Injektionszwecke. Anwendungsgebiete: DARZALEX ist indiziert in Kombination mit Lenalidomid und Dexamethason oder Bortezomib, Melphalan und Prednison für die Behandlung erwachsener Patienten mit neu diagnostiziertem multiplen Myelom, die für eine autologe Stammzelltransplantation nicht geeignet sind. DARZALEX ist indiziert in Kombination mit Bortezomib, Thalidomid und Dexamethason für die Behandlung erwachsener Patienten mit neu diagnostiziertem multiplen Myelom, die für eine autologe Stammzelltransplantation geeignet sind. DARZALEX ist indiziert in Kombination mit Lenalidomid und Dexamethason oder Bortezomib und Dexamethason für die Behandlung erwachsener Patienten mit multiplem Myelom, die bereits mindestens eine Therapie erhalten haben. DARZALEX ist indiziert in Kombination mit Pomalidomid und Dexamethason für die Behandlung erwachsener Patienten mit multiplem Myelom, die bereits eine vorherige Therapie mit einem Proteasom-Inhibitor und Lenalidomid erhalten haben und refraktär gegenüber Lenalidomid waren oder die bereits mindestens zwei vorherige Therapien erhalten haben, die Lenalidomid und einen Proteasom-Inhibitor enthielten, und die während oder nach der letzten Therapie eine Krankheitsprogression gezeigt haben. DARZALEX ist indiziert als Monotherapie für die Behandlung erwachsener Patienten mit rezidiviertem und refraktärem multiplen Myelom, die bereits mit einem Proteasom-Inhibitor und einem Immunmodulator behandelt wurden, und die während der letzten Therapie eine Krankheitsprogression zeigten. DARZALEX ist indiziert in Kombination mit Cyclophosphamid, Bortezomib und Dexamethason für die Behandlung erwachsener Patienten mit neu diagnostizierter systemischer Leichtketten (AL)Amyloidose. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile. Inhaber der Zulassung: Janssen-Cilag International NV, Turnhoutseweg 30, B-2340, Beerse, Belgien. Vertrieb für Österreich: JANSSEN-CILAG Pharma GmbH, Vorgartenstraße 206B, A-1020 Wien. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. ATC-Code: L01XC24.
Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation.
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Es ist daher wichtig, jeden Verdachtsfall einer Nebenwirkung in Bezug auf DARZALEX® zu melden.
AT_CP-242309_v1.0_20210622