Mit hohem Evidenzlevel durch das Behandlungskontinuum
Bericht: Dr. Judith Moser
FTD/TPI: Assoziation zwischen Therapiedauer und Real-World-Outcomes14
Die globale, offene Phase-IIIb-Studie PRECONNECT evaluierte die Wirksamkeit und Sicherheit von FTD/TPI unter klinischen Routinebedingungen bei vorbehandelten mCRC-Patienten. Für die am ESMO WCGIC 2021 präsentierte Analyse unterteilten die Autoren die Population (n=914) je nach Therapiedauer in drei Gruppen (0–3, 4–7 und ≥8 Zyklen). Es resultierte eine direkte Korrelation zwischen der Therapiedauer und dem PFS (0–3 Zyklen: 2,2 Monate; 4–7 Zyklen: 5,3 Monate; ≥8 Zyklen: 9,4 Monate) sowie der Krankheitskontrollrate (12,3%, 75,3% bzw. 96,8%) und der Zeit bis zur Verschlechterung des ECOG PS (3,6 bzw. 8,9 und 16,4 Monate). Insgesamt untermauern die Daten den Benefit der Therapie, speziell auch im Hinblick auf die Anwendung über mehrere Zyklen.
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Therapiesequenzen sind im Management von Patienten mit metastasiertem kolorektalem Karzinom etabliert und werden zunehmend auch beim metastasierten Pankreaskarzinom Routine. Solide Effektivität und Verträglichkeit können in diesem Setting von FTD/TPI (Lonsurf®) bzw. pegyliertem liposomalem Irinotecan (Onivyde®) plus 5-FU/LV erwartet werden.1,2
Limitierte Daten zur Rechallenge bei mCRC
Für die Behandlung des metastasierten kolorektalen Karzinoms (mCRC) steht mittlerweile eine Vielzahl an systemischen Optionen zur Verfügung. Die Guidelines der European Society of Medical Oncology (ESMO) empfehlen je nach Ausgangssituation (RAS- und BRAF-Mutationsstatus, Mikrosatellitenstabilität) diverse Therapiesequenzen von der ersten bis zur vierten Linie, wobei zielgerichtete Substanzen in späteren Linien nur einen geringen Teil des Spektrums ausmachen.3 Ab der Drittlinie bewegt sich der Gesamtanteil der Patienten mit molekularen Aberrationen, die ein gezieltes Ansetzen erlauben, im Bereich von 10%.4–7
Einer Anti-EGFR-Rechallenge als Therapieoption in später Linie sollte jedenfalls eine Selektion der Patienten mit RAS-Wildtyp mittels Liquid Biopsy vorangehen. „Allerdings eignet sich diese Strategie nicht für alle Patienten“, betonte Prof. Dr. Rachel Riechelmann, AC Camargo Cancer Center, São Paulo, Brasilien. Zur Anti-EGFR-Rechallenge liegt nur sehr begrenzt hochqualitative klinische Evidenz vor, zudem steht die Liquid Biopsy in vielen Ländern nicht zur Verfügung. Auch in Bezug auf die Oxaliplatin-Rechallenge in der Dritt- oder Viertlinie fehlen robuste Daten, und ein Vorteil ist lediglich bei einem Teil der Patienten zu erwarten. Aufgrund dessen wird in den ESMO-Guidelines keine entsprechende Empfehlung abgegeben.3
Anhaltende Lebensqualität unter FTD/TPI
Trifluridin/Tipiracil (FTD/TPI; Lonsurf®) und Regorafenib stellen ab der dritten Behandlungslinie die einzigen Optionen dar, die auf der Basis von Phase-III-Studien mit einer IB-Empfehlung ausgestattet wurden.3 In der RECOURSE-Studie bewirkte FTD/TPI eine signifikante Verlängerung des Gesamtüberlebens (OS) gegenüber Placebo (7,2 vs. 5,2 Monate; HR: 0,69; p<0,0001).8 Ebenso verlängerte sich in CORRECT das OS unter Regorafenib vs. Placebo signifikant (6,4 vs. 5,0 Monate; HR: 0,77; p=0,0052).9
Unterschiede zwischen den beiden Substanzen basieren in erster Linie auf den Toxizitätsprofilen. Wie Riechelmann ausführte, geht FTD/TPI mit subjektiv weniger belastenden Nebenwirkungen in Form von Zytopenien einher, während Regorafenib häufig Hand-Fuß-Syndrom, Fatigue, Anorexie und Diarrhö hervorruft.9–12 In RECOURSE resultierte unter FTD/TPI vs. Placebo ein signifikanter Vorteil im Hinblick auf die Zeit bis zur Verschlechterung des ECOG-Performance-Status (PS) auf ≥2 (5,7 vs. 4,0 Monate; HR: 0,66; p<0,001).10
Real-World-Daten aus der Phase-IIIb-Studie PRECONNECT bestätigen die in RECOURSE generierte Evidenz.13 Das mediane progressionsfreie Überleben (PFS) betrug 2,8 Monate und die mediane Zeit bis zur ECOG-Verschlechterung (PS ≥2) 8,9 Monate. Ebenso entsprachen die beobachteten Toxizitäten dem bekannten Profil, und die Lebensqualität blieb bis zum 7. Zyklus konstant. Die beim World Congress on GI Cancer (WCGIC) präsentierte Analyse der Studie setzte die Therapiedauer mit den klinischen Endpunkten in Relation (Kasten).14
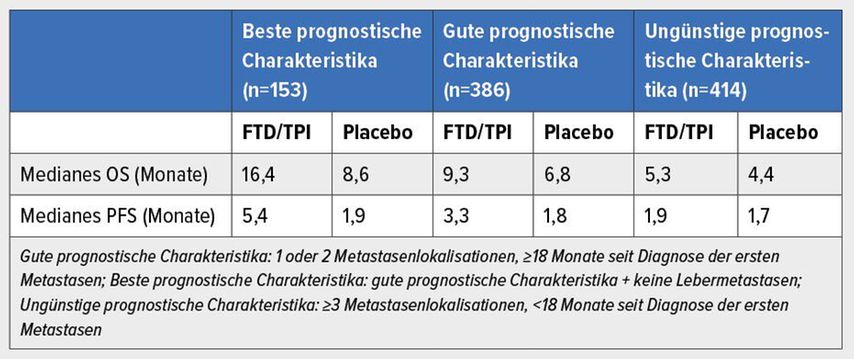
Angesichts der ähnlichen Outcomes unter FTD/TPI und Regorafenib wurde versucht, prädiktive Faktoren für einen größeren Benefit durch die eine oder andere Substanz zu identifizieren. Eine exploratorische Analyse der RECOURSE-Studie stellte eine direkte Korrelation zwischen den prognostischen Charakteristika und dem OS bzw. PFS fest (Tab. 1).15,16 Bei Vorliegen der besten Prognosefaktoren betrug das mediane OS unter FTD/TPI bzw. Placebo 16,4 vs. 8,6 Monate, wobei auch gezeigt werden konnte, dass alle Patienten – auch mit weniger günstigen Prognosefaktoren – deutlich von der Therapie mit FTD/TPI profitierten (Tab. 1).15,16
Tab. 1: RECOURSE-Studie: Gesamtüberleben (OS) und progressionsfreies Überleben (PFS) in drei prognostischen Subgruppen15, 16
Pankreaskarzinom: Evidenz in der Zweitlinie
Steigende Inzidenzzahlen sind in Bezug auf das Pankreaskarzinom zu erwarten, das derzeit im Mortalitäts-Ranking bei soliden Tumoren den dritten Platz einnimmt und in den nächsten zehn Jahren auf Platz 2 vorrücken könnte.17 Bei diesem immanent therapieresistenten Karzinom ließen sich in den letzten Dekaden nur langsam Fortschritte erzielen. „Mittlerweile hat die 5-Jahres-Überlebensrate jedoch den zweistelligen Bereich erreicht“, berichtete Assoc. Prof. Priv.-Doz. Dr. Gerald Prager, Univ.-Klinik für Innere Medizin I, Medizinische Universität Wien.18
In der metastasierten Situation empfiehlt sich als Erstlinien-Kombinationsstrategie entweder nab-Paclitaxel/Gemcitabin oder (modifiziertes) FOLFIRINOX. „Ein wachsender Anteil der Patienten ist fit genug für die Zweitlinientherapie“, betonte Prager. Nach FOLFIRINOX-Versagen fehlen robuste evidenzbasierte Daten für eine Folgetherapie in weiterer Linie. In der Praxis kommen hier Gemcitabin-basierte Regimes infrage. Gemcitabin-vorbehandelte Patienten können dagegen 5-FU-basierte Schemata erhalten, zu denen pegyliertes liposomales Irinotecan (nal-IRI, Onivyde®) plus 5-FU/LV als einzige ESMO-Guideline IA empfohlene Zweitlinientherapie zählt.19 Prager verwies auf die widersprüchliche Datenlage im Zusammenhang mit der Oxaliplatin-basierten Therapie im Zweitlinien-Setting. „Während die CONKO-003-Studie einen OS- und PFS-Vorteil durch OFF gegenüber Folsäure/Fluorouracil zeigte, erbrachte PANCREOX keine PFS-Überlegenheit von FOLFOX-6 versus 5-FU/LV und sogar Unterlegenheit im Hinblick auf das OS.“20,21
Eindeutig positive Evidenz liegt dagegen aus der Phase-III-Studie NAPOLI-1 vor, die nal-IRI in Kombination mit 5-FU/LV evaluierte. Im Vergleich zu 5-FU/LV bewirkte die Kombination signifikante Verlängerungen des OS (6,24 vs. 4,24 Monate; HR: 0,75), des PFS (3,1 vs. 1,5 Monate; HR: 0,57) und eine Verbesserung der Gesamtansprechrate (17% vs. 1%; p<0,0001).22 Laut EORTC-QLQ-C30 blieb die Lebensqualität im Prüfarm erhalten, die im Setting des metastasierten Pankreaskarzinoms eine zentrale Rolle spielt.23 „Die Scores änderten sich in den Wochen 6 und 12 nicht merklich.“ Bei adäquater Fitness des Patienten steht auch eine Drittlinientherapie im Raum.
OS-Verlängerung im Spiegel österreichischer Beobachtungen
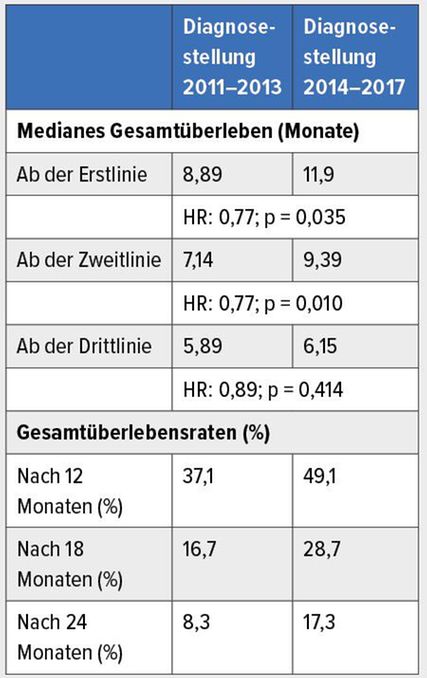
Tab. 2: Überlebens-Outcomes der am AKH Wien von 2011 bis 2013 bzw. 2014 bis 2017 diagnostizierten Pankreaskarzinom-Patienten24
Eine am AKH Wien durchgeführte Analyse bestätigt die Relevanz der Zweitlinientherapie für die Gesamtprognose. Patienten, deren Erkrankung zwischen 2014 und 2017 diagnostiziert worden war, lebten dank der neuen Behandlungsoptionen signifikant länger als die zwischen 2011 und 2013 diagnostizierte Gruppe (Tab.2).24„Die OS-Verlängerung basierte hauptsächlich auf der Zweitlinientherapie, welche einen signifikanten Benefit bewirkte“, erklärte Prager (7,14 vs. 9,39 Monate; HR: 0,77; p=0,010). Seit 2016 steht nal-IRI als aktive Therapie nach Gemcitabin-Vorbehandlung zur Verfügung.2 Auch der Anteil der Langzeitüberlebenden ist im Laufe der Zeit gestiegen, wie die 24-Monats-OS-Raten vor Augen führen (17,3% vs. 8,3%).
Für ein Langzeitüberleben prädiktive Charakteristika umfassen laut einer Post-hoc-Analyse der NAPOLI-1-Studie und einer Auswertung der am AKH Wien generierten Real-World-Daten jüngeres Alter, guten PS, niedrigere CA19-9-Spiegel und das Fehlen von Lebermetastasen.22 Wie Prager zusammenfassend hervorhob, haben effektive und tolerable Sequenzen neuer und bewährter systemischer Therapien auf der Basis solider Evidenz eine allgemeine Verbesserung der Prognose von Patienten mit metastasiertem Pankreaskarzinom ermöglicht.
FTD/TPI: Assoziation zwischen Therapiedauer und Real-World-Outcomes14
Die globale, offene Phase-IIIb-Studie PRECONNECT evaluierte die Wirksamkeit und Sicherheit von FTD/TPI unter klinischen Routinebedingungen bei vorbehandelten mCRC-Patienten. Für die am ESMO WCGIC 2021 präsentierte Analyse unterteilten die Autoren die Population (n=914) je nach Therapiedauer in drei Gruppen (0–3, 4–7 und ≥8 Zyklen). Es resultierte eine direkte Korrelation zwischen der Therapiedauer und dem PFS (0–3 Zyklen: 2,2 Monate; 4–7 Zyklen: 5,3 Monate; ≥8 Zyklen: 9,4 Monate) sowie der Krankheitskontrollrate (12,3%, 75,3% bzw. 96,8%) und der Zeit bis zur Verschlechterung des ECOG PS (3,6 bzw. 8,9 und 16,4 Monate). Insgesamt untermauern die Daten den Benefit der Therapie, speziell auch im Hinblick auf die Anwendung über mehrere Zyklen.
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch Servier Austria GmbH
Fachkurzinformation siehe Seite 119/120Lonsurf_Onivyde/C2/20´21/ESMO GI_Jatros/Sept.21
Quelle:
ESMO World Congress on Gastrointestinal Cancer, Symposien der Firma Servier, 1. & 2. Juli 2021, virtuell
Literatur:
1 Fachinformation Lonsurf®, Stand Dez. 2020 2 Fachinformation Onivyde®, Stand Aug. 2020 3 Van Cutsem E et al.: Ann Oncol 2016; 27(8): 1386-422 4 Loree JM et al.: J Gastrointest Oncol 2017; 8(1): 199-212 5 Venderbosch S et al.: Clin Cancer Res 2014; 20(20): 5322-30 6 Antoniotti C et al.: J Clin Oncol 2020; 38(suppl_15): 4077 7 Okamura R et al.: JCO Precis Oncol 2018; 2018: PO.18.00183 8 Van Cutsem E et al.: Eur J Cancer 2018; 90: 63-72 9 Grothey A et al.: Lancet 2013; 381(9863): 303-12 10 Mayer RJ et al.: NEngl J Med 2015; 372(20): 1909-19 11 Li J et al.: Lancet Oncol 2015; 16(6): 619-29 12 Van Cutsem E et al.: Oncologist 2019; 24(2): 185-92 13 Bachet JP et al.: ESMO Open 2020; 5(3): e000698 14 Taieb J et al.: ESMO World Congress on Gastrointestinal Cancer 2021, Abstract SO-18 15Tabernero J et al.: ESMO Open 2020; 5(4): e000752 16Tabernero J et al.: J Clin Oncol 2019; 37(suppl_4): 677 17Rahib L et al.: Cancer Res 2014; 74(11): 2913-21 18 Pancreatic Cancer Action Network, www.pancan.org 19 Ducreux M et al.: Ann Oncol 2015; 26(Suppl 5): v56-68 20Oettle H et al.: J Clin Oncol 2014; 32(23): 2423-9 21 Gill S et al.: J Clin Oncol 2016; 43(32): 3914-20 22 Wang-Gillam A et al.: Eur J Cancer 2019; 108: 78-87 23 Wang-Gillam A et al.: Lancet 2016; 387(10018): 545-57 24 Kieler M et al.: J Clin Med 2020; 9(3): 648