Biomarker-basierte Diagnostik und Behandlungsstrategien bei Alzheimer
Bericht:
Dipl.-Ing. Dr. Manuel Spaltl-Zoidl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine sorgfältige Diagnose der Alzheimererkrankung (AD) ist für den Einsatz krankheitsmodifizierender Therapien unumgänglich. Auf der 22. Jahrestagung der Österreichischen Gesellschaft für Neurologie (ÖGN) wurde über Biomarker-basierte Diagnostik und neue krankheitsmodifizierende Therapien bei AD berichtet.
Keypoints
-
Die Berücksichtigung relevanter Biomarker unterstützt Kliniker:innen bei der Diagnostik der Demenzform.
-
Anti-Amyloid-Antikörper wie Lecanemab und Donanemab liefern positive Wirksamkeitsergebnisse in Phase-III-Studien, können aber zu ARIA führen.
-
Biomarker können bei der Früherkennung der Alzheimerkrankheit helfen und so einen zeitnahen Therapiestart ermöglichen.
-
Die Patient:innenautonomie und eine gemeinsame Entscheidungsfindung haben bei der Auswahl einer geeigneten Therapie einen besonders hohen Stellenwert.
Univ.-Prof. Dr. Gerhard Ransmayr, Facharzt für Neurologie und Psychiatrie in Linz und Innsbruck, und Prof.in Priv.-Doz.in Dr.in Elisabeth Stögmann, Universitätsklinik für Neurologie der Medizinischen Universität Wien, präsentierten bei der Tagung aktuelle Erfahrungen mit der Biomarker-basierten Diagnostik und neuen krankheitsmodifizierenden Therapien bei der AD.
Biomarker-basierte Diagnostikder AD
Die Komplexität der Demenzdiagnostik kommt, so Ransmayr, durch die verschiedenen Ursachen des Syndroms zustande. Die häufigsten Formen sind die Alzheimerdemenz und deren verschiedene Varianten, wie die posteriore kortikale Atrophie, die logopenische und frontale Variante, sowie das kortikobasale Syndrom.1 Andere Formen der Demenz umfassen Parkinsondemenz, Demenz mit Lewy-Körperchen (DLB), frontotemporale Demenz und vaskuläre Demenz.2
Obwohl sich die verschiedenen Formen der Demenz in der klinischen Präsentation unterscheiden, ist die genaue Diagnose aufgrund überlappender Symptome, ihres Wandels im Krankheitsverlauf und wegen möglicher atypischer Phänomenologien häufig unsicher. Für die Abgrenzung der Demenzformen voneinander ist, so Ransmayr, eine Analyse der zugrunde liegenden Biomarker daher besonders relevant.
Die ATN-Klassifikation bei AD
Für die Klassifikation der AD kommen die Biomarkerklassen Amyloid (A), Phospho-Tau (T) und Neurodegeneration (N) zum Einsatz. Innerhalb jeder Klasse können verschiedene Biomarker erfasst werden. So kann ein PET sowohl Amyloid-Plaques als auch Tau-Neurofibrillenbündel nachweisen. Im Liquor oder Plasma werden das Verhältnis zwischen Aβ42 und Aβ40 sowie die Spiegel der phosphorylierten Tau-Spezies pTau181 oder pTau217 ermittelt. Für den Nachweis der Neurodegeneration stehen beispielsweise Neurofilament-Leichtketten (NfL) und das saure Gliafaserprotein (GFAP) zur Verfügung. Praktisch lässt sich anhand dieser ATN-Klassifikation die Wahrscheinlichkeit einer Alzheimerdemenz ableiten. Patient:innen mit A+/T+/N+ weisen eine Pathologie auf, die mit hoher Wahrscheinlichkeit mit einer AD vereinbar ist. Demenz bei Patient:innen mit A–/T–/N– hat dagegen höchstwahrscheinlich eine andere Ursache.3
Für die definitive Diagnose der AD sind die Ergebnisse der Biomarkeranalyse allein jedoch nicht ausreichend. Laut den Europäischen Leitlinien sollten auch entsprechende klinische Symptome vorliegen, um die AD zu bestätigen.4
Anti-Amyloid-Antikörper liefern positive Ergebnisse
In der Gruppe der monoklonalen Anti-Amyloid-Antikörper hat Lecanemab vor Kurzem die Marktzulassung in der Europäischen Union erhalten. Donanemab wird gegenwärtig noch von der Europäischen Arzneimittelagentur evaluiert. Lecanemab war in einer klinischen randomisierten doppelblinden Phase-III-Studie mit 1795 Patient:innen Placebo bei der Veränderung des Clinical Dementia Rating–Sum of Boxes Score (CDR-SB) signifikant überlegen. Der Behandlungsunterschied nach 18 Monaten betrug –0,45 (95% CI: –0,67 bis –0,23) und entspricht einer 27-prozentigen Verlangsamung der Krankheitsprogression über 18 Monate hinweg.5 Ebenso erreichte Donanemab den primären Endpunkt der randomisierten doppelblinden Phase-III-Studie mit 1736 Patient:innen. Hier betrug der Unterschied der Veränderung des CDR-SB zwischen Donanemab und Placebo –0,7 (95% CI: –0,95 bis –0,45). Dies entspricht einer 29-prozentigen Verlangsamung der Krankheitsprogression über 76 Wochen hinweg.6
Der klinische Nutzen der Anti-Amyloid-Therapien muss allerdings gegen die potenziell tödliche Nebenwirkung der „amyloid-related imaging abnormalities“ (ARIA) abgewogen werden. Durch die Antikörper kann es zu Leckagen und Flüssigkeitsaustritt in das Parenchym kommen. Handelt es sich bei dieser Flüssigkeit um Blut, führt dies zu Mikroblutungen im Parenchym oder superfiziellen Siderosen im Subarachnoidalraum.7 Hauptrisikofaktor für diese Nebenwirkung stellt die Homozygotie des APOE-ε4-Allels dar. Aber auch Mikroblutungen und superfizielle Siderosen im Ausgangs-MRT sowie ein hoher arterieller Blutdruck und eine hohe Amyloidlast sind wichtige Risikofaktoren.6
Ursache dieser Leckagen könnte vaskuläres Aβ im Gehirn sein, welches durch Antikörper wie Lecanemab und Donanemab nicht gebunden wird. Anders als andere Anti-Amyloid-Therapien kann der sogenannte Brain-Shuttle-Antikörper Trontinemab über das „transferrin receptor-based system“ die Blut-Hirn-Schranke überwinden und vaskuläres Aβ binden. In einer Phase-Ib/II-Studie mit 160 Patient:innen mit früher AD reduzierte Trontinemab 3,6mg/kg nach 28 Wochen die Amyloid-Last um 98 Centiloide. Allerdings trat auch mit diesem Molekül ein tödliches ARIA-Ereignis bei einer Patientin mit einer superfiziellen Siderose im Ausgangs-MRT auf, sodass die Sicherheit des Arzneimittels anhand laufender Studien weiter evaluiert werden muss.8
Anti-Tau-Antikörper zeigenerste positive Signale
Anti-Tau-Antikörper sind im Vergleich zu Anti-Amyloid-Antikörpern nur selten in klinischen Studien vertreten.9 Grund für eine geringe Wirksamkeit bisher evaluierter Antikörper könnte deren Angriffspunkt am Tau-Molekül sein. Diese binden häufig am N-terminalen Ende, welches vor der Aggregierung von Tau abgespalten wird und für den Krankheitsprozess möglicherweise keine Rolle spielt, so Stögmann.
Neue Ansätze zielen auf die „microtubule binding region“ (MTBR) des Tau-Moleküls ab. Dabei generierte E2814 in einer kleinen Kohorte mit Patient:innen mit autosomal dominanter AD positive Signale bei der Reduktion von pTau217 und MTBR-Tau243 im Liquor.10 Der Anti-Tau-Antikörper Bepranemab erreichte in einer Phase-II-Studie mit 466 Patient:innen mit früher AD den primären Endpunkt nicht, zeigte aber in einer Subgruppe mit Patient:innen, die eine geringe Tau-Last und kein APOE-ε4-Allel hatten, erste Signale für eine Verlangsamung der Tau-Pathologie im Gehirn.11
Biomarker als Schlüssel zur Früherkennung der AD
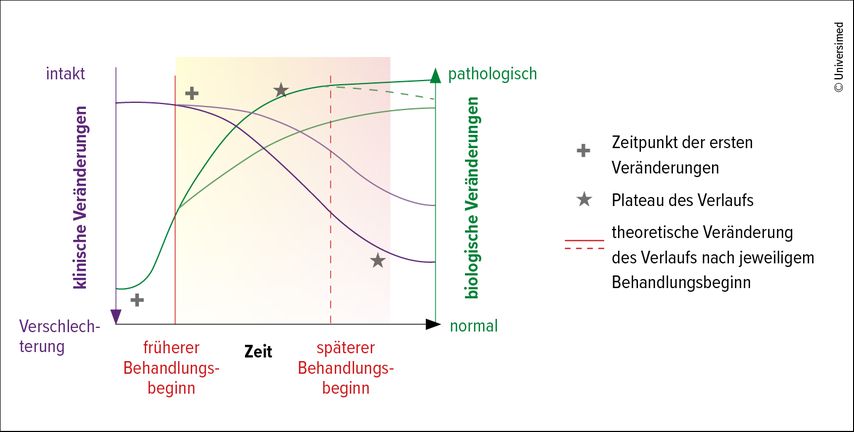
Heute findet mit dem Konzept der „clinical meaningfulness“ ein Umdenken statt. Es sollen nicht nur Symptome behandelt werden, sondern auch das biologische Fortschreiten der Erkrankung soll reduziert werden. Ein von Hampel und Kolleg:innen entwickeltes Modell zeigt, dass biologische Veränderungen lange vor den klinischen Symptomen eintreten und ein früher Behandlungsstart theoretisch zu günstigeren Krankheitsverläufen führt (Abb. 1).12 Biomarker nehmen eine Schlüsselrolle bei der rechtzeitigen Erkennung dieser biologischen Veränderungen ein, unterstrich Stögmann.
Abb. 1: Gegenüberstellung der biologischen und klinischen Veränderungen bei Alzheimerkrankheit über die Zeit. Ein früherer Behandlungsbeginn ist theoretisch mit einem günstigeren Krankheitsverlauf assoziiert (modifiziert nach Elhage A et al.)12
Fazit
Heute steht mit zwei unabhängigen Phase-III-Studien Evidenz zur Verfügung, dass Aβ ein wichtiges, jedoch nicht das einzige Substrat der AD ist. Gerade in frühen Stadien ist unklar, ob klinische Endpunkte allein signifikante Effekte nachweisen können. Ein integriertes Biomarkerkonzept nimmt daher für den Nachweis der Wirksamkeit eine Schlüsselrolle ein. Die Pati-ent:innenautonomie steht für Stögmann immer im Vordergrund. In einem gemeinsamen Gespräch sollten Nutzen und Risiko der Therapien besprochen werden, und eine möglichst sichere und breit aufgestellte Behandlung durch gemeinsame Entscheidungsfindung sollte erarbeitet werden, schloss Stögmann ihren Vortrag.
Quelle:
22. Jahrestagung der Österreichischen Gesellschaft für Neurologie (ÖGN), 12. – 14. März 2025, Innsbruck
Literatur:
1 McKhann GM et al.: The diagnosis of dementia due to Alzheimerʼs disease: recommendations from the National Institute on Aging-Alzheimerʼs Association workgroups on diagnostic guidelines for Alzheimerʼs disease. Alzheimers Dement 2011; 7(3): 263-9 2 DGN e.V. & DGPPN e.V. (Hrsg.): S3-Leitlinie Demenzen, Version 5.1, 28.3.2025, verfügbar unter: https://register.awmf.org/de/leitlinien/detail/038-013; Zugriff am 15.4.2025 3 Jack CR Jr et al.: A/T/N: an unbiased descriptive classification scheme for Alzheimer disease biomarkers. Neurology 2016; 87(5): 539-47 4 Dubois B et al.: Alzheimer disease as a clinical-biological construct—an International Working Group recommendation. JAMA Neurol 2024; 81(12): 1304-11 5 van Dyck CH et al.: Lecanemab in early Alzheimerʼs disease. N Engl J Med 2023; 388(1): 9-21 6 Sims JR et al.: Donanemab in early symptomatic Alzheimer disease: the TRAILBLAZER-ALZ 2 randomized clinical trial. JAMA 2023; 330(6): 512-27 7 Hampel H et al.: Amyloid-related imaging abnormalities (ARIA): radiological, biological and clinical characteristics. Brain 2023; 146(11): 4414-24 8 www.alzforum.org/news/conference-coverage/trontinemab-data-strengthen-hope-brain-shuttles; letzter Zugriff am 10.4.2025 9 Cummings J et al.: Alzheimerʼs disease drug development pipeline: 2024. Alzheimers Dement (N Y) 2024; 10(2): e12465 10 www.eisai.com/news/2024/news202480.html; letzter Zugriff am 15.4.2025 11 www.alzheimer-europe.org/news/ucb-presents-phase-ii-data-bepranemab-early-ad; letzter Zugriff am 15.4.2025 12 Elhage A et al.: Defining benefit: clinically and biologically meaningful outcomes in the next-generation Alzheimerʼs disease clinical care pathway. Alzheimers Dement 2025; 21(2): e14425
Das könnte Sie auch interessieren:
Kardiomyopathien bei neuromuskulären Erkrankungen
Neuromuskuläre Erkrankungen zeigen oft eine kardiale Mitbeteiligung mit Herzinsuffizienz und malignen Rhythmusstörungen. Durch frühzeitige Diagnostik und zeitgemäße Medikamenten- und ...
Aktuelle Themen und Herausforderungen bei der Behandlung der Epilepsie
Die 13. Dreiländertagung der Deutschen und Österreichischen Gesellschaften für Epileptologie sowie der Schweizerischen Epilepsie-Liga stand im Zeichen globaler Kooperation und ...
Spannende Zeiten im Therapiefeld der Muskeldystrophien
Wien steht 2025 ganz im Zeichen der neuromuskulären Erkrankungen. Nach dem jährlichen UpDate Muskelforschung findet vom 7.–11.10.2025 mit dem 30. Jubiläumsmeeting der World Muscle ...