Behandlungserfolge mit zielgerichteten und immunonkologischen Therapien
Bericht:
Dr. Ine Schmale
Das Gastrointestinal Cancers Symposium der American Society of Clinical Oncology (ASCO GI), im Regelfall der erste amerikanische onkologische Kongress im Jahr, zog uns in diesem Jahr nicht nach San Francisco, sondern vor den heimatlichen Computer. Dennoch haben die wissenschaftlichen Vorträge wichtige Ergebnisse für die Behandlung von gastrointestinalen Tumoren geliefert.
Kolorektalkarzinom: Pembrolizumab bei MSI-H-Tumoren
Bei ungefähr 5% der Patienten mit metastasiertem Kolorektalkarzinom kann eine Mikrosatelliteninstabilität (MSI-H) nachgewiesen werden. Mit der Pembrolizumab-Monotherapie wurden in der Phase-II-Studie KEYNOTE-164 dauerhafte Remissionen bei akzeptablem Sicherheitsprofil gesehen, die in der Phase-III-Studie KEYNOTE-177 bestätigt wurden. Beim ASCO GI wurden nun auch die Ergebnisse bezüglich des progressionsfreien Überlebens unter der nachfolgenden Therapie (PFS2) und der Lebensqualität der Patienten präsentiert.1 Insgesamt erhielten in der KEYNOTE-177-Studie 307 Patienten mit MSI-H metastasiertem Kolorektalkarzinom (mCRC) entweder bis zu 35 Zyklen Pembrolizumab (200mg, q3w) oder eine Chemotherapie (FOLFOX oder FOLFIRI) mit oder ohne Biological (Bevacizumab oder Cetuximab) nach Wahl des Behandlers. Bei Tumorprogress war den Patienten des Kontrollarms der Wechsel in den Pembrolizumab-Arm erlaubt. Mit einer medianen Nachbeobachtungszeit von 32,4 Monaten wurden 12- und 24-Monats-PFS-Raten von 55% und 48% im Pembrolizumab-Arm versus 37% und 19% im Kontrollarm beobachtet (HR: 0,60; 95% CI: 0,45–0,80; p=0,0002). Im Median lebten die Patienten 16,5 versus 8,2 Monate progressionsfrei. Laut einer Subgruppenanalyse profitierten insbesondere Patienten ≤70 Jahre (HR: 0,52; 95% CI: 0,37–0,75), Patienten mit einem sehr guten Allgemeinzustand (Eastern Co-Operative Oncology Performance Status [ECOG PS] 0) (HR: 0,37; 95% CI: 0,24–0,59), Patienten mit KRAS/NRAS-Wildtyp-Tumoren (HR: 0,44; 95% CI: 0,29–0,67) sowie Patienten mit rechtsseitigen Tumoren (HR: 0,54; 95% CI: 0,38–0,77). Als bestes Ansprechen erreichten die Patienten eine komplette Remission in 11,1% versus 3,9% der Fälle, eine partielle Remission in 32,7% versus 29,2% der Fälle und eine stabile Erkrankung in 20,9% versus 42,2% der Fälle. Die Dauer des Ansprechens betrug 10,6 Monate im Kontrollarm und war zur Zeit der Auswertung im Pembrolizumab-Arm noch nicht erreicht. 83% versus 35% der Patienten sprachen ≥24 Monate auf die Studienmedikation an.
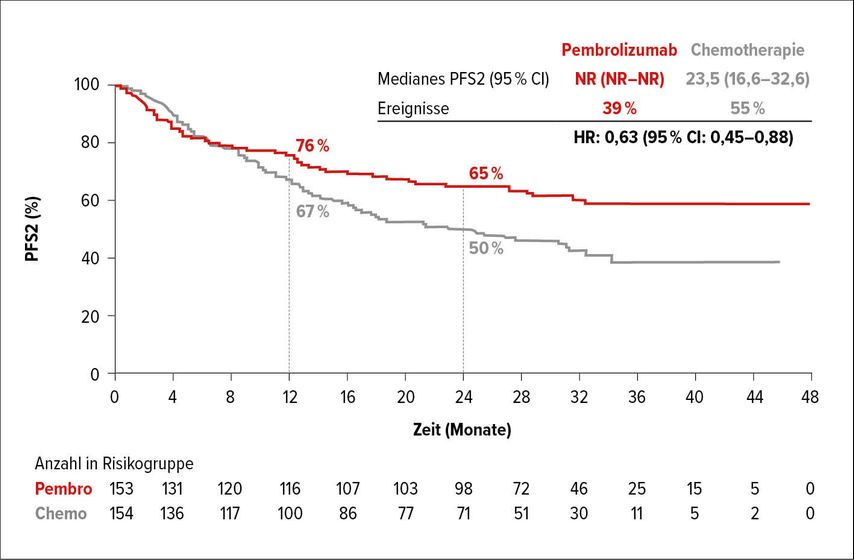
Die Pembrolizumab-Therapie hatte auch einen positiven Effekt auf die Zeit bis zum Progress unter der nachfolgenden Therapie (PFS2). Das PFS2 betrug median 23,5 Monate im Chemotherapie-Arm und war im Pembrolizumab-Arm noch nicht erreicht. Die 12-Monats-PFS2-Rate betrug 76% versus 67% und die 24-Monats-PFS2-Rate 65% versus 50% (HR: 0,63; 95% CI: 0,45–0,88) (Abb. 1). Dabei muss bemerkt werden, dass 36,4% der Patienten vom Chemotherapiearm in den Pembrolizumab überwechselten. Von den Patienten, die nicht in den Pembrolizumab-Arm wechselten, aber eine weitere Therapie erhielten, war dies in 9,1% der Fälle Pembrolizumab und in weiteren 8,3% der Fälle eine andere Checkpoint-Immuntherapie.
Abb. 1: Progressionsfreies Überleben unter der Nachfolgetherapie (PFS2) im Pembrolizumab- versus Chemotherapie-Arm (nach Shiu et al.)1
Bezüglich der Nebenwirkungen erwies sich Pembrolizumab als die verträglichere Therapie mit nur 22% therapieassoziierten Nebenwirkungen Grad ≥3 gegenüber 66% im Chemotherapie-Arm. Immunvermittelte Nebenwirkungen Grad ≥3 traten häufiger im Pembrolizumab-Arm auf (9% vs. 2%). Es brachen 10% versus 6% die Therapie aufgrund von Nebenwirkungen ab, davon 7% versus 0 Patienten aufgrund von immunvermittelten Nebenwirkungen. Die Erhebung der Lebensqualität mithilfe des European Organization for Research and Treatment of Cancer Core Quality of Life Questionnaire (EORTC QLQ-C30) zeigte eine verbesserte Lebensqualität unter Pembrolizumab im Vergleich mit den Chemotherapieregimen.
Pankreaskarzinom: Erhaltungstherapie mit Olaparib bei BRCA-mutierten Tumoren
Die randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie POLO untersuchte die Erhaltungstherapie mit dem PARP-Inhibitor Olaparib bei Patienten mit metastasiertem Pankreaskarzinom und Keimbahn-BRCA-Mutation. Beim ASCO GI wurden nun die Ergebnisse der finalen Analyse zum Gesamtüberleben vorgestellt.2 154 Patienten, die nach Platin-basierter Chemotherapie ≥16 Wochen keinen Krankheitsprogress aufwiesen, erhielten in der POLO-Studie 3:2randomisiert Olaparib (300mg b.i.d.) oder Placebo bis Krankheitsprogress. Die Studie erreichte ihren primären Endpunkt, eine Verlängerung des PFS, mit median 7,4 versus 3,8 Monaten (HR: 0,53; 95% CI: 0,35–0,82; p=0,004).
Bezüglich des OS wurde trotz einer 36- Monats-Rate von 33,9% versus 17,8% die statistische Signifikanz zwischen den beiden Studienarmen nicht erreicht (HR: 0,83; 95% CI: 0,56–1,22; p=0,3487). Das mediane OS betrug 19,0 versus 19,2 Monate. Bei Auswertung waren noch 14,1% der Patienten im Olaparib-Arm versus 3,2% im Placebo-Arm unter Therapie. Ein OS ≥2 Jahre wurde bei 37% der Patienten unter Olaparib versus 27% der Patienten unter Placebo festgestellt. Von diesen lebten zur Zeit der Auswertung noch 73,5% im Olaparib-Arm versus 41,2% im Placebo-Arm. Eine nachfolgende Chemotherapie erhielten 35,3% der mit Olaparib versus 64,7% der mit Placebo behandelten Patienten.
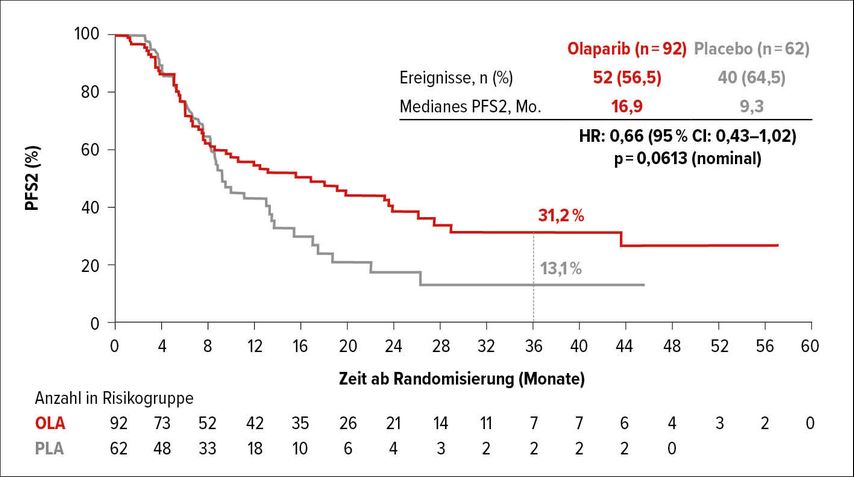
Bezüglich der Zeit bis zur ersten nachfolgenden Therapie (TFST) und bis zum Progress unter der nachfolgenden Therapie wurden statistisch signifikante bzw. klinisch relevante Vorteile für die Erhaltungstherapie mit Olaparib beobachtet. Nach 36 Monaten waren 21,5% versus 3,6% der Patienten ohne nachfolgende Therapie (HR: 0,44; 95% CI: 0,30–0,66; p<0,0001) (Abb. 2). Die mediane Zeit bis zur ersten nachfolgenden Therapie betrug 9,0 versus 5,4 Monate. Das mediane PFS2 betrug 16,9 versus 9,3 Monate, mit einer 34%igen Reduktion des Progressionsrisikos (HR: 0,66; 95% CI: 0,43–1,02; p=0,0613).
Abb. 2: Progressionsfreies Überleben unter der Nachfolgetherapie (PFS2) im Olaparib- versus Placebo-Arm (nach Golan et al.)2
Trotz der nicht signifikanten OS-Daten schlossen die Autoren aus der gesamten Evidenz, dass die Erhaltungstherapie mit Olaparib bei Pankreaskarzinom-Patienten mit Keimbahn-BRCA-Mutation einen klinisch relevanten Nutzen bringt.
Magenkarzinom: Proof of Concept für FGFR2b-gerichtete Therapie
Der „fibroblast growth factor receptor 2b“ (FGFR2b) wird auf verschiedenen Tumorentitäten exprimiert, u.a. beim Magenkarzinom. In der doppelblinden, placebokontrollierten, randomisierten Phase-II-Studie FIGHT wurde die zusätzliche Gabe von Bemarituzumab, einem FGFR2b-gerichteten IgG1-Antikörper, zu mFOLFOX6 bei insgesamt 155 Patienten mit zuvor nicht behandeltem, nicht resektablem, HER2-negativem lokal fortgeschrittenem oder metastasiertem Adenokarzinom des Magens oder des gastroösophagealen Übergangs untersucht.3 Die als Phase III geplante Studie wurde nach Rekrutierung von 155 Patienten in eine Proof-of-Concept-Studie der Phase II umgewandelt.
Die in die FIGHT-Studie eingeschlossenen Patienten waren median 60 Jahre alt und in nahezu 60% der Fälle asiatischen Ursprungs. Das PFS innerhalb der ITT-Population (primärer Endpunkt) wurde durch die Bemarituzumab-Gabe von median 7,4 auf 9,5 Monate verlängert (HR: 0,68; 95% CI: 0,44–1,04; p=0,0727). Nach 9 Monaten waren 52,5% versus 33,8% ohne Progress. Für das OS wurde der Median im Bemarituzumab-Arm noch nicht erreicht und betrug im Placebo-Arm 12,9 Monate (HR: 0,58; 95% CI: 0,35–0,95; p=0,0268). Die 12-Monats-OS-Rate betrug 65,3% versus 56,9%. Ein Ansprechen zeigten 47% versus 33% der Patienten beider Studienarme, mit einer medianen Remissionsdauer von 12,2 Monaten versus 7,1. An Nebenwirkungen traten insbesondere Stomatitis und trockene Augen häufiger im Bemarituzumab-Arm auf. 26,3% der Patienten brachen die Bemarituzumab-Therapie aufgrund von Nebenwirkungen auf die Cornea ab.Die Ergebnisse befürworten die Durchführung einer prospektiven randomisierten Phase-III-Studie, so das Fazit der Autoren.
Leberzellkarzinom: Atezolizumab plus Bevacizumab in der ersten Therapielinie
Die Kombination des PD-L1-Inhibitors Atezolizumab und des „vascular endothelial growth factor receptor“(VEGFR)-Antikörpers Bevacizumab wurde in der Phase-III-Studie IMbrave150 für die Therapie von nicht vorbehandelten Patienten mit nicht resezierbarem Leberzellkarzinom (HCC) untersucht. Die Studie erreichte in der Primäranalyse den primären Endpunkt, eine im Vergleich mit Sorafenib signifikante Reduktion des Risikos zu sterben um 42% (HR: 0,58; 95% CI: 0,42–0,79; p<0,001) und der Tumorprogression um 41% (HR: 0,59; 95% CI: 0,47–0,76; p<0,001). Aufgrund der überlegenen Ergebnisse wurde die Rekrutierung in die Studie gestoppt. Der Median war für das OS – nach einer medianen Nachbeobachtungszeit von 8,6 Monaten – im Kombinationsarm noch nicht erreicht und betrug unter Sorafenib 13,2 Monate. Beim ASCO GI 2021 wurden aktualisierte Ergebnisse mit einer medianen Nachbeobachtungszeit von 15,6 Monaten präsentiert.4
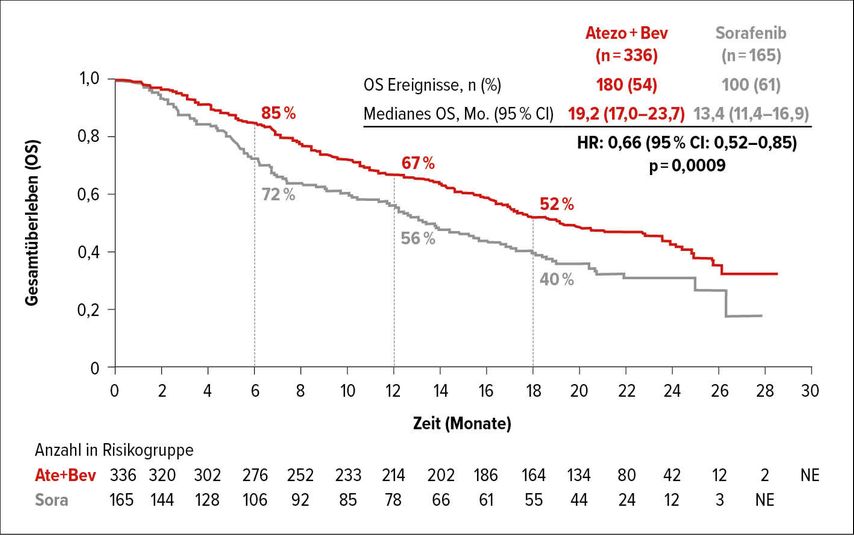
In der IMbrave150-Studie erhielten 501 HCC-Patienten mit lokal fortgeschrittener oder metastasierter und/oder nicht resektabler Erkrankung ohne vorangegangene systemische Therapie 2:1randomisiert Atezolizumab (1200mg, q3w) plus Bevacizumab (15mg/kg, q3w) oder Sorafenib (400mg, b.i.d.) bis zum Verlust eines klinischen Nutzens oder bis zu nicht akzeptierbarer Toxizität. In der aktualisierten Auswertung wurde die Überlegenheit von Atezolizumab plus Bevacizumab gegenüber Sorafenib bestätigt. Die OS-Kaplan-Maier-Kurven separierten sich früh und blieben mit OS-Raten von 85% vs. 72% nach 6 Monaten, 67% vs. 56% nach 12 Monaten und 52% vs. 40% nach 18 Monaten konsistent getrennt (Abb. 3). Der Median für das OS war nun auch im Kombinationsarm erreicht und betrug 19,2 versus 13,4 Monate (HR: 0,66; 95% CI: 0,52–0,85; p=0,0009). Bezüglich der aktualisierten Ergebnisse zum PFS waren 55% versus 38% der Patienten nach 6 Monaten, 35% versus 21% nach 12 Monaten und 24% versus 12% nach 18 Monaten ohne Progress (HR: 0,65; 95% CI: 0,53–0,81; p=0,0001).
Abb. 3: Gesamtüberleben (OS) unter Erstlinientherapie mit Atezolizumab plus Bevacizumab versus Sorafenib (nach Finn et al.)4
Ein bestätigtes Ansprechen nach RECIST-1.1-Kriterien zeigten 30% der Patienten unter Atezolizumab plus Bevacizumab versus 11% der Patienten unter unter Sorafenib, nach HCC-mRECIST-Kriterien waren es 35% versus 14%. Die mediane Dauer des Ansprechens betrug 18,1 versus 14,9 Monate nach RECIST-Kriterien sowie 16,3 versus 12,6 Monate nach HCC-mRECIST-Kriterien.
Leberzellkarzinom: Nivolumab plus Ipilimumab in der zweiten Therapielinie
Die doppelte Immunblockade mit Nivolumab plus Ipilimumab wurde in der zweiten Therapielinie des HCC, nach Sorafenib-Versagen, untersucht. Die dreiarmige, offene, multizentrische Phase-I/II-Studie CheckMate 040 prüfte drei verschiedene Dosiskombinationen bei insgesamt 148 HCC-Patienten. Beim ASCO GI wurden Ergebnisse mit einer Nachbeobachtungszeit von mindestens 44 Monaten und median 46,5 Monaten präsentiert.5 Sie stützen die Entwicklung von Nivolumab 1mg plus Ipilimumab 3mg als Zweitlinientherapie des fortgeschrittenen HCC.
In Arm A und B erhielten die Patienten jeweils vier Zyklen Nivolumab (A: 1mg/kg; B: 3mg/kg; q3w) plus Ipilimumab (A: 3mg/kg; B: 1mg/kg; q3w) gefolgt von 240mg Nivolumab (q2w) bis Tumorprogress versus in Arm C alle zwei Wochen 3mg/kg Nivolumab (3mg/kg, q2w) plus alle sechs Wochen 1mg/kg Ipilimumab (1mg/kg, q6w) bis Tumorprogress. Primäre Studienendpunkte waren die Sicherheit sowie Ansprechen und Dauer des Ansprechens.
Die Patienten wurden über einen Zeitraum von median 2,3–5,1 und einer Spanne von 0–52 Monaten mit einem der Nivolumab-Ipilimumab-Regime behandelt. 31–32% der Patienten in den drei Studienarmen erreichten ein Ansprechen, mit kompletten Remissionen bei 8% (Arm A), 6% (Arm B) und 2% (Arm C) der Patienten. Die Zeit bis zum Ansprechen betrug 2,0–2,7 Monate und die Dauer des Ansprechens 17,5 (Arm A) versus 22,2 (Arm B) versus 16,6 (Arm C) Monate. Eine Kontrolle der Erkrankung wurde bei 54%, 43% und 49% der Patienten in den drei Studienarmen erreicht, mit einer medianen Dauer von 16,6, 16,5 und 11,5 Monaten. Das mediane OS betrug 22,2 versus 12,5 versus 12,7 Monate mit 36-Monats-OS-Raten von 42%, 26% bzw. 30%.
Quelle:
Gastrointestinal Cancers Symposium (ASCO GI), 15.–17. Jänner 2021
Literatur:
1 Shiu KK et al.: ASCO GI 2021; Abstr. #6 2 Golan T et al.: ASCO GI 2021; Abstr. #378 3 Wainberg ZA et al.: ASCO GI 2021; Abstr.#160 4 Finn RS et al.: ASCO GI 2021; Abstr. #267 5 El-Khoueiry AB et al.: ASCO GI 2021; Abstr. #269