Ursachenabklärung des ischämischen Schlaganfalls
Klinik für Neurologie<br>Universitätsspital Zürich<br>E-Mail: valeriecornelia.schuetz@usz.ch
Klinik für Neurologie<br>Universitätsspital Zürich<br>E-Mail: Mira.Katan@usz.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der ischämische Schlaganfall ist eine heterogene Erkrankung. Zwar kommt es dabei definitionsgemäss immer zu einer persistierenden oder vorübergehenden zerebralen Durchblutungsstörung, aber die Ursachen einer solchen sind mannigfaltig. Die Suche nach der zu-grunde liegenden Ursache ist essenziell. Sie dient der bestmöglichen Akuttherapie, der Verhinderung von Folgekomplikationen und vor allem der «massgeschneiderten» anschliessenden Sekundärprävention.
Keypoints
-
Die Einteilung der Ätiologie sollte neben der klassischen TOAST-Klassifikation über die ASCOD-Klassifikation und das CSS-System erfolgen, da sie im Gegensatz zur TOAST-Klassifikation koexistierende Morbiditätsfaktoren im Zusammenhang mit der Ätiologie berücksichtigen.
-
Zur Entscheidung einer intensivierten Suche nach unentdecktem Vorhofflimmern empfiehlt es sich, folgende Parameter einzubeziehen: den echokardiografischen Nachweis eines vergrösserten Vorhofohrs sowie bestimmte EKG-Veränderungen, vor allem Veränderungen der P-Welle wie z.B. «P-terminal force» in Ableitung V1, und die Blut-Biomarker wie z.B. das MRproANP oder auch NTproBNP.
-
Weitere vielversprechende Blutbiomarker zur besseren ätiologischen Einordnung des Schlaganfalles wären z.B. auch: Lp(a) (Makroangiopathisch), D-Dimere (Malignome, PFO).
-
Bei Hautveränderungen oder auch einer Livedo racemosa sowie Artrhalgien sollte auch eine zerebrale Vaskulitis abgeklärt werden – in seltenen Fällen sind diese auch erregerbedingt und entsprechend behandelbar.
-
Bei jüngeren Patienten und Häufung von Schlaganfällen in der Familie sowie natürlich bei typischen Zusatzsymptomen sollte – auch wenn selten – an eine genetische Ursache gedacht werden.
Bei der Sekundärprävention kann man grob zwischen der therapeutischen Einstellung, den allgemeinen vaskulären Risikofaktoren (Blutdruck, Dyslipidämie, Diät, etc.) bei allen Schlaganfallpatienten, sowie der spezifischen Therapie basierend auf der Ätiologie unterscheiden.
Einteilung der Ätiologie
Klassischerweise erfolgt die Unterteilung nach der 1993 definierten «Trial of Org. 10172 in Acute Stroke Treatment» (TOAST)-Klassifikation. Hierbei erfolgt die Einteilung in fünf verschiedene Ätiologien nach dem primär vermuteten zugrunde liegenden Mechanismus bzw. dem Vorhandensein einer zugrunde liegenden Erkrankung die zu eben der stattgehabten Durchblutungsstörung geführt hat. Die Einteilung basiert auf der Grundlage des klinischen Eindruckes und der diagnostischen Resultate:1
-
TOAST 1 – makroangiopathisch (symptomatische Stenosen von mindestens 50% an den grossen hirnversorgenden Gefässen, ipsilateral zur Ischämie)
-
TOAST 2 – kardioembolisch (z.B. Vorhofflimmern, intrakardialer Thrombus, persistierendes Foramen ovale)
-
TOAST 3 – mikroangiopathisch (lakunäre Infarkte mit Läsionen kleiner als 1,5cm Durchmesser)
-
TOAST 4 – andere eindeutige Ätiologie (z.B. Vaskulitis, Gerinnungsstörung, Dissektion)
-
TOAST 5 – nicht eindeutige Ätiologie
1. zwei oder mehr Ursachen identifiziert (konkurrierende Ursachen)
2. unklare Ätiologie trotz ausgedehnter Abklärung
3. inkomplette Abklärung (z.B. bei frühzeitigem Versterben, Patient möchte Abklärungen nicht)
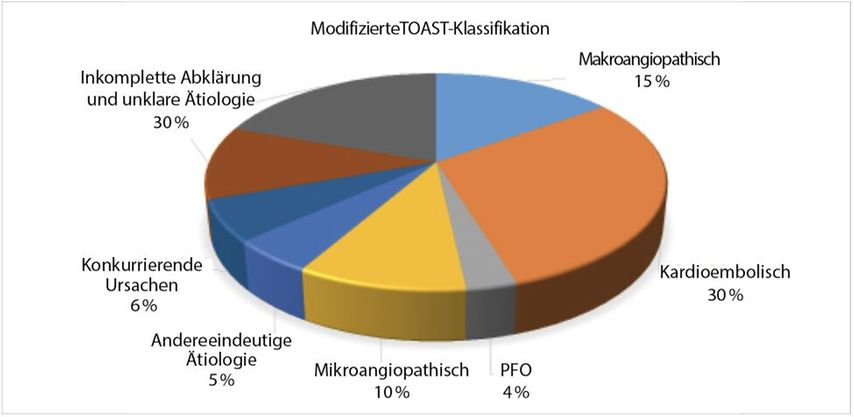
Abb. 1: Einteilung der Ätiologie gemäss der modifizierten TOAST-Klassifikation anhand von Daten aus der prospektiven Schlaganfall-Studie BIOSIGNAL mit 1759 Patienten, eingeschlossen von 2014 bis 2017. Die Subgruppe «Kardioembolisch» wurde in zwei Kategorien aufgeteilt: in die Subgruppe «Kardioembolischer Schlaganfall aufgrund eines PFO» und in die Subgruppe «Kardioembolischer Schlaganfall durch Vorhofflimmern/intrakardiale Thromben ohne Nachweis eines PFO»
Neben der alten, aber am häufigsten verwendeten TOAST-Klassifikation gibt es noch neuere Klassifikationen, wie das
ASCOD-Klassifikationssystem oder das «Causative Classification of Stroke (CCS)»-System.2, 3
Bei der ASCOD-Klassifikation handelt es sich um ein System, welches auch Überlappungen der zugrunde liegenden Schlaganfallätiologie und die Wahrscheinlichkeit zwischen dem «Index-Stroke» und jeder einzelnen Kategorie berücksichtigt.3 2009 wurde ASCO von Amarenco et al. eingeführt und 2013 um das D – für Dissektion – ergänzt.3
Die Kategorien werden in A – «athero-
sclerosis», S – «small-vessel disease»,C– «car- diac», O – «other», D – «dissection» unterteilt.Den verschiedenen Kategorien, auch Phänotypen genannt, werden dann verschiedene Kausalitätsgrade zugeteilt (Tab. 1):

Tab. 1: Gradeinteilung der Grunderkrankungen in der ASCOD-Klassifikation; diese werden vorangehend in fünf unterschiedliche Phänotypen eingeteilt und danach in die Grade 1 – 2 – 3 – 0 – 93
Im Gegensatz zur TOAST- und ASCOD-Klassifikation basiert das CCS-System auf einem Online-Formular, das wie ein Fragebogen aufgebaut ist.4 Über einen Link werden Markierungsfelder angeklickt und die verschiedenen Kombinationen dieser Markierungsfelder werden über einen auf Wahrscheinlichkeiten basierenden entscheidungsunterstützenden automatischen Algorithmus ausgewertet.4 Dabei werden klinische, epidemiologische, bildgebende Faktoren sowie Laborinformationen aus der Schlaganfallabklärung berücksichtigt und anhand evidenzbasierter Kriterien die wahrscheinlichste Schlaganfallätiologie identifiziert.4–7
Genau wie bei der ASCOD-Klassifikation erfolgt beim CCS-System die Einteilung der Schlaganfallätiologie in fünf Hauptkategorien nach klinischen Aspekten hinsichtlich des Schlaganfallmechanismus: makroangiopathisch, kardioaortale Embolie, mikroangiopathisch, andere Ursachen und unbestimmte Ursachen. Die Subgruppe der unbestimmten Mechanismen wird weiterhin unterteilt in «kryptogen embolisch», «andere kryptogene Mechanismen», «inkomplette Abklärung» und «nicht klassifizierte Mechanismen». Diese Kategorien werden je nach Evidenzgrad mit dem webbasierten Algorithmus in «evident», «wahrscheinlich» oder «möglich» eingeteilt.4
Alle drei Klassifikationssysteme unterteilen die Schlaganfallsubtypen in die gleichen fünf phänotypischen Hauptkategorien, wobei vor allem die TOAST-Klassifikation die Ätiologie primär hinsichtlich des Vorhandenseins oder Fehlens eines zugrunde liegenden Erkrankungsmechanismus kategorisiert. Das CCS-System betrachtet zudem, welche Ursache bei mehreren konkurrierenden Ätiologien am wahrscheinlichsten ist.8
Das CCS-System und die ASCOD-Klassifikation erlauben eine verfeinerte Unterteilung der Ätiologie – eine Überlappung mehrerer koexistierender Faktoren wird besser abgebildet, zusätzlich zeigte sich für beide Systeme eine gute Interrater-Reliabilität für die Klassifikation von kardioembolischen, makroangiopathischen und anders klassifizierten Schlaganfällen.9, 10
Diagnostik zur ätiologischen Abklärung
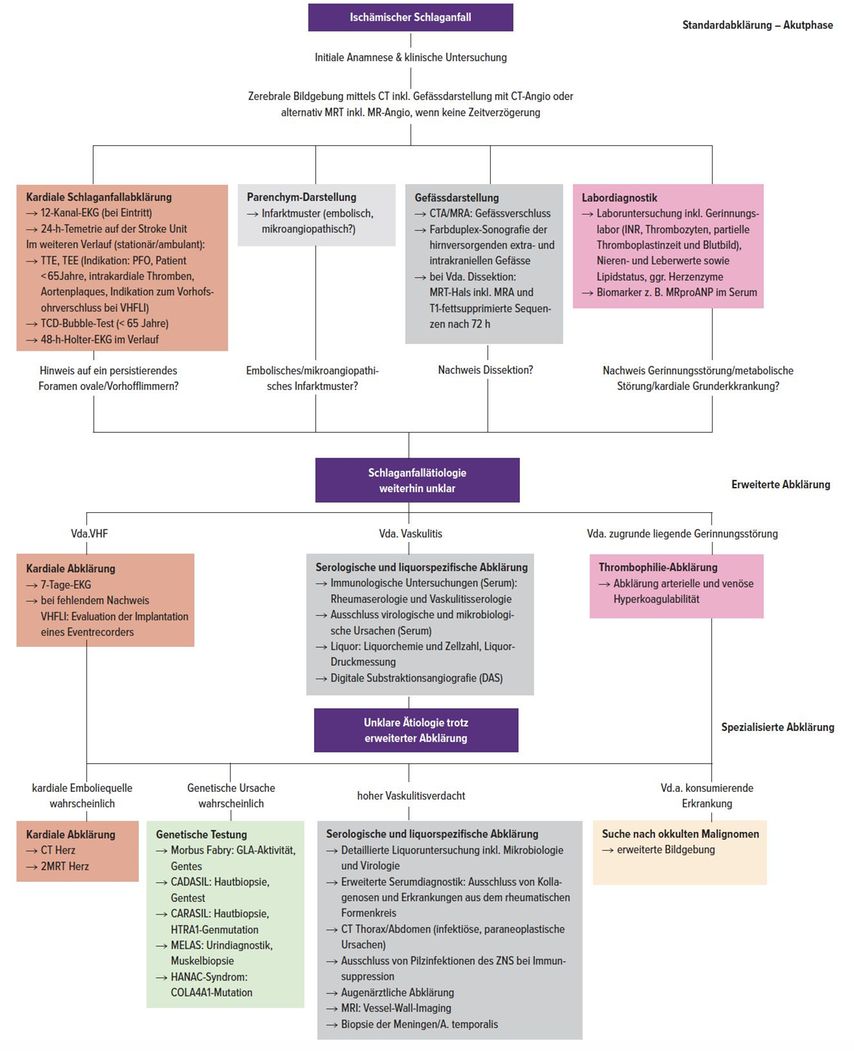
Die Diagnostik gliedert sich grob in zwei Etappen: in die Erstdiagnostik in der Akutphase und die weiterführende Diagnostik, insbesondere zur finalen Festlegung der Sekundärprävention. Die Primärdiagnostik beim akuten ischämischen Schlaganfall beinhaltet für alle Patienten eine zerebrale Bildgebung mittels Gefässdarstellung – CT inklusive CT-Angiografie – und in spezialisierten Zentren insbesondere bei unklarem On-Set der Symptome oder vermuteter Affektion des vertebrobasilären Stromgebiets eine kraniale Magnetresonanztomografie (MRT) inklusive MR-Angiografie.2 Zum Routine-Screening in der Akutphase gehört auch ein 12-Kanal-EKG sowie die Labordiagnostik (Abb. 2). Weiterführende bildgebende Abklärungen wie ein Magnetresonanztomogramm (MRT) des Schädels sind insbesondere auch hilfreich, um anhand des akuten Infarktmusters oder weiterer Parenchymschäden wie z.B. älterer oder klinisch stummer Läsionen sowie Gefässpathologien besser abzuschätzen, welche Infarktmechanismen am wahrscheinlichsten sind.2
Es empfiehlt sich auch nach stattgehabter CT-Angiografie, eine farbduplexsonografische Untersuchung der extra- und intrakraniellen Hirngefässe für die Graduierung potenzieller Stenosen nach den NASCET-Kriterien durchzuführen. Zusätzlich sollte zeitnah, während des stationären Aufenthaltes, bei allen Patienten eine kardiale Abklärung mittels transthorakaler Echokardiografie (TTE) oder transösophagealer Echokardiografie (TEE) erfolgen; insbesondere bei jüngeren Schlaganfallpatienten unter <65 Jahren oder klinischem Verdacht auf eine kardiale Emboliequelle wird an den meisten Zentren in der Schweiz eine TEE und ein Bubble-Test mittels TCD empfohlen, um ein persistierendes Foramen ovale (PFO) oder selten auch einen anderen Shunt zu detektieren.2, 11
Bei vielen Schlaganfällen bleibt die Ätiologie weiterhin unklar
Trotz dieser Standarddiagnostik werden aber immer noch bis zu 40% aller ischämischen Schlaganfälle nicht eindeutig klassifiziert.12, 13 Das trifft insbesondere bei jüngeren Patienten zu. Das zeigt, dass die empfohlenen Standardabklärungen häufig nicht ausreichend sind. Sie sollten deshalb entsprechend dem aktuellen Studienstand individualisiert ergänzt werden.
Eine zugrunde liegende kardiale Erkrankung ist trotz initial nicht detektiertem Vorhofflimmern (VHF) häufig. In der multizentrischen Crystal-AF-Studie wurde bei 30% der Patienten, welche initial als «kryptogen» klassifiziert wurden, mittels EKG-Monitorings (Implantation eines Eventrecorders) über 3 Jahre ein intermittierendes VHF entdeckt. Entsprechend wird zur intensiveren Suche nach einem intermittierenden VHF ein prolongiertes EKG-Monitoring (z.B. mittels 7-Tage-EKGs oder wiederholten 48-Std.-Holter-EKGs) und/oder eine Implantation eines Eventrecorders empfohlen.2, 14
Neben dem CHA2DS2-VASc-Score und dem topografischen Infarktmuster werden zunehmend auch Surrogatmarker einer zugrunde liegenden atrialen Kardiopathie wie z.B. der EKG-Parameter «P-terminal force» in der Brustwandableitung V1 einbezogen.14 Dabei handelt es sich um eine Verlängerung des negativen terminalen Anteils der P-Welle mit einer Dauer von mehr als 40ms und einer Tiefe von mehr als 0,1mV. Des Weiteren gilt ein PR-Intervall länger als 200ms als ein Surrogatparameter für das Auftreten von Vorhofflimmern bei kryptogenem Schlaganfall, ebenso scheint eine P-Wellen-Dispersion von mehr als 40ms mit dem Auftreten von Vorhofflimmern assoziiert zu sein.15, 16 Weitere vielversprechende EKG-Marker, die gemäss der aktuellen Studienlage mit einem neu diagnostizierten Vorhofflimmern assoziiert sind, sind der «advanced interatrial block», der durch eine P-Wellenverlängerung von mehr als 120ms in der EKG-Ableitung II sowie eine negative oder biphasische P-Welle in den Extremitätenableitungen II, III, aVF charakterisiert ist, sowie supraventrikuläre Extrasystolen.14, 16–18
Echokardiografisch kann ein erhöhtes Risiko für einen kardioembolischen Schlaganfall ohne bisherigen Nachweis eines Vorhofflimmerns anhand des Ausmasses der Vorhofdilatation und Grösse des linken Vorhofohrs bewertet werden. So zeigt die aktuelle Datenlage, dass das Ausmass der Vorhofdilatation, der linksatriale Volumenindex, die Grösse des linken Vorhofohrs und die Biomarker im Blutserum wie die natriuretischen Peptide (MR-pro-ANP oder NT-proBNP) prädiktive Marker für einen kardioembolischen Schlaganfall sind, ohne dass ein Vorhofflimmern initial detektiert wurde.19–23 In seltenen Fällen reicht ein TTE oder TEE nicht aus und ein Herz-CT-/MR muss ergänzend durchgeführt werden, um eine seltenere vermutete kardiale Emboliequelle auszumachen.12
Zur Klärung der Frage, ob das aktuelle Ereignis mit einem neu identifizierten persistierenden Foramen ovale (PFO) assoziiert ist, sollte nach Bedingungen, die eine paradoxe Embolie begünstigen, gesucht werden (längere Immobilisation, gleichzeitig vorhandene tiefe Beinvenenthrombose/ Lungenembolie, Valsalva-Manöver, welche dem aktuellen Ereignis vorausgingen, erhöhte D-Dimere). Zur besseren Risikostratifikation eines persistierenden PFO wurde daher der «Risk of Paradoxical Embolism (RoPE)»-Score etabliert. Der RoPE-Score berücksichtigt hierbei das Alter und Hypertonus in der Vorgeschichte ebenso wie Schlaganfälle oder transitorische ischämische Attacken in der Vorgeschichte, Rauchen, Diabetes mellitus und kortikale Infarkte in der zerebralen Bildgebung.24
Je weniger Risikofaktoren bei einem Patienten vorliegen und je jünger der Patient ist, desto höher ist die erreichte Punktzahl (Skala 0–10).25 Die Wahrscheinlichkeit eines pathogenen PFO mit zunehmender Zahl an Risikofaktoren und steigendem Alter ändert sich von bis zu 90% (bei 20- bis 30-jährigen Patienten ohne Risikofaktoren) auf praktisch 0% (bei >60-jährigen Patienten und Vorliegen mehrerer Risikofaktoren).26, 27
Nicht nur kardiale Ursachen kommen als Emboliequelle infrage: Es gibt auch immer mehr Hinweise dafür, dass es auch bei nicht hochgradigen Stenosen aufgrund von vulnerablen Plaques zu arterioarteriellen Embolien kommt.28 Durch neue Verfahren wie MRT-basierte Gewebequantifizierung können vulnerable Plaques detektiert werden, zudem gibt es mittlerweile auch dreidimensionalen Ultraschall und kontrastmittelverstärkten Ultraschall, der zu einer verbesserten Detektion von vulnerablen Plaques führen kann. Zur Detektion von Mikroembolien, die aufgrund von vulnerablen Plaques im Bereich der Karotis oder auch intrakraniell auftreten, kann ein transkranielles Doppler-Monitoring erfolgen, das mindestens eine Stunde am Kopf des Patienten im Bereich der Schläfe angebracht werden sollte und Mikroemboliesignale detektieren kann.28–30 Laborchemisch gewinnen auch zunehmend neuere Blut-Biomarker wie z.B. Lipoprotein (a) (Lp[a]) eine Bedeutung.31 Ein Spiegel über 100nmol/l wird mit einem hohen Risiko für kardiovaskuläre Ereignisse assoziiert und von der European Society of Cardiology wird seit 2019 empfohlen, die Messung des Lp(a)-Spiegels einmal im Leben durchzuführen (Klasse-IIa-Empfehlung).32–34 Ebenso zeigte sich in diversen Studien eine Korrelation von Lipoprotein-assoziierter Phospholipase A2 (LpPLA2) mit der Inzidenz von ischämischen Schlaganfällen und im Speziellen auch atherosklerotisch bedingten ischämischen Insulten.35
Sollten die aufgeführten Abklärungen keinen richtungsweisenden Befund hinsichtlich der Schlaganfallätiologie (A – Atherosklerose, S – «small vessel disease», C – «cardial», O – «other», D – Dissektionen) ergeben, sollte eine detaillierte erweiterte Abklärung ergänzt werden. Diese hängt vor allem auch von der gezielten Anamnese und der bisherigen Befundkonstellation ab. Bei proximal embolischem Infarktmuster im MRT, ohne Nachweis einer kardialen oder hämatologischen Grunderkrankung, aber z.B. anamnestischen Hinweisen auf eine B-Symptomatik, sollte an eine tumorassoziierte Genese gedacht werden (v.a. Pankreas- und kleinzelliges Bronchialkarzinom, aber auch Ovarialkarzinom oder andere gynäkologische Tumoren).2
Bei Hautveränderungen, Arthralgie etc. sollten differenzialdiagnostisch eine systemische Vaskulitis oder andere Erkrankungen aus dem rheumatischen Formenkreis wie die Kollagenosen in Betracht gezogen werden (Details siehe Abb. 2).2 Ergeben sich auch in der erweiterten Diagnostik keine richtungsweisenden Ätiologie-bezogenen Befunde, vor allem bei Patienten unter 65 Jahren, kann eine genetische Testung evaluiert werden, auch wenn genetische Ursachen äusserst selten sind. So ergab sich z.B. in Bezug auf Morbus Fabry als Schlaganfallätiologie bei einer europäischen prospektiven Studie von 2011, dass nur 0,6% von 5000 eingeschlossenen jungen Schlaganfallpatienten unter 55 Jahren einen Alpha-Galaktosidase-A-Defizit hatten.36
Literatur:
1 Adams HP Jr. et al.: Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment. Stroke 1993; 24(1): 35-41 2 Hennerici MG et al.: S1-Leitlinie Diagnostik akuter zerebrovaskulärer Erkrankungen. 2017 Deutsche Gesellschaft für Neurologie: Leitlinien für Diagnostik und Therapie in der Neurologie; available from: https://dgn.org/leitlinien/3409-030-117-diagnostik-akuter-zerebrovaskulaerer-erkrankungen-2017 3 Amarenco P: The ASCOD phenotyping of ischemic stroke (updated ASCO phenotyping). Cerebrovasc Dis 2013; 36(1): 1-5 4 Ay H et al.: A computerized algorithm for etiologic classification of ischemic stroke: the causative classification of stroke system. Stroke 2007; 38(11): 2979-84 5 Desai JA et al.: Etiologic classification of TIA and minor stroke by A-S-C-O and causative classification system as compared to TOAST reduces the proportion of patients categorized as cause undetermined. Cerebrovasc Dis 2014; 38(2): 121-6 6 Radu RA et al.: Etiologic classification of ischemic stroke: Where do we stand? Clin Neurol Neurosurg 2017; 159: 93-106 7 Ay H et al.: Pathogenic ischemic stroke phenotypes in the NINDS-stroke genetics network. Stroke 2014; 45(12): 3589-96 8 Arsava EM et al.: Assessment of the predictive validity of etiologic stroke classification. JAMA Neurol 2017; 74(4): 419-26 9 Marnane M et al.: Stroke subtype classification to mechanism-specific and undetermined categories by TOAST, A-S-C-O, and causative classification system: direct comparison in the North Dublin population stroke study. Stroke 2010; 41(8): 1579-86 10 Chatzikonstantinou A et al.: Ischemic stroke in young adults: classification and risk factors. Journal of Neurology 2012; 259(4): 653-9 11 Jung SMH et al.: Stroke Richtlinien Inselspital Bern. http://www.neurologie.insel.ch/fileadmin/neurologie/neurologie_users/Unser_Angebot/Dokumente/Stroke-Richtlinien-20190724.pdf: Inselspital Bern; 2019 12 Saver JL: Cryptogenic Stroke. N Engl J Med 2016; 375(11): e26 13 Kolominsky-Rabas PL et al.: Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence, and long-term survival in ischemic stroke subtypes: a population-based study. Stroke 2001; 32(12): 2735-40 14 Kamel H: Heart-rhythm monitoring for evaluation of cryptogenic stroke. N Engl J Med 2014; 370(26): 2532-3 15 Thijs VN et al.: Predictors for atrial fibrillation detection after cryptogenic stroke: results from CRYSTAL AF. Neurology 2016; 86(3): 261-9 16 Acampa M et al.: Atrial cardiopathy and sympatho-vagal imbalance in cryptogenic stroke: pathogenic mechanisms and effects on electrocardiographic markers. Front Neurol 2018; 9: 469 17 Suzuki S et al.: Usefulness of frequent supraventricular extrasystoles and a high CHADS2 score to predict first-time appearance of atrial fibrillation. Am J Cardiol 2013; 111(11): 1602-7 18 Mendieta G et al.: Advanced interatrial block: a predictor of covert atrial fibrillation in embolic stroke of undetermined source. J Electrocardiol 2020; 58: 113-8 19 De Marchis GM et al.: Midregional proatrial natriuretic peptide improves risk stratification after ischemic stroke. Neurology 2018; 90(6): e455-e65 20 Katan M et al.: Midregional pro-atrial natriuretic peptide and outcome in patients with acute ischemic stroke. J Am Coll Cardiol 2010; 56(13): 1045-53 21 Katan M et al.: Procalcitonin and midregional proatrial natriuretic peptide as biomarkers of subclinical cerebrovascular damage: The Northern Manhattan Study. Stroke 2017; 48(3): 604-10 22 Llombart V et al.: B-type natriuretic peptides help in cardioembolic stroke diagnosis: pooled data meta-analysis. Stroke 2015; 46(5): 1187-95 23 Jordan K et al.: Left atrial volume index is associated with cardioembolic stroke and atrial fibrillation detection after embolic stroke of undetermined source. Stroke 2019; 50(8): 1997-2001 24 Kent DM, Thaler DE: Ro PESI. The risk of paradoxical embolism (RoPE) study: developing risk models for application to ongoing randomized trials of percutaneous patent foramen ovale closure for cryptogenic stroke. Trials 2011; 12: 185 25 Diener HC et al.: Kryptogener Schlaganfall und offenes Foramen ovale. S2eLeitlinie Deutsche Gesellschaft für Neurologie: Leitlinien für Diagnostik und Therapie in der Neurologie; updated 2018 26 Wessler BS et al.: The RoPE score and right-to-left shunt severity by transcranial Doppler in the CODICIA study. Cerebrovasc Dis 2015; 40(1-2): 52-8 27 Kent DM et al.: An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. 2013; 81(7): 619-25 28 Bang OY et al.: Evaluation of cryptogenic stroke with advanced diagnostic techniques. Stroke 2014; 45(4): 1186-94 29 Droste DW et al.: Variability in occurrence of embolic signals in long term transcranial Doppler recordings. Neurol Res 1996; 18(1): 25-30 30 Ringelstein EB et al.: Consensus on microembolus detection by TCD. International Consensus Group on Microembolus Detection. Stroke 1998; 29(3): 725-9 31 Gencer B, Kronenberg F, Stroes ES, Mach F: Lipoprotein(a): the revenant. Eur Heart J 2017; 38(20): 1553-60 32 Mach F et al.: 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41(1): 111-88 33 Lange KS et al.: Lipoprotein(a) levels and recurrent vascular events after first ischemic stroke. Stroke 2017; 48(1): 36-42 34 Wilson DP et al.: Use of lipoprotein(a) in clinical practice: a biomarker whose time has come. A scientific statement from the National Lipid Association. J Clin Lipidol 2019; 13(3): 374-92 35 Katan M et al.: Lipoprotein-associated phospholipase A2 is associated with atherosclerotic stroke risk: the Northern Manhattan Study. PLoS One 2014; 9(1): e83393 36 Rolfs A et al.: Acute cerebrovascular disease in the young: The Stroke in Young Fabry Patients Study. Stroke 2013; 44(2): 340-9
Das könnte Sie auch interessieren:
Blutbiomarker-Diagnostik in der klinischen Praxis: Anwendungsempfehlungen
Blutbasierte Biomarker (BBM) eröffnen neue Möglichkeiten für die frühzeitige Diagnostik der Alzheimererkrankung. Sie könnten die Identifikation von Patient:innen mit kognitiven ...
Optische Kohärenztomografie bei Multipler Sklerose – wie viel ist genetisch?
Mit der optischen Kohärenztomographie kann durch die Messung retinaler Schichtatrophie die neuroaxonale Schädigung bei Multipler Sklerose erfasst werden. Eine neue Studie gibt Einblick ...
APOE und Anti-Amyloid-Therapien: Genetik im klinischen Alltag
Mit der Zulassung der ersten krankheitsmodifizierenden Therapien hat ein Paradigmenwechsel in der Behandlung der Alzheimerkrankheit begonnen. Anti-Amyloid-Antikörper können den ...