Therapie der Epilepsien: aktueller Stand und zukünftige Perspektiven
Autorin:
Priv.-Doz. Dr. Alexandra Astner-Rohracher
Universitätsklinik für Neurologie
Medizinische Universität Innsbruck
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Leitliniengerechte medikamentöse Therapie unter Berücksichtigung von Epilepsiesyndrom, Alter, Geschlecht und Komorbiditäten stellt den Goldstandard der Epilepsiebehandlung dar. Durch neue Entwicklungen auf dem Gebiet der Pharmakotherapie und die zunehmende Bedeutung der „targeted therapy“ bei seltenen genetischen Epilepsien unterliegt die medikamentöse Epilepsietherapie einem stetigen Fortschritt. Auch auf dem Gebiet der Epilepsiechirurgie eröffnen sich durch neue Neuromodulationsverfahren und nichtinvasive operative Techniken weitere Therapieoptionen für Menschen mit medikamentös therapieresistenter Epilepsie.
Keypoints
-
Die medikamentöse Behandlung mit Anfallssuppressiva (ASM) stellt den Goldstandard in der Therapie der Epilepsien dar und richtet sich nach Epilepsiesyndrom, Alter und Geschlecht der Patient:innen.
-
Entsprechend den Leitlinien gilt Lamotrigin als Mittel erster Wahl bei fokalen Epilepsien, Valproinsäure bei genetisch generalisierten und unklassifizierten Epilepsien. Frauen im gebärfähigen Alter, bei denen eine Konzeption nicht mit hohem Maß an Sicherheit ausgeschlossen werden kann, sollten jedoch aufgrund der teratogenen Risiken keine Therapie mit Valproinsäure erhalten, hier werden Lamotrigin und Levetiracetam empfohlen.
-
Neue Anfallssuppressiva wie Cenobamat und Fenfluramin stellen vielversprechende Behandlungsmöglichkeiten für Patient:innen mit gegenüber medikamentöser therapieresistenter Epilepsie und Entwicklungs- und epileptischen Enzephalopathien dar.
-
Etwa ein Drittel aller Menschen mit Epilepsie kann durch medikamentöse Behandlung keine Anfallsfreiheit erzielen und gilt als medikamentös therapieresistent. Die Epilepsiechirurgie mit Neuerungen im Bereich von resektiven und nichtresektiven Verfahren sowie Neuromodulationstechniken stellen für diese Patient:innen eine gute Behandlungsoption dar.
Hintergrund
Epilepsien zählen zu den häufigsten chronischen neurologischen Erkrankungen und betreffen etwa 50–70 Millionen Menschen weltweit.1 Sie stellen eine der Top-5-Ursachen für neurologische Behinderungen dar und sind mit einer zwei- bis dreifach erhöhten Mortalität assoziiert.2
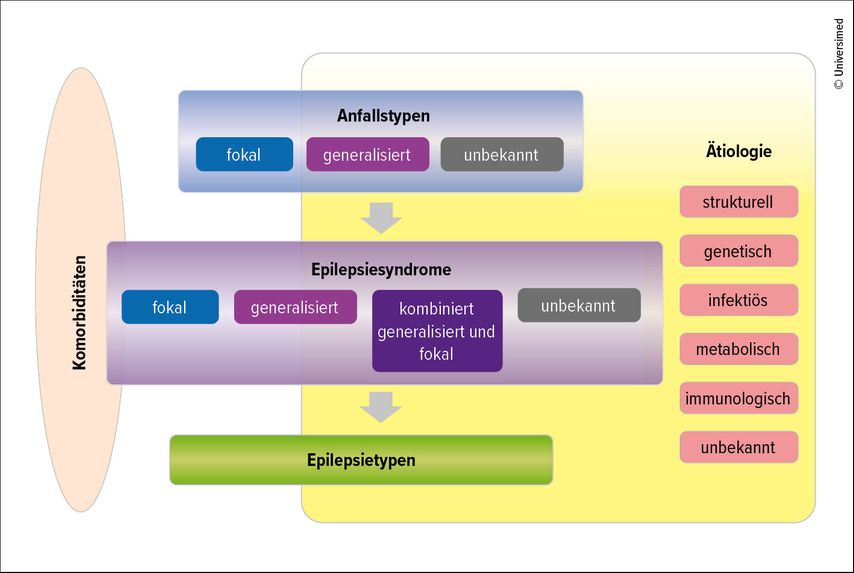
Die Diagnose einer Epilepsie wird gestellt nach mindestens zwei unprovozierten epileptischen Anfällen im Abstand von mehr als 24 Stunden oder nach einem unprovozierten Anfall und bildgebenden oder elektrophysiologischen Befunden, die eine >60%ige Wahrscheinlichkeit für weitere Anfälle erwarten lassen.3 Epilepsien werden entsprechend Anfallstyp, Ursache und Komorbiditäten in fokale, generalisierte, fokale und generalisierte sowie unklassifizierte Epilepsien unterteilt (Abb. 1).4 Diese Einteilung ist sowohl für die medikamentöse Behandlung als auch für die Prognose und die Therapieoptionen bei fehlendem Ansprechen auf medikamentöse Therapie von großer Relevanz.
Abb. 1: Klassifikation der Epilepsien der Internationalen Liga gegen Epilepsie (ILAE) (nach Scheffer IE et al.)4
Medikamentöse Therapien: Leitlinien und Geschlechteraspekte
Die medikamentöse Behandlung mit Anfallssuppressiva ist der Goldstandard in der Therapie der Epilepsie. Ziel ist es, das Risiko weiterer Anfälle zu reduzieren und optimalerweise Anfallsfreiheit zu erreichen. Da anhand der aktuellen Studienlage keine Prävention der Entwicklung einer Epilepsie z.B. nach einem Schlaganfall möglich ist5 und verfügbare Medikamente ausschließlich epileptische Anfälle unterdrücken, nicht jedoch die Epilepsie selbst behandeln können, erfolgte eine Änderung der Terminologie von Antiepileptikum bzw. Antikonvulsivum zu Anfallssuppressivum (ASM).6
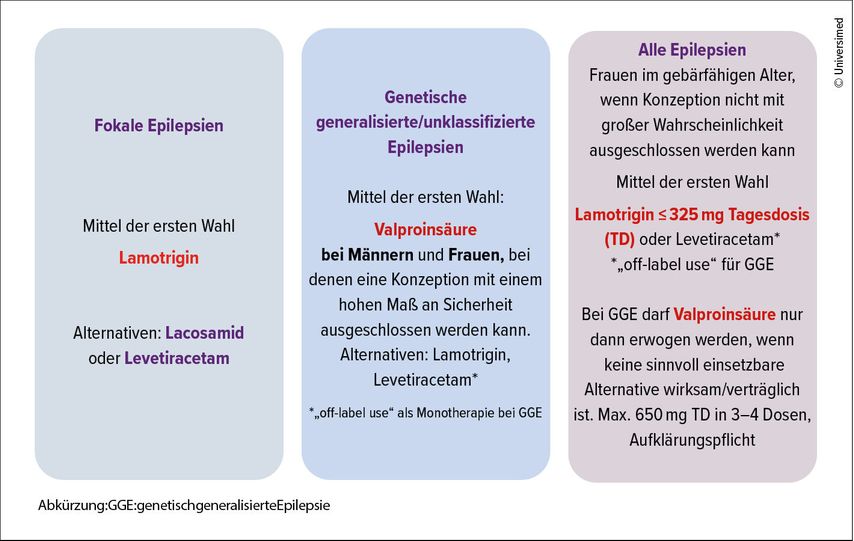
Die Wahl des geeigneten ASM erfordert eine differenzierte Herangehensweise unter Berücksichtigung von Epilepsiesyndrom, Geschlecht und Alter der Patient:innen sowie Einbeziehung von Komorbiditäten und Risikofaktoren. Entsprechend den Leitlinien wird bei fokalen Epilepsien Lamotrigin (LTG) als Erstlinientherapie empfohlen.7 Bei genetischen generalisierten Epilepsien (GGE) und unklassifizierten Epilepsien stellt Valproinsäure (VPA) die Therapie der ersten Wahl dar.8 Dies gilt jedoch nicht für Frauen im gebärfähigen Alter, bei denen eine Konzeption nicht mit hohem Maß an Sicherheit ausgeschlossen werden kann.9 Gründe hierfür sind ein erhöhtes Risiko für schwere kongenitale Fehlbildungen von bis zu 10,3%10 sowie ein 2,4- bis 5-fach erhöhtes Risiko für Autismus-Spektrum-Erkrankungen (ASD) und intellektuelle Beeinträchtigung (ID) bei Kindern, die in utero gegenüber VPA exponiert waren.11, 12 LTG und Levetiracetam (LEV) sollten hier als Erstlinientherapie gewählt werden, wobei Letzteres in Monotherapie bei GGE im „off-label use“ eingesetzt wird (Abb. 2).9
Dies unterstreicht die Wichtigkeit, geschlechterspezifische Aspekte in der medikamentösen Behandlung von Menschen mit Epilepsie zu berücksichtigen. Neben VPA ist auch Topiramat (TPM) mit einem erhöhten Risiko für kongenitale Fehlbildungen von bis zu 6,3%10 und einem 2,8- bis 4-fachen Risiko für ASD und ID assoziiert.12 Basierend auf einer von der Europäischen Arzneimittel-Agentur (EMA) in Auftrag gegebenen und im Jänner 2024 veröffentlichten Studie ergeben sich erstmals auch Hinweise auf ein erhöhtes Risiko für neurologische Entwicklungsstörungen bei Kindern, deren Väter drei Monate präkonzeptionell VPA einnahmen. Trotz methodologischer Kritik an dieser Studie wird aufgrund dessen auch eine umfassende Aufklärung von Männern unter Therapie mit VPA empfohlen, wobei gegebenenfalls eine Therapieanpassung bei Kinderwunsch nach individueller Risiko-Nutzen-Abschätzung erwogen werden kann.13
„Gamechanger“ in der medikamentösen Behandlung und neue Medikamente in der Pipeline
Durch die Entwicklung neuer ASM konnten in den vergangenen Jahrzehnten besonders in puncto Verträglichkeit, aber auch Therapieansprechen bemerkenswerte Fortschritte erzielt werden, wenngleich der Anteil therapieresistenter Patient:innen bei etwa 35% unverändert bleibt.14
Cenobamat
Cenobamat (CNB) (Ontozry®), seit März 2021 durch die EMA zur Zusatztherapie fokaler Epilepsien zugelassen, wird von einigen Expert:innen als potenzieller „Gamechanger“ in der medikamentösen Epilepsiebehandlung gesehen.15 Es zeichnet sich durch einen dualen Wirkmechanismus aus: Einerseits verstärkt es die Inaktivierung spannungsabhängiger Natriumkanäle, andererseits wirkt es als positiver allosterischer Modulator am GABA-A-Rezeptor. In zwei doppelblinden, placebokontrollierten Phase-II-Studien zeigte CNB eine mediane Reduktion der Anfallsfrequenz von bis zu 55,6% (bei 200mg/ 400mg, versus Placebo 21,5–24%)16, 17 und eine Rate von 50%-Respondern (Patient:innen mit 50%iger Reduktion der Anfallsfrequenz) von 50,1%.18 In randomisiert-kontrollierten Studien (RCTs) zur Add-on-Therapie mit ASM der dritten Generation bei fokalen Epilepsien konnte CNB die höchste Anfallsfreiheitsrate von 18% erzielen (LTG 0,8%, LEV < 6,34%).19 Zu den häufigsten Nebenwirkungen zählen dosisabhängig Somnolenz, Schwindel, Gangstörung, Nystagmus und Diplopie. Diese treten besonders in Kombination mit anderen ASM mit ähnlichem Wirkmechanismus wie Benzodiazepinen oder Natriumkanalblockern auf. Aufgrund einer möglichen dosisabhängigen Verkürzung des QTc-Intervalls werden ein 12-Kanal-EKG vor Therapieeinleitung sowie regelmäßige EKG-Kontrollen unter Therapie empfohlen, wobei ein Short-QT-Syndrom eine Kontraindikation darstellt. Weiters wurde das sehr seltene Risiko eines DRESS-Syndroms („drug rash with eosinophilia and systemic symptoms“) beschrieben. Aufgrund von Interaktionen von CNB mit hepatalen CYP450-Isoenzymen (CYP2C19-Inhibitor, CYP3A4- und CYP2B6 Induktor) können Wechselwirkungen mit anderen Medikamenten auftreten.
Fenfluramin
Fenfluramin (FFA), zugelassen als Orphan Drug (Fintepla®) zur Zusatztherapie des Dravet- und Lennox-Gastaut-Syndroms, hat eine bewegte Geschichte: Ursprünglich wurde es als Appetitzügler eingesetzt, dann 1997 wegen des Auftretens von Herzklappenveränderungen und pulmonalarteriellem Hypertonus (PAH) vom Markt genommen. Seine Wirksamkeit beim Dravet-Syndrom wurde bereits in den 1980er/1990er-Jahren entdeckt.20–23 Der Mechanismus, über den FFA eine anfallssuppressive Wirkung entfaltet, ist nicht gänzlich geklärt, wobei serotoninerge Effekte sowie eine positive allosterische Modulation am Sigma-1-Rezeptor vorliegen. Drei RCTs24, 25 und eine Open-Label-Verlängerungsstudie26 bei Dravet-Syndrom zeigten eine „number needed to treat“ (NNT) von 2–3 für eine Reduktion der Anfallsfrequenz von 50–75%, was bei diesen schwer behandelbaren Epilepsiesyndromen mit hochfrequenten Sturzanfällen eine signifikante Verbesserung der Lebensqualität bedeutet. Engmaschige echokardiografische Kontrollen sind aufgrund des Risikos von Herzklappenveränderungen und PAH obligatorisch, Klappenvitien und vorbestehende PAH stellen Kontraindikationen dar. Häufige Nebenwirkungen sind Somnolenz und Müdigkeit sowie gastrointestinale Beschwerden wie Appetitlosigkeit, Erbrechen und Gewichtsverlust.25,27 Durch Interaktionen mit CYP450-Isoezymen (CYP2D6-Inhibitor, CYP2B6- und CYP3A4-Induktor) können relevante Wechselwirkungen mit anderen ASM auftreten.
Cannabidiol
Cannabidiol (CBD) (Epidyolex®) ist zur Zusatztherapie bei Dravet- und Lennox-Gastaut-Syndrom in Kombination mit Clobazam sowie bei tuberöser Sklerose ohne Clobazam zugelassen. Eine systematische Metaanalyse von 16 Studien mit insgesamt 668 Patient:innen ergab eine statistisch signifikante Reduktion der Anfallsfrequenz im Vergleich zu Placebo (SMD: −1,50, 95%CI: −3,47–0,47, p<0,01).28 Darüber hinaus wurde durch Betreuungspersonen eine positive Wirkung auf Stimmung, Wachsamkeit, Kognition, Emotion und Schlaf berichtet.29 Die häufigsten Nebenwirkungen umfassen Sedierung, Diarrhö, Gewichtsverlust und neuropsychiatrische Symptome. Eine systematische Metaanalyse zum Vergleich der Therapieoptionen bei Dravet-Syndrom zeigte, dass CBD mit einer geringeren Anfallsansprechrate als FFA und Stiripentol, aber auch mit einer geringeren Rate an Nebenwirkungen assoziiert war.30
XEN1101 und BHV-7000
Der Blick in die Zukunft der medikamentösen Epilepsietherapie ist vielversprechend. Aktuell befinden sich neue Substanzen in der Entwicklung, die das Potenzial haben, die Behandlungslandschaft weiter zu verändern. XEN1101 (Azetukalner), ein neuartiger Kv7.2/Kv7.3(KCNQ2/3)-Kaliumkanal-Aktivator, zeigte in einer Phase-IIb-Studie bei Erwachsenen mit fokaler medikamentös therapieresistenter Epilepsie eine dosisabhängige und signifikante Reduktion der Anfallsfrequenz von bis zu 52,8% (Placebo: 18,2%; p<0,001) bei guter Verträglichkeit.31 Ein weiterer Kandidat mit ähnlichem Wirkmechanismus ist BHV-7000, ebenso ein selektiver Aktivator des Kv7.2/7.3-Kaliumkanals, der in Phase-I-Studien eine geringere Rate an zentralnervösen Nebenwirkungen zeigte, insbesondere keine Somnolenz, was einen Paradigmenwechsel in der Epilepsietherapie bedeuten könnte.32
Everolimus
Zunehmend gewinnt auch die Rolle der Genetik an Bedeutung, die eine „targeted therapy“ für spezifische genetische Epilepsien ermöglicht. Dies ist besonders bei Erkrankungen wie dem Komplex der tuberösen Sklerose relevant, einer autosomal-dominanten Phakomatose, die durch Mutationen im TSC-1 oder TSC-2-Gen zu einer verminderten Inhibition des mTOR-Signalwegs führt. Hier kommt Everolimus, ein mTOR-Inhibitor, als Add-on-Therapie zum Einsatz.33 Die Identifikation genetischer Ursachen und das Verständnis der zugrunde liegenden Pathophysiologie ermöglichen zukünftig eine präzisere und individualisierte Therapie bei einer Vielzahl von Epilepsien und anderen neurologischen Erkrankungen. Wenngleich viele genetische Ursachen selten sind, stellen diese insbesondere bei jüngeren Patient:innen individuelle Herausforderungen in der Behandlung dar, die nur durch internationale Zusammenarbeit, wie das „rare disease reference network“, adressiert werden können.
Epilepsiechirurgie und Neuromodulation
Etwa 30–35% aller Menschen mit Epilepsie können durch medikamentöse Therapie keine Anfallsfreiheit erreichen und gelten als medikamentös therapieresistent.14, 34 Dies ist definiert als das Versagen von zwei geeigneten und ausreichend dosierten ASM in Mono- oder Kombinationstherapie.35 Epilepsiechirurgie stellt für einen Teil dieser Patient:innen eine potenziell kurative Therapieoption dar, wobei – abhängig vom Epilepsiesyndrom – Anfallsfreiheit in bis zu 70–80% erzielt werden kann.36,37 Voraussetzung für einen epilepsiechirurgischen Eingriff ist die Identifikation einer umschriebenen „epileptogenen Zone“ (EZ) mittels multimodaler prächirurgischer Abklärung, deren Entfernung zu Anfallsfreiheit führen soll.38
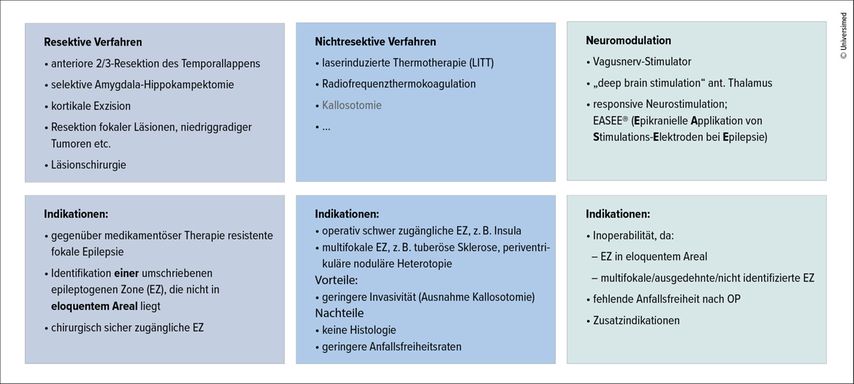
Nichtresektive Verfahren
Neben resektiven Verfahren, wie beispielsweise der anterioren 2/3-Resektion des Temporallappens oder der selektiven Amygdala-Hippokampektomie bei Temporallappenepilepsie (TLE), gewinnen nicht-resektive Techniken zunehmend an Bedeutung.39, 40 Hierzu gehören die laserinduzierte Thermotherapie (LITT)41 und die Radiofrequenzthermokoagulation42, deren Vorteile in der geringeren Invasivität und der Möglichkeit, operativ schwer zugängliche oder multifokale EZ zu behandeln, liegen. Nachteile sind das Fehlen einer Histologie und potenziell geringere Anfallsfreiheitsraten.
Neuromodulation
Ein weiteres zukunftsträchtiges Feld ist die Neuromodulation, die Optionen wie den Vagusnerv-Stimulator, die „deep brain stimulation“ des anterioren Thalamus und die responsive Neurostimulation bietet (Abb. 3).43 Diese kommen bei Inoperabilität aufgrund multifokaler EZ oder Lokalisation des Anfallsursprungs in eloquenten Hirnarealen zum Einsatz und können zwar keine Anfallsfreiheit, jedoch eine signifikante Reduktion der Anfallsfrequenz und Medikamentenlast erzielen. Neue Entwicklungen, wie die epikranielle Applikation von Stimulationselektroden bei Epilepsie (EASEE®), sind hier hervorzuheben.44 Bei dieser Technik werden Stimulationselektroden subkutan epikraniell über dem suspizierten epileptogenen Fokus implantiert, wobei durch Hochfrequenzstimulation eine Unterbrechung der Anfallsaktivität und durch Gleichstromstimulation eine Neuromodulation erzielt werden können. In zwei nichtrandomisierten, unkontrollierten multizentrischen Studien mit 34 Patient:innen mit medikamentös therapieresistenter Epilepsie zeigte EASEE® nach 6 Monaten eine Rate von 50%-Respondern von 53%,44 welche nach 2 Jahren auf 64% anstieg.45 Im Langzeitverlauf zeigte sich eine mediane Reduktion der Anfallsfrequenz von 68% nach 18 bis 24 Monaten, bei einer Retentionsrate von 81% nach 2 Jahren.45 Nebenwirkungen waren zumeist mild und passager, in Form von Kopfschmerzen, lokaler Schwellung und vorübergehender Zunahme der Anfallsfrequenz. EASEE® stellt somit eine wirksame Therapieoption für ausgewählte Patient:innen mit medikamentös therapieresistenter fokaler Epilepsie dar.
Fazit und Ausblick
Der aktuelle Stand der Epilepsietherapie ist geprägt von kontinuierlichen Fortschritten sowohl in der medikamentösen Behandlung als auch in der Epilepsiechirurgie. In Österreich orientiert sich die Therapie an Leitlinien, die auch geschlechterspezifische Aspekte berücksichtigen, insbesondere in Hinblick auf potenziell teratogene Risiken von ASM wie VPA und TPM. Die stetige Entwicklung neuer ASM, wie Cenobamat und Fenfluramin, bietet neue Hoffnung für Patient:innen mit medikamentös therapieresistenten Epilepsien und schwer behandelbaren Entwicklungs- und epileptischen Enzephalopathien. Darüber hinaus sind vielversprechende neue Medikamente, wie die Aktivatoren des KCNQ2/3-Kaliumkanals, in der Pipeline. Die zunehmende Bedeutung der „targeted therapy“ bei Epilepsien mit klarer genetischer Ursache wird die Behandlung weiter revolutionieren. Für Patient:innen mit medikamentös therapieresistenter Epilepsie bieten die Epilepsiechirurgie, insbesondere durch die Entwicklung nichtresektiver Verfahren mit geringerer Invasivität, sowie neue Neuromodulationsansätze wie z.B. EASEE® zusätzliche Behandlungsoptionen. Insgesamt ist die Therapie der Epilepsien auf einem dynamischen Weg, der sich an den individuellen Bedürfnissen der Patient:innen orientiert und zukünftig durch die zunehmende Identifikation genetischer Ursachen weitere Fortschritte verspricht.
Literatur:
1 Feigin VL et al.: Global, regional, and national burden of neurological disorders during 1990-2015: A systematic analysis for the Global Burden of Disease Study 2015. Lancet Neurol 2017; 16(11): 877-97 2 Trinka E et al.: Cause-specific mortality among patients with epilepsy: Results from a 30-year cohort study. Epilepsia 2013; 54(3): 495-501 3 Fisher RS et al.: ILAE official report: A practical clinical definition of epilepsy. Epilepsia 2014; 55(4): 475-82 4 Scheffer IE et al.: ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology. Epilepsia 2017; 58(4): 512-21 5 Koepp M et al.: Prevention of epileptogenesis – are we there yet? Curr Opin Neurol 2024 doi:10.1097/WCO.000000000000 1256 6 Perucca E et al.: Which terms should be used to describe medications used in the treatment of seizure disorders? An ILAE position paper. Epilepsia 2024; 65(3): 533-41 7 Marson A et al.: The SANAD II study of the effectiveness and cost-effectiveness of levetiracetam, zonisamide, or lamotrigine for newly diagnosed focal epilepsy: An open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021; 397(10282): 1363-74 8 Marson A et al.: The SANAD II study of the effectiveness and cost-effectiveness of valproate versus levetiracetam for newly diagnosed generalised and unclassifiable epilepsy: An open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet 2021; 397(10282): 1375-86 9 Holtkamp M et al.: Erster epileptischer Anfall und Epilepsien im Erwachsenenalter, S2k-Leitlinie, 2023, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien. Erster epileptischer Anfall und Epilepsien im Erwachsenenalter. 10 Cohen JM et al.: Comparative safety of sntiseizure medication monotherapy for major malformations. Ann Neurol 2023; 93(3): 551-62 11 Meador KJ et al.: Fetal antiepileptic drug exposure and cognitive outcomes at age 6 years (NEAD study): A prospective observational study. Lancet Neurol 2013; 12(3): 244-52 12 Bjørk M-H et al.: Association of prenatal exposure to antiseizure medication with risk of autism and intellectual disability. JAMA Neurol 2022; 79(7): 672-81 13 Public Assessment Report: Paternal exposure to valproate and risk of neurodevelopmental disorders and congenital malformations in offspring: https://assets.publishing.service.gov.uk/media/675330d420bcf083762a6d47/Valproate-PAR-PASS-_accessible_-_PUBLISH.pdf 14 Chen Z et al.: Treatment outcomes in patients with newly diagnosed epilepsy treated with established and new antiepileptic drugs: A 30-year longitudinal cohort study. JAMA Neurol 2018; 75(3): 279-86 15 French JA. Cenobamate for focal seizures – a game changer? Nat Rev Neurol 2020; 16(3): 133-34 16Chung SS et al.: Randomized phase 2 study of adjunctive cenobamate in patients with uncontrolled focal seizures. Neurology 2020; 94(22): e2311-22 7 Krauss GL et al.: Safety and efficacy of adjunctive cenobamate (YKP3089) in patients with uncontrolled focal seizures: A multicentre, double-blind, randomised, placebo-controlled, dose-response trial. Lancet Neurol 2020; 19(1): 38-48 18 Lattanzi S et al.: Adjunctive cenobamate for focal-onset seizures in adults: A systematic review and meta-analysis. CNS Drugs 2020; 34(11): 1105-20 19 Lattanzi S et al.: Third-generation antiseizure medications for adjunctive treatment of focal-onset seizures in adults: a systematic review and network meta-analysis. Drugs 2022; 82(2): 199-218 20 Schoonjans A et al.: Low-dose fenfluramine significantly reduces seizure frequency in Dravet syndrome: A prospective study of a new cohort of patients. Eur J Neurol 2017; 24(2): 309-14 21 Schoonjans A-Set al.: Low-dose fenfluramine in the treatment of neurologic disorders: Experience in Dravet syndrome. Ther Adv Neurol Disord 2015; 8(6): 328-38 22 Ceulemans B et al.: Successful use of fenfluramine as an add-on treatment for Dravet syndrome. Epilepsia 2012; 53(7): 1131-9 23 Ceulemans B et al.: Five-year extended follow-up status of 10 patients with Dravet syndrome treated with fenfluramine. Epilepsia. 2016; 57(7): e129-34 24 Nabbout R et al.: Fenfluramine for treatment-resistant seizures in patients with dravet syndrome receiving stiripentol-inclusive regimens: a randomized clinical trial. JAMA Neurol 2020; 77(3): 300-8 25 Lagae L et al.: Fenfluramine hydrochloride for the treatment of seizures in Dravet syndrome: A randomised, double-blind, placebo-controlled trial. Lancet 2019; 394(10216): 2243-54 26 Sullivan J et al.: Fenfluramine HCl (Fintepla®) provides long-term clinically meaningful reduction in seizure frequency: Analysis of an ongoing open-label extension study. Epilepsia 2020; 61(11): 2396-404 27 Knupp KG et al.: Efficacy and safety of fenfluramine for the treatment of seizures associated with Lennox-Gastaut Syndrome: a randomized clinical trial. JAMA Neurol 2022; 79(6): 554-64 28 Ong MJY et al.: The use of cannabidiol as adjunctive therapy in adult patients with drug-resistant epilepsy: A systematic review and meta-analysis. Ther Adv Neurol Disord 2025; 18: 17562864251313914 29 Berg AT et al.: Caregiver-reported outcomes with real-world use of cannabidiol in Lennox-Gastaut syndrome and Dravet syndrome from the BECOME survey. Epilepsy Res 2024; 200: 107280 30 Lattanzi S et al.: Pharmacotherapy for Dravet Syndrome: a systematic review and network meta-analysis of randomized controlled trials. Drugs 2023; 83(15): 1409-24 31 French JA et al.: Efficacy and safety of XEN1101, a novel potassium channel opener, in adults with focal epilepsy: A phase 2b randomized clinical trial. JAMA Neurol 2023; 80(11): 1145-54 32 Awsare B et al.: Phase 1 study evaluating the safety and tolerability of BHV-7000, a novel, selective Kv7.2/7.3 potassium channel activator, in healthy adults (P8-1.007). Neurology 2024; 102: doi:10.1212/WNL.0000000000206409 33 Mühlebner A et al.: New insights into a spectrum of developmental malformations related to mTOR dysregulations: Challenges and perspectives. J Anat. 2019; 235(3): 521-42 34 Brodie MJ et al.: Patterns of treatment response in newly diagnosed epilepsy. Neurology 2012; 78(20): 1548-54 35 Kwan P et al.: Definition of drug resistant epilepsy: Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010; 51(6): 1069-77 36 Téllez-Zenteno JF et al.: Long-term seizure outcomes following epilepsy surgery: A systematic review and meta-analysis. Brain 2005; 128(5): 1188-98 37 Jobst BC, Cascino GD: Resective epilepsy surgery for drug-resistant focal epilepsy: A review. JAMA 2015; 313(3): 285-93 38Lüders HO et al.: The epileptogenic zone: General principles. Epileptic Disord 2006; 8 Suppl 2: S1-9 39Quigg M, Harden C: Minimally invasive techniques for epilepsy surgery: Stereotactic radiosurgery and other technologies. J Neurosurg 2014; 121(Suppl): 232-40 40 Nordli Iii DR et al.: Minimally invasive epilepsy surgery. Neuropediatrics 2024; 55(5): 279-88 41 Hoppe C et al.: Laser interstitial thermotherapy (LiTT) in epilepsy surgery. Seizure 2017; 48: 45-52 42 Le Wang et al.: Stereoelectroencephalography-guided radiofrequency thermocoagulation in drug-resistant focal epilepsy. Ann Transl Med 2022; 10(4): 192 43 Rincon N et al.: Neuromodulation in drug resistant epilepsy. Aging Dis 2021; 12(4): 1070-80 44Schulze-Bonhage A et al.: Focal cortex stimulation with a novel implantable device and antiseizure outcomes in 2 prospective multicenter single-arm trials. JAMA Neurol 2023; 80(6): 588-96 45 Schulze-Bonhage A et al.: Long-term outcome of epicranial focal cortex stimulation with the EASEE system in pharmacoresitant focal epilepsy. Clinical Neurophysiology 2024; 159: e2
Das könnte Sie auch interessieren:
Schwelend-fortschreitende Multiple Sklerose
Dank innovativer immunmodulierender und krankheitsmodifizierender Medikamente sind Schübe heute oftmals vermeidbar und Patient:innen, die heute die Diagnose MS erhalten, haben eine ...
Prognosemarker in der Schlaganfallrehabilitation
In den vergangenen Jahrzehnten sind zahlreiche Publikationen zur frühzeitigen Abschätzung des Rehabilitationserfolges nach Schlaganfall unter Einschluss von klinischen Parametern und ...
Insomnie: Diagnostik, Phänotypen und innovative Therapieansätze
Insomnie zählt zu den häufigsten und hartnäckigsten Schlafstörungen mit erheblichen Folgen für die Lebensqualität. Die umfassende Schlafanamnese und die kognitive Verhaltenstherapie sind ...