Modulation der Neuroplastizität eröffnet neue Chancen in der Schlaganfallrehabilitation
Autor:
Prim. Dr. Andreas Winkler
Zentrum für Neurologische RehabilitationKlinik Pirawarth Bad Pirawarth
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nach Angaben der Weltgesundheitsorganisation erleiden jedes Jahr weltweit über 15 Millionen Menschen einen Schlaganfall. Davon sterben 5 Millionen und weitere 5 Millionen sind dauerhaft behindert. Laut epidemiologischen Studien (GBD 2016) liegt das geschätzte globale Lebenszeitrisiko für einen Schlaganfall für Personen im Alter ab 25 Jahren bei knapp 25%.
Obwohl dank der verbesserten Möglichkeiten in der Schlaganfallprävention und -akutbehandlung, insbesondere mittels Lysetherapie bzw. Thrombektomie, die Schlaganfallmortalität rückläufig ist, hat die Zahl der Menschen, die mit den Folgen eines Schlaganfalls leben, aufgrund der wachsenden und alternden Bevölkerung in den letzten Jahren auch in Österreich kontinuierlich zugenommen. So gehen Hochrechnungen davon aus, dass derzeit rund 100000 Menschen in Österreich mit den Folgen eines Schlaganfalls zu leben haben, jährlich kommen ca. 25000 neue Erkrankungsfälle hinzu (ÖGSF). Die steigende Zahl der Schlaganfallüberlebenden generiert einen enormen Bedarf an rehabilitativen Leistungen. Neue, wirksamere Methoden der Schlaganfallrehabilitation sind deshalb besonders notwendig und gefordert.
Subgruppenanalyse der IMPULSE-Studie soll die Bedeutung von BDNF als prädiktivem Reha-Marker klären
Der „brain-derived neurotrophic factor“ (BDNF) gehört zur Familie der Neurotrophine und spielt eine wichtige Rolle beim axonalen und dendritischen Wachstum von Neuronen und der Gehirnplastizität. Zudem stellt er einen wesentlichen Mediator der Effekte der nichtinvasiven Hirnstimulation dar. Die Proform von BDNF (pro-BDNF) wird in den synaptischen Spalt ausgeschüttet und dort durch die Protease Plasmin zum maturen BDNF abgebaut. BDNF fördert die synaptische Plastizität und eine Langzeitpotenzierung. Die BDNF-Konzentration im Gehirn, aber auch im Serum wird durch verschiedene Faktoren beeinflusst. Sie ist z.B. durch Stress vermindert und wird durch Lernprozesse, verschiedene antidepressive Therapiemodalitäten, körperliche Aktivität und Diät erhöht. Inwieweit die Bestimmung der BDNF-Serumspiegel eine diagnostische oder prognostische Aussage erlaubt, ist derzeit Gegenstand der Untersuchungen und dem wird auch im Rahmen einer Subgruppe der IMPULSE-Studie nachgegangen. Daneben könnte die gezielte Beeinflussung der BDNF-Verfügbarkeit, wie z.B. durch die indirekte BDNF-Erhöhung durch Cerebrolysin® oder andere Maßnahmen, für die Therapie und möglicherweise auch für die Förderung der motorischen Funktionserholung nach Schlaganfall an Bedeutung gewinnen.
Neuroplastizität als Key-Target in der Rehabilitation
Neuroplastizität wird heute generell als jene Eigenschaft des Nervensystems verstanden, nach der unser neuronales System seine Aktivität als Reaktion auf intrinsische oder extrinsische Reize zu verändern vermag. Dies erfolgt, indem unser Nervensystem seine Morphologie, Funktion oder Konnektivität adaptiert und reorganisiert. Eine grundlegende Eigenschaft von Neuronen ist ihre Fähigkeit, die Bindungsstärke und Wirksamkeit der synaptischen Übertragung durch eine Vielzahl von aktivitätsabhängigen Mechanismen zu verändern, was unter dem Terminus synaptische Plastizität zusammengefasst wird. Die Forschung des letzten Jahrhunderts hat gezeigt, dass neuronale Plastizität eine fundamentale Eigenschaft des menschlichen Nervensystems ist, die einer Modulation durch externe Trigger zugänglich ist. Trotz intensiver Erforschung der Mechanismen, die die synaptische Plastizität bedingen, ist es letztlich immer noch ungeklärt, wie die Plastizität die Morphologie und Physiologie des Gehirns formt. Besonders im Bereich der Neurorehabilitation ist deshalb das Studium der synaptischen Plastizität derzeit besonders in den Fokus wissenschaftlichen Interesses gerückt
Frequenz, Intensität und Spezifität rehabilitativer Maßnahmen entscheidend
Neben dem frühzeitigen Beginn rehabilitativer Maßnahmen gilt es vor allem die erforderlichen hohen Schwellenwerte an Intensität und Frequenz der Trainingspro- gramme zu erreichen, die notwendig sind, um klinisch relevante Verbesserungen er- zielbar zu machen. Die derzeit in rehabilitativen Settings verabreichten „Dosierun- gen“ an Reha-Therapie liegen zumeist weit unter den dafür notwendigen Grenzwerten: So konnte in rezenten Arbeiten gezeigt werden, dass zwischen 90 und 300 Stunden an spezifischer funktioneller Therapie notwendig sind, um auch bei Schlaganfallpatienten in chronischen Stadien (> 6 Monate) noch statistisch signifikante und vor allem klinisch relevante Verbesserungen in der Handfunktion zu erzielen (Ward N.S., 2019; Mc Cabe, 2015).
Nichtinvasive Stimulationsmethoden fördern neuronale Plastizität
Da derart hohe Intensitäten und Frequenzen unter gängigen Routinebedingungen derzeit nicht erzielbar sind, besteht großes Interesse an additiven Therapiemodalitäten, die den Output rehabilitativer Maßnahmen bahnen bzw. verstärken können. Die rehabilitationsvermittelte Erholung motorischer Funktionen hängt weitgehend von Lernprozessen und somit von der neuronalen Plastizität ab, sodass Manipulationen, welche die Plastizität fördern, die Ergebnisse der Rehabilitation verbessern könnten. In der jüngeren Vergangenheit konnte sich die klinische Neurophysiologie vor allem im Bereich der Neurorehabilitation als eine wesentliche Therapieoption etablieren. Die nichtinvasive Hirnstimulation, insbesondere die transkranielle Magnet- und Gleichstromstimulation, wird mit zunehmend besserer Evidenzlage bei einer Vielzahl von Indikationen eingesetzt. Eine stetig steigende Zahl von Publikationen zu diesem Thema vertieft unser Verständnis der zielgerichteten Modulierbarkeit neuroplastischer Prozesse, verbessert die methodische Herangehensweise, stärkt unsere Evidenzbasis und erhöht das Vertrauen in die Wirksamkeit und Sicherheit der Verfahren. Nicht zuletzt eröffnet die nichtinvasive Hirnstimulation neue therapeutische Fenster und trägt damit wesentlich zum Ziel der Verbesserung oder Wiederherstellung von Funktionen in der Rehabilitation bei. Im Bereich der neurologischen Rehabilitation haben sich nichtinvasive Stimulationsmethoden als Hoffnungsträger für die Behandlung von motorischen, sensorischen, aphasischen, affektiven und kognitiven Symptomen im klinischen Alltag erwiesen, obwohl Studien mit größeren Fallzahlen und mit einheitlicherer Methodik noch gefordert werden (Platz T., 2020; Fregni F., 2020).
Herausforderung: Paresen der oberen Extremität nach Schlaganfall
Nach einem Schlaganfall ist die Armparese eine der schwersten Folgen. Sie tritt bei 50–80% der Schlaganfallüberlebenden auf und beeinträchtigt die Aktivitäten des täglichen Lebens und die Autonomie der Betroffenen stark (Broeks J.G., 1999). Eine funktionelle Verbesserung der oberen Extremitäten (UL) bei Patienten mit einem leichten bis mittelschweren Schlaganfall tritt hauptsächlich innerhalb der ersten 8–12 Wochen nach dem Ereignis auf und ist sechs Monate danach weitgehend abgeschlossen (Winstein C. J., 2016).
In experimentellen, kinematisch kontrollierten Versuchsanordnungen, die den Einfluss kompensatorischer Substitutionsstrategien (z.B. Ausweichbewegungen, Gravitationskräfte, etc.) auf die Motorik der Handfunktion nach Schlaganfall ausschlossen, konnte gezeigt werden, dass die Erholung willkürlicher motorischer Funktionen der Arm/Hand-Kontrolle bereits nach 5 Wochen abgeschlossen war und sich danach nicht weiter verbesserten. Demgegenüber zeigten klinische Beurteilungsinstrumente wie z.B. der „Action Research Arm Test“ (ARAT) oder der Fugl-Meyer-Score (FMS) bis zu 52 Wochen nach dem Schlaganfall eine weitere Verbesserung. Die Autoren interpretieren diese Änderungen der klinischen Scores als implizite Unschärfe in der Differenzierung von tatsächlicher motorischer Erholung und Funktionsgewinn im Gegensatz zu kompensatorischen Mechanismen in der motorischen Bewegungskontrolle (Cortes J.C., 2017).
Nichtinvasive Hirnstimulation – tDCS und rTMS
Die nichtinvasive Hirnstimulation („non-invasive brain stimulation“ – NIBS) ist für Kliniker und Forscher von großem Interesse, da sie bei der Untersuchung der Gehirnphysiologie und -plastizität sowie bei der Behandlung und in der Erstellung von Prognosen bei Erkrankungen des Gehirns eine immer bedeutendere Rolle spielt. Mit der Entwicklung moderner Stimulatoren, die in der Routinetherapie leicht anzuwenden sind, wurde NIBS, z.B. transkranielle Magnetstimulation (TMS), repetitive transkranielle Magnetstimulation (rTMS), transkranielle Gleichstromstimulation („transcranial direct current stimulation“, tDCS), immer öfter im Rahmen der Rehabilitation nach Schlaganfällen eingesetzt. Die tDCS ist eine einfach durchführbare, kostengünstige, mobile und nahezu nebenwirkungsfreie Technik, bei der durch direkte elektrische Stimulation des Kortex über die Kopfhaut eine gerichtete Modulation der Erregbarkeit kortikaler und subkortikaler neuronaler Strukturen erzielbar ist. Dadurch können je nach Stimulationsprotokoll Lernprozesse moduliert bzw. im Sinne einer Fazilitation (LTP) oder Suppression (LTD) beeinflusst werden. In Kombination mit intensivem aufgabenspezifischem Training hat sich gezeigt, dass es funktionelle Ergebnisse in der Rehabilitation verbessern kann. Ähnliche Effekte wurden mit der rTMS bei Schlaganfallpatienten beobachtet (Elsner B., 2016; Bornheim S., 2020).
Effektaugmentation durch Tripeltherapie
Die tDCS ist ein nichtinvasives und nichtpharmakologisches Neuromodulationsverfahren, das nachweislich die kortikale Erregbarkeit moduliert und den Effekt des aufgabenspezifischen Trainings im Kontext der motorischen Erholung der oberen Extremität optimiert. Anodale tDCS über dem primären Motorkortex (M1) induziert eine Form der langfristigen synaptischen Plastizität, die eine aktivitätsabhängige Erhöhung des BDNF („brain derived neurotrophic factor“) erfordert (Fritsch B., 2010). Mittels intravenös verabreichter Biologika kann eine indirekte Augmenation der BDNF-Verfügbarkeit erzielt werden. Cerebrolysin® ist ein Neuropeptid-Biologikum mit neuroprotektiver und neurorestorativer Wirkung. Es fördert nachweislich die neuronale Keimung, verbessert das neuronale Überleben nach Hypoxie, stimuliert die Neurogenese und fördert die motorische Erholung bei Schlaganfallpatienten. Präklinische Studien haben gezeigt, dass das Biologikum mehrere Signalwege im ischämischen Gehirn induziert (z.B. „sonic hedgehog pathway“, tPA), die u.a. zu einer erhöhten Verfügbarkeit von BDNF (Alvarez A., 2016) an der Stelle der Läsion führen und dadurch, in Kombination mit aufgabenspezifischem Training und atDCS, selbst bei chronischen Schlaganfallpatienten ein Milieu erhöhter Neuroplastizität induzieren können (Zeiler S., 2018; Brainin M., 2018; Chopp M., 2013).
Während für andere pharmakologische Ansätze (z.B. SSRI, Dopamin) in der motorischen Schlaganfallrehabilitation in großen rezenten Arbeiten überwiegend enttäuschende Studienergebnisse vorliegen (TALOS 2017, FOCUS 2018, AFFINITY, 2020 EFFECTS 2019, DARS 2017), gibt es für Cerebrolysin® aufgrund der Evidenzlage aus randomisierten und kontrollierten Studien (CARS 2016) eine klare Empfehlung (Evidenzgrad Ia–IIb; ÖGSF 2018, DGNR 2020, EBRSR 2020) für einen frühzeitigen Einsatz nach Schlaganfall.
Induktion erhöhter neuronaler Plastizität
Wir stellen die Hypothese auf, dass die Kombination von Cerebrolysin® und atDCS ein Milieu verbesserter neuronaler Aktivität und Konnektivität induziert, möglicherweise durch Förderung der BDNF-vermittelten synaptischen Plastizität. Für BDNF konnte gezeigt werden, dass dessen Serumspiegel insbesondere nach schweren Schlaganfällen sowie in chronischen Phasen nach Schlaganfall deutlich vermindert sind. Man geht davon aus – und dies konnte auch in präklinischen Studien gezeigt werden –, dass BDNF nicht nur das molekulare Substrat für die anodale tDCS darstellt (Cocco S., 2018; Podda M., 2016), sondern dass BDNF als Downstream-CREB-induziertes Genprodukt eine physiologische Voraussetzung für motorische Erholung und LTP-induzierte Lernprozesse ist (Carmichael S.T., 2016).
Dieser Weg der Plastizitätsförderung ist im Gegensatz zur motorischen Erholung im Rahmen der biologischen Spontanremission lernabhängig (Hebb‘sche Lernregel) und beruht darauf, dass die elektrische Stimulation spezifischer Neurone des Motorkortex zu einer verstärkten synaptischen Übertragung führt. Eine weitere Voraussetzung für die Induktion behavioraler Plastizität ist die ausreichende Versorgung mit neuronalen Wachstumsfaktoren (z.B. BDNF, IGF, Neurotransmitter etc.). Elektrische Gleichstromstimulation gepaart mit der Verabreichung neurotropher Wachstumsfaktoren wie BDNF sowie einem funktionellen, intensiven motorischen Lernprogramm kann das Outcome der motorischen Erholung nach Schlaganfall fördern und möglicherweise die Wiederherstellung der motorischen Funktion verstärken.
Positive Signale aus explorativen Untersuchungen
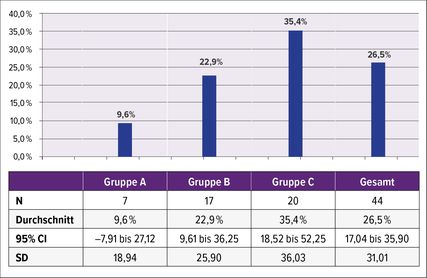
Abb. 1: Effekt einer Dreifachtherapie auf die Recovery bei Störungen der oberen Extremitäten nach einem Schlaganfall
In einer explorativen, retrospektiven Analyse von 44 konsekutiven Schlaganfallpatienten mit Funktionsstörung der oberen Extremität, die an der Klinik Pirawarth stationär aufgenommen wurden, wurden Patienten mit subakuten, chronischen ischämischen Infarkten (>4 Wochen) mit leichter bis mittelschwerer Beeinträchtigung der Arm/Hand-Motorik (ARAT > 12 Pkt.,) SAFE-Score > 4 Pkt.) unter Routinebedingungen (Abb.1) eingeschlossen. Die Patienten wurden in drei Gruppen eingeteilt: Die Patienten in Gruppe A erhielten täglich aufgabenspezifisches Training (mindestens 30 Minuten, 5 Tage/Woche) über 2 Wochen; die Patienten in Gruppe B erhielten täglich aufgabenspezifisches Training (mindestens 30 Minuten, 5 Tage/Woche) plus anodale tDCS (20 Minuten, 5 Tage/Woche) über 2 Wochen; die Patienten in Gruppe C erhielten zusätzlich eine tägliche morgendliche Infusion von Cerebrolysin® 30ml i.v. über 2 Wochen. Der primäre Endpunkt war der ARAT-Score am 14. Tag, definiert als proportionaler Erholungswert („proportional recovery rate“, %). Aufgrund der Gruppengröße sowie des explorativen Designs der Untersuchung wurde eine deskriptive statistische Analyse durchgeführt. Wir berechneten die Veränderungen im ARAT-Score (PPR %) nach 2 Wochen Behandlung (Abb.1). Im Vergleich zur Gruppe A waren die Veränderungen in Gruppe B und C wesentlich größer (A – 9,6% ; B – 22,9%, C – 35,4%). Die Patienten wiesen die höchsten numerischen Steigerungsraten der PPR% auf, wenn sie mit dem Dreifach-Therapieregime behandelt wurden, allerdings war dieser Unterschied aufgrund des explorativen Designs statistisch nicht signifikant (überlappende CI-Intervalle). Wie erwartet wurden die Behandlungen gut vertragen, und es wurden in beiden Gruppen keine Nebenwirkungen festgestellt.
IMPULSE-Studie
Die IMPULSE-Studie (IMPULSE trial – a prospective, multi-center, randomized, double-blind study on the stIMulation of brain Plasticity to improve Upper Limb recovery after StrokE) wird als multizentrische Phase-II-Studie an 7 österreichischen Schlaganfallzentren durchgeführt. IMPULSE soll in einem ersten Teil die Frage beantworten, ob diese Tripeltherapie auch unter kontrollierten Studienbedingungen an einer entsprechend großen Patientenzahl die positiven Signale aus explorativen Studien bestätigen kann. Begleitende Substudien widmen sich zudem der Rolle von BDNF als Marker der motorischen Erholung; EEG-Konnektivitätsanalysen sollen zum Nachweis adaptiver neuronaler Veränderungen durch die Tripeltherapie beitragen.
Die IMPULSE-Studie ist Teil des VASCAge-C-Programms, eines öffentlich finanzierten Forschungsprogramms (FFG) mit Partnern aus Wissenschaft und Industrie, das die Forschung sowie tiefere Einblicke in die Auswirkungen des Alterns auf das Gefäßsystem fördert. Trotz Verzögerung des Studienbeginns aufgrund der Corona-Pandemie ist geplant, erste Patienten noch im ersten Quartal 2021 einzuschließen.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Welchen Beitrag kann therapeutisches Drug-Monitoring leisten?
Bariatrische Operationen sind eine wirksame Strategie zur Gewichts-reduktion bei Adipositas. Die damit veränderte Anatomie kann die Bioverfügbarkeit von Arzneimitteln massgeblich ...
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...