Freund oder Feind?
Die beiden Supersysteme zentrales Nervensystem und Immunsystem steuern vielfältigste Funktionen im Organismus. Neurologen diskutierten bei der ANIM 2017, wie die beiden Organsysteme nach einem Schlaganfall interagieren. Zutage kamen zwei sehr unterschiedliche Aspekte: eine relativ rasch initiierte Immunreaktion im Hirngewebe, die zu einer weiter fortschreitenden Schädigung des Gewebes führt, sowie die langfristige Beteiligung des Immunsystems an der Regeneration des Zentralnervensystems.
Zum einen konnte man in Mausmodellen in von einem Schlaganfall betroffen Gehirnarealen viele unterschiedliche Entzündungszellen detektieren. Studiert man den zeitlichen Ablauf, wird evident, dass diese Immunzellen koordiniert und in Kaskaden in das Gehirn einwandern.1 Zum anderen fällt das Infarktvolumen nach einem induzierten Schlaganfall im Gehirn genetisch veränderter Mäuse ohne funktionierende Lymphozyten (Rag1-/-Mäuse) signifikant geringer aus.2, 3
„Die Entzündungsreaktion kann prinzipiell in zwei Kompartimenten stattfinden: im Blutgefäß, die sogenannte Thromboinflammation, und im Gewebe als sogenannte sterile Inflammation“, erläuterte Professor Dr. Tim Magnus, Universitätsklinikum Hamburg-Eppendorf. „Dies sind wahrscheinlich zum Teil parallel ablaufende Entzündungsreaktionen.“ Im Gefäß sind verschiedene Faktoren daran beteiligt,4 ebenso im Hirngewebe: Das Team rund um Prof. Magnus zeigte, dass sogenannte Gefahrensignale, die beim Zelluntergang aus Nervenzellen austreten, die Umgebung über die „drohende Gefahr“ informieren. Diese reagiert mit der Produktion von Chemokinen, die locken wiederum verschiedene Entzündungszellen an, welche das Hirngewebe weiter schädigen.1, 5–7
Besteht die Möglichkeit die in Mausmodellen gewonnenen Erkenntnisse auch auf den Menschen zu übertragen? „Man sieht, dass die Komponenten der Kaskaden in beiden Organismen relativ ähnlich sind.5 Dies ist nicht verwunderlich – die Entzündungsreaktion wurde ursprünglich zur Bekämpfung von Bakterien eingerichtet. Im Laufe der Evolution wurde sie allerdings vom Organismus zum Beseitigen von Gewebsuntergängen adaptiert – im Gehirn laufen wir da in Komplikationen rein“, so Prof. Magnus.
Neue Therapieoptionen
Es stellt sich nun die Frage, ob die durch eine solche Entzündungsreaktion hervorgerufene Schädigung des Gehirngewebes aufgehalten werden kann. Fingolimod, ein Wirkstoff zur Behandlung der Entzündungserkrankung Multiple Sklerose, kann im experimentellen Aufbau das Ausmaß eines Schlaganfalls signifikant reduzieren. Dies geschieht sowohl auf der Ebene der Anzahl intravaskulärer T-Lymphozyten im Gehirn als auch auf jener der Schlaganfallvolumina.8, 9 „Das sind erste Hinweise darauf, dass solche Interventionen effektiv sein können. Ergebnisse aus unserer eigenen Forschungsgruppe zeigen zudem, dass bei Mäusen, deren IL-17-Signaltransduktionsweg unterbrochen wurde, die Schlaganfallvolumina geringer ausfallen und die Tiere auch klinisch besser abschneiden“,5 berichtet Prof. Magnus, „Man kann bis zu sechs Stunden nach dem Schlaganfall mit der Behandlung beginnen und erzielt noch immer eine erfolgreiche Blockade der Ausbreitung des Gewebsuntergangs.“
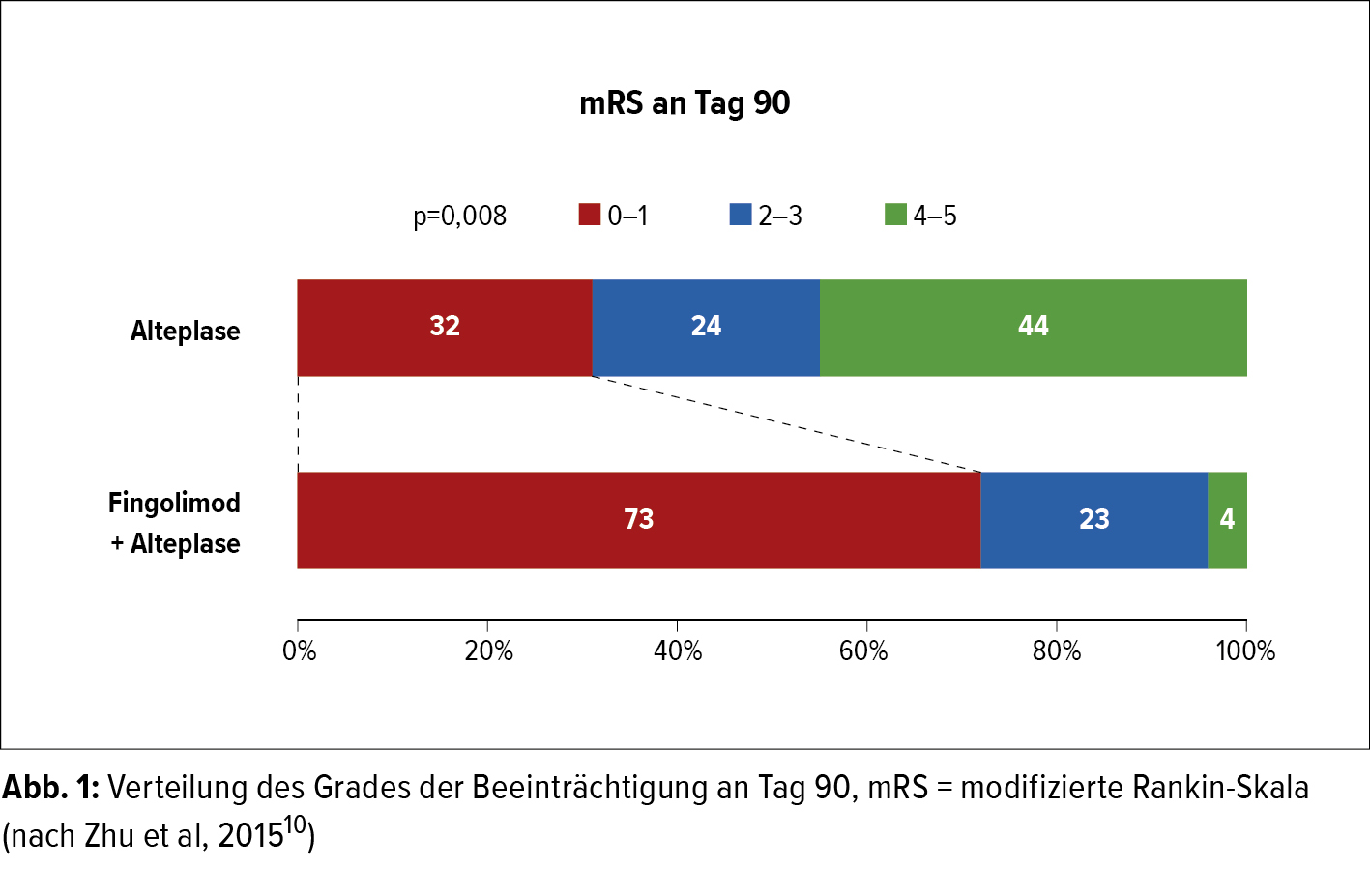
Ob diese Ergebnisse auch für die Behandlung von Schlaganfallpatienten umgesetzt werden können, ist noch unklar, denn humane Studien sind bisher noch nicht aussagekräftig. „Das letzte Wort ist hier aber noch nicht gesprochen. Wir gehen davon aus, dass ein Schlaganfall, wenn er einmal auftritt, sich noch weiter ausbreitet. Eine Multicenterstudie aus China,10 die mittlerweile in eine Phase-III-Studie übergegangen ist, hat gezeigt, dass die Zunahme des Infarktvolumens im Gehirn unter Fingolimod deutlich reduziert war“, erläuterte Prof. Magnus. Patienten, die zusätzlich zur Lysetherapie Fingolimod erhalten hatten, zeigten ein deutlich besseres Outcome als jene, die nur einer Lysetherapie unterzogen wurden (Abb. 1). „Man muss allerdings anmerken, dass diese Studie auf einer relativ kleinen Kohorte basiert und nicht verblindet war“, so der Neurologe.
Im vor wenigen Wochen publizierten ACTION Trial11 wurde bei Patienten mit akuten ischämischen Schlaganfällen eine einmalige Gabe von Natalizumab gegenüber Placebo getestet. „In den ACTION Trial waren viele verschiedene Schlaganfallgruppen eingeschlossen. Auch hier war die Kohorte nicht sehr groß, daher ist das Ergebnis mit Vorsicht zu genießen“, betonte Prof. Magnus. Primärer Zieltherapiepunkt war die Zunahme des Infarktvolumens relativ zur Basislinie im MR. Hier konnte kein Unterschied zwischen den Gruppen Natalizumab und Placebo festgestellt werden. „Bei einigen sekundären Outcomes hingegen wurde ein besseres Abschneiden der Natalizumab-Gruppe gegenüber der Placebogruppe beobachtet“, erläuterte der Neurologe. Es sei allerdings noch unklar, ob dies als Hinweis gewertet werden könne, dass solche Therapien beim Menschen wirklich wirksam seien. Eine weitere Studie soll diese Ergebnisse in einer größeren Kohorte bestätigen.
Keine Regeneration ohne Immunsystem
Die Auswirkungen des Immunsystems nach einem Schlaganfall sind aber nicht ausschließlich negativ. Viele Funktionen, die bei Patienten nach einem Schlaganfall beeinträchtigt sind, können wieder erlernt werden – das Gehirn ist auch in fortgeschrittenem Alter noch regenerationsfähig. Wie hängt diese Plastizität mit dem Immunsystem zusammen? „Die Vorgänge in den ersten Tagen nach einem Schlaganfall sind extrem gut verstanden. Man weiß, wann welche Immunzellen im Gehirn einwandern, was sie da machen und wie man sie blockieren kann, um einen Gewebsuntergang zu verhindern. Was in den Wochen und Monaten danach passiert, beginnen wir erst zu verstehen“, erklärte Prof. Dr. Jens Minnerup, Universitätsklinikum Münster.
Untersucht wurde dies in einem Mausmodell, in dem mittels photothrombotischer Ischämie kleine kortikale Infarkte ausgelöst wurden. Diese Infarkte führten zu subtilen Beeinträchtigungen bei gleichzeitig hoher Überlebensrate und langer Überlebenszeit der Tiere, die so über einen Zeitraum von 46 Tagen physiotherapeutisch behandelt werden konnten.12, 13 Die Auswirkung der Therapie auf die trainingsinduzierte Regeneration von sensorischen und motorischen Funktionen wurde mit dem Adhesive-Tape-Test und dem Foot-Fault-Test erfasst.
Forciertes Training induziert funktionelle Erholung
„Genetisch unveränderte Tiere reagieren auf das Physiotherapietraining mit einer signifikanten Verbesserung der sensorischen und motorischen Funktionen. In Rag1-/-Mäusen bleibt dieser Erfolg aus – ein erster Hinweis darauf, dass für die trainingsinduzierte Regeneration Lymphozyten notwendig sind“, berichtete Prof. Minnerup. In einer weiteren Versuchsserie zeigte das Forscherteam mittels adoptiven Zelltransfers in Rag1-/-Mäusen, dass speziell die regulatorischen T-Zellpopulationen für den rehabilitativen Trainingserfolg verantwortlich waren. Die Trainingsdefizite wurden durch den Zelltransfer ausgeglichen. Die Behandlung mit T-Zellen ohne anschließendes Training führte zu keiner signifikanten Regeneration.
Die Infarktvolumina, welche 49 Tage nach Induktion der Ischämie gemessen wurden, waren in allen für die Versuche herangezogenen genetischen Mausmodellen sehr ähnlich. „Wir haben nichts anderes erwartet, da wir den adaptiven Zelltransfer später als 24 Stunden nach dem Infarkt durchgeführt haben. Für uns sind diese Ergebnisse ein starker Hinweis darauf, dass es hier nicht um Schadenskaskaden und Gewebsuntergang geht, sondern um echte Plastizität im Gehirn“, so der Neurologe. Potenzielle Mechanismen, die der trainingsinduzierten Regeneration unterliegen, werden derzeit erforscht. Eine durch das Training gesteigerte Rate der Infiltration regulatorischer T-Zellen, trainingsinduzierte Neurogenese und trainingsinduziertes axonales Sprouting kommen nach ersten Untersuchungen hierbei infrage. „Die im Symposium vorgestellten Erkenntnisse sind einerseits von großem wissenschaftlichem Interesse, weil sie zeigen, wie komplex zwei Supersysteme des menschlichem Organismus interagieren“, schloss Prof. Minnerup, „Andererseits bilden sie die Grundlage für zukünftige Therapien von Schlaganfallpatienten.“
Quelle: Arbeitstagung NeuroIntensivMedizin (ANIM), 16.–18. Februar 2017, Wien
1 Gelderblom et al: Stroke 2009; 40(5): 1849-57 2 Kleinschnitz C et al: Blood 2010; 115(18): 3835-42 3 Yilmaz G et al: Circulation 2006; 113(17): 2105-12 4 De Meyer et al: Stroke 2016; 47(4): 1165-72 5 Gelderblom et al: Blood 2012; 120(18): 3793-802 6 Ludewig et al: Circ Res 2013; 113(8):1013-22 7 Gelderblom et al: Stroke 2014; 45(11): 3395-402 8 Kraft et al: Stroke 2013; 44(11): 3202-10 9 Schuhmann et al: J Cereb Blood Folow Metab 2015; 35(1): 6-10 10 Zhu et al: Circulation 2015; 132(12): 1104-12 11 Elkins J et al: Lancet Neurol 2017; 16(3): 217-26 12 Schmidt A et al: Stroke 2014: 45(1): 239-47 13 Schmidt A et al: Exp Transl Stroke Med 2012 4(1): 13
Das könnte Sie auch interessieren:
Menschen mit Demenz: Was beeinflusst deren Überleben nach Diagnosestellung?
Verschiedenste Faktoren beeinflussen die Überlebenszeit nach einer Demenzdiagnose. Das Wissen um Risikofaktoren zum Zeitpunkt der Diagnose einer Demenzerkrankung oder in deren Verlauf ...
Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...